[导读] 作者:病理小言
前文:子宫内膜去分化癌伴错配修复蛋白缺失
定义
子宫内膜去分化癌由未分化癌和分化癌(通常为FIGO1级或2级子宫内膜样癌)混合组成。其中,子宫内膜未分化癌是一种没有明显细胞系分化的恶性上皮性肿瘤。
未分化癌与并存的分化癌呈克隆性相关,表明未分化癌是通过从潜在的分化癌成分发生了去分化过程而产生的。具有错配修复蛋白缺陷/高微卫星不稳定性的子宫内膜癌似乎更容易发生去分化,因为大约一半到三分之二的去分化癌和大约一半的未分化癌具有错配修复缺陷/微卫星不稳定。
去分化/未分化癌也可能发生在其他分子环境中,低拷贝数的子宫内膜样癌是第二常见的分子亚组,其次是POLE突变或TP53突变的癌。超过一半的肿瘤发现了涉及PTEN、PIK3CA和/或PIK3R1的激活Pl3K通路突变,这些突变存在于分化癌和未分化癌的成分中。在大约三分之二的去分化癌和大约一半的未分化癌中,涉及核心SWI/SNF复合蛋白的失活突变与去分化,这导致未分化癌成分中SMARCA4(BRG1)、SMARCB1(IN1)以及ARID1A和ARID1B的表达缺失。
大体检查
大多数未分化癌形成巨大、息肉状、宫腔内肿块,大小范围2-15cm。常见坏死。大多数肿瘤累及子宫体;然而,许多肿瘤累犯子宫下段。
组织病理学
单形性未分化癌
肿瘤由大小相对均匀的、小到中等的、不粘附的细胞组成,这些细胞成片排列,没有任何明显的巢状或小梁状结构,类似于淋巴瘤、浆细胞瘤、高级别子宫内膜间质肉瘤或小细胞癌。不存在腺体形成;然而,可以看到突然角化。核染色质通常凝缩,核分裂象常见(>25个/2mm²,相当于视野直径0.55mm、视野面积0.24mm²中>30个/10HPF)。偶尔肿瘤可有横纹肌样形态。间质通常不明显,部分肿瘤有黏液样基质。肿瘤浸润性淋巴细胞通常很多。常见地图样坏死。
去分化癌
几乎40%的单形性未分化癌含有分化癌,成为第二种成分,最常见类型的是FIGO 1级或2级子宫内膜样癌,但高级别癌(如FIGO 3级子宫内膜状癌和浆液性癌)也有罕见报道。这两种成分的比例可以变化,两种成分之间的间隔显得很突然(呈现双相性外观),或混杂存在。
免疫组织化学
未分化癌仅有少数肿瘤细胞显示上皮分化的证据,通常EMA和角蛋白具有非常局灶性但强阳性的核周点状染色;不应出现广谱角蛋白(PCK)的弥漫性强阳性。由于PCK在这些肿瘤中通常是完全阴性,因此建议使用多种上皮标记物来确认上皮起源。在上皮分化的标志物中,CK8/18和EMA更可能呈阳性。肿瘤细胞表达波形蛋白,但不表达ER、PR或E-cadherin。PAX8通常是阴性,但也可能有散在的单个或小簇细胞呈局灶性阳性。
少数肿瘤细胞也可能表达CgA和/或Syn,通常<10%。大约三分之一的子宫内膜未分化癌可见SMARCA4(BRG1)表达缺失。
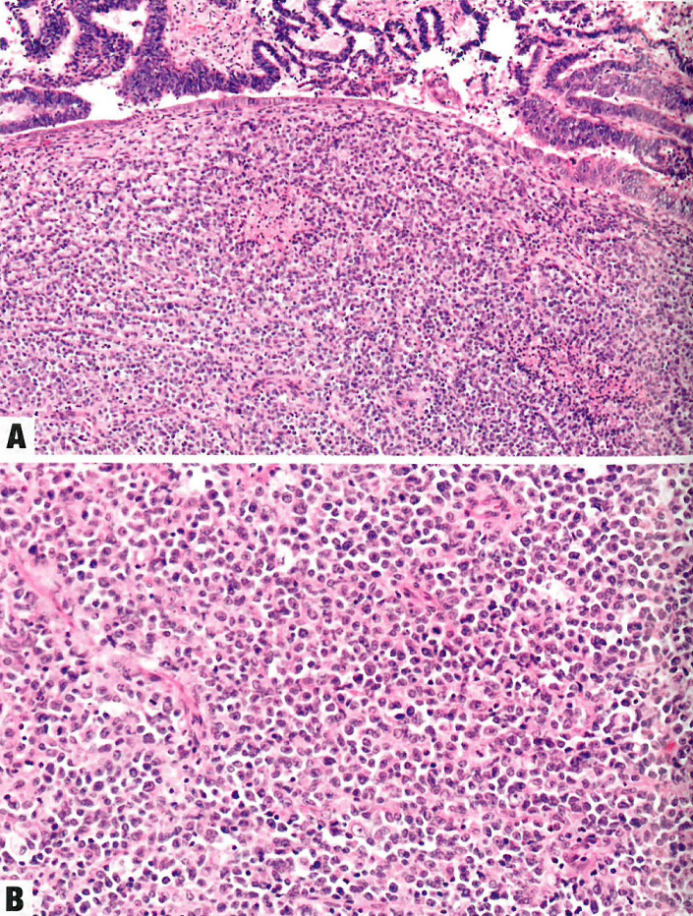
图1 去分化子宫内膜癌。A 分化和去分化区域有明显边界。B 高倍,显示未分化成分的小圆细胞。
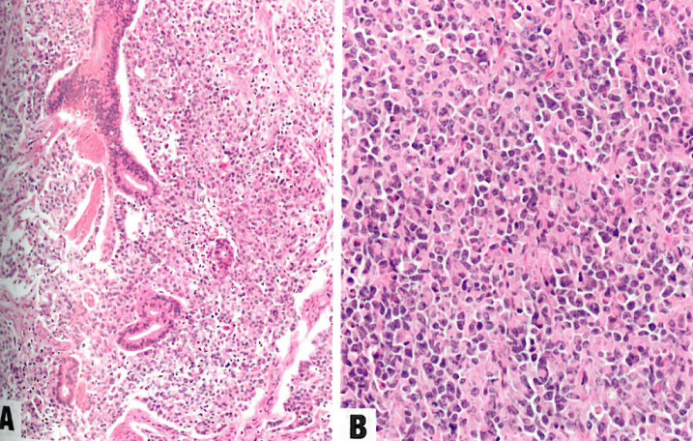
图2 去分化子宫内膜癌。A 肿瘤显示混杂的子宫内膜样和未分化成分。B 高倍,显示横纹肌样特征。
鉴别诊断
未分化癌可能与FIGO 3级子宫内膜样腺癌、高级别神经内分泌癌(NEC)和浆液性癌的实性成分相混淆。支持未分化癌诊断的特征包括不粘附的细胞形态、免疫组织化学PAX8阴性、角蛋白减少/阴性以及神经内分泌标志物阳性<10%。
诊断标准
必要标准:未分化组织学和免疫表型(用于未分化癌/成分)。
理想标准:遗传学分析或免疫组化显示:SMARCA4(BRG1)和SMARCB1(INI1)的失活突变或失表达,或同时伴ARID1A和ARID1B的失活突变或失表达。
分期
根据国际癌症控制联盟(UICC)TNM分类和FIGO分期系统进行分期。
预后和预测
这些肿瘤通常具有高度侵袭性,55-95%的病例复发或死于疾病。未分化癌成分的存在,无论占比如何,都预示着预后较差;因此,将这种肿瘤与FIGO 3级子宫内膜样癌区分开来具有临床意义。然而,POLE核酸外切酶结构域突变的存在提示预后较好。与存在SWI/SNF的肿瘤相比,显示核心SWI/SNF蛋白缺乏的肿瘤似乎侵袭性更强。错配修复蛋白缺乏似乎不是预后因素,但它可能会在合适的患者中提示额外的治疗选择(即免疫疗法)。
错配修复蛋白缺失的解读与建议
目前的FIGO分期强调对非侵袭性与侵袭性组织学肿瘤类型的识别以及子宫内膜肿瘤的分子亚分类。
非侵袭性肿瘤类型包括FIGO 1级和2级子宫内膜样癌(EEC)和黏液癌(胃肠型除外)。这些低级别肿瘤预后良好,一般不需要新辅助治疗。所有其他组织学类型都是侵袭性:3级子宫内膜样癌、浆液性癌、透明细胞癌、中肾样癌、胃肠型黏液癌、混合癌、癌肉瘤和未分化癌。
在FIGO的所有分期中,不强制、但强力建议增加分子分类,尤其是对于高级别子宫内膜样癌。该预测信息作为下标添加到FIGO分期“m”(分子)的修饰语中。例如,分期IAmPOLEmut是一种局限于子宫或伴宫颈蔓延的POLE突变性癌,无论LVSI的程度或组织学类型如何。转移性浆液性癌分期为Ⅳmp53mut。POLE突变和p53异常发现改变了早期疾病的FIGO 分期;其他类型则没有。建议对所有子宫内膜肿瘤进行完整的分子分类,并可以在活检标本中进行,但并非所有实验室都能进行所有的检测。一种简单的方法是使用3种免疫组织化学(IHC)标记物(p53、MSH6、PMS2)和一种分子标记物(POLE突变分析)将肿瘤分为4类:POLEmut、MMRd、NSMP和p53abn。少数病例的结果可能不止一个分类(“多重分类”)。那些POLEmut或MMRd伴p53abn的分类不应被归类为p53abn中。研究仍在进行中,但大多数这样的病例预后更好,应当就这样分类。如果肿瘤同时存在POLE突变和MMR缺陷,则考虑做林奇综合征的基因检测。
本例为FIGO 1AmMMRd。随后的分子分型(TCGA分型)为MSI-H型,基因检测为非林奇综合征。
附1:DNA错配修复检测结果报告模板
版本号:1.0.0.2
发布日期:2021年6月
本生物标志物模板非认证必需材料,但可用于协助符合CAP认证项目要求
认证要求
完成本模板是实施生物标志物检测和/或提供结果解读实验室的责任。当检测与解读均由其他机构(如参考实验室)完成时,也鼓励送检组织实验室采用清单式报告,以确保患者病历包含完整信息,便于临床治疗团队随时查阅。本模板非认证必需材料。
如无特别说明,请选择单项回答
DNA错配修复检测
+样本部位:_________________
+检测组织块编号(请注明):_________________
+错配修复(MMR)蛋白免疫组化(IHC)结果(可多选)
___ MLH1
+MLH1检测结果
___ 细胞核表达完整
___ 细胞核表达缺失
___ 无法判定(说明):_________________
___ MSH2
+MSH2检测结果
___ 细胞核表达完整
___ 细胞核表达缺失
___ 无法判定(说明):_________________
___ MSH6
+MSH6检测结果
___ 细胞核表达完整
___ 细胞核表达缺失
___ 无法判定(说明):_________________
___ PMS2
+PMS2检测结果
___ 细胞核表达完整
___ 细胞核表达缺失
___ 无法判定(说明):_________________
___ 背景非肿瘤组织/内对照显示完整细胞核表达
+错配修复(MMR)结果解读
___ 未发现MMR蛋白核表达缺失:无错配修复缺陷证据(MSI-H可能性低)
___ 一个或多个MMR蛋白核表达缺失:存在错配修复缺陷
+微卫星不稳定性(MSI)结果解读
___ 微卫星稳定(MSS)
___ 微卫星低度不稳定(MSI-L)
___ 1-29%的标记物显示不稳定性
___ 5个NCI或单核苷酸标记物中有1个显示不稳定性
___ 其他(说明):_________________
___ 微卫星高度不稳定(MSI-H)
___ ≥30%的标记物显示不稳定性
___ 5个NCI或单核苷酸标记物中有2个及以上显示不稳定性
___ 其他(说明):_________________
___ 微卫星不稳定性无法判定(说明):______________
存在微卫星高度不稳定性(MSI-H)/错配修复缺陷也可能是林奇综合征附加检测和遗传咨询的指征。
MLH1和PMS2的异质性表达在子宫内膜癌中较为罕见(约占病例的3%)。目前尚不清楚其他癌症类型中异质性表达的发生率及其对预测检查点抑制剂敏感性的影响。
注解
注解:______________
附2:林奇综合征筛查流程
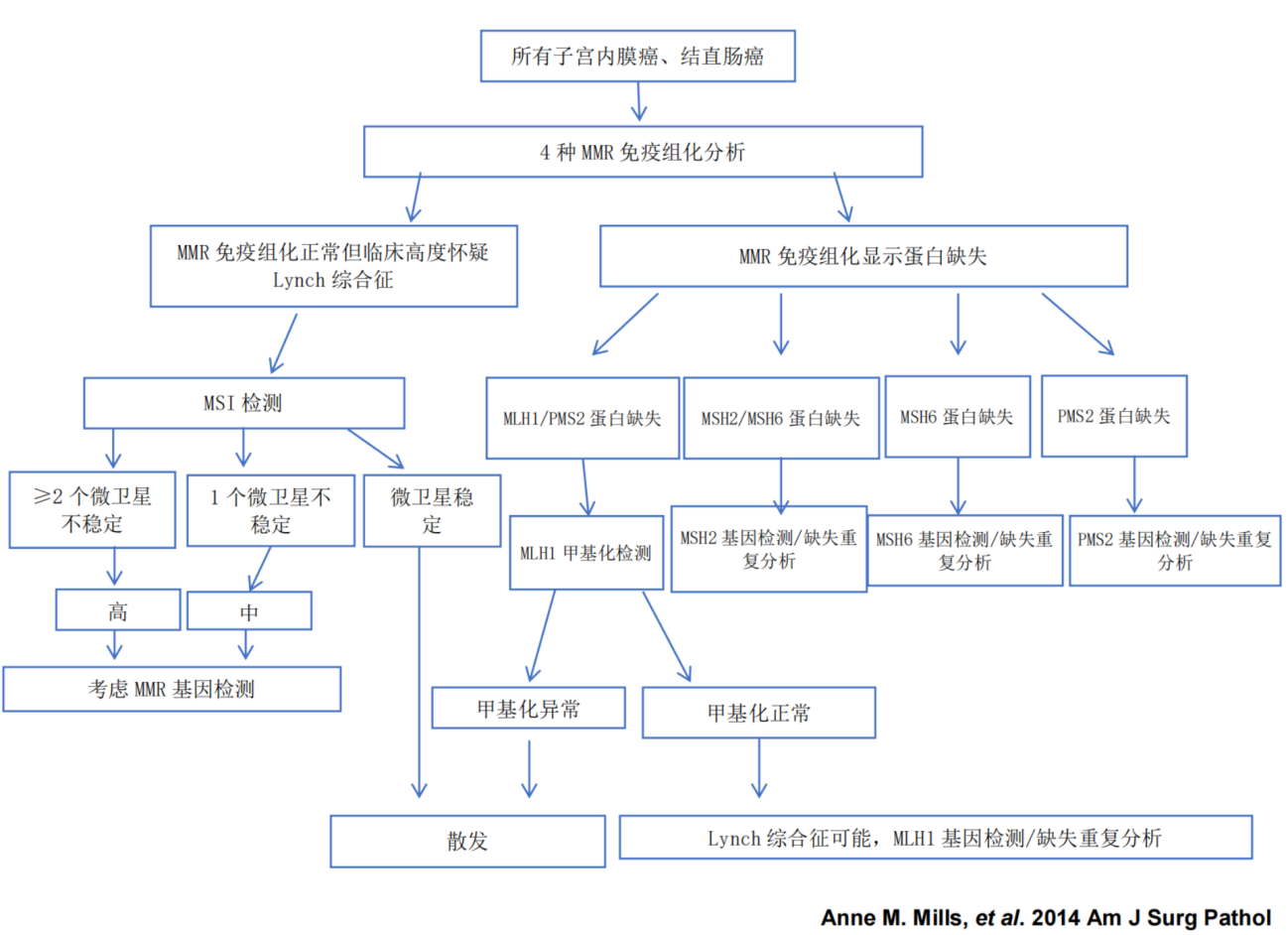
附3 本例分子检测的主要结果
MMR胚系评估:未检出致病性/可能致病性变异,表明本例不是林奇综合征
TCGA分型:MSI-H型
主要参考文献:
女性生殖肿瘤WHO分类第5版;CAP病理报告模板
















共0条评论