[导读] 编译整理:魏建国,王强
涎腺癌
黏液表皮样癌
黏液表皮样癌是涎腺癌中最常见的类型。该肿瘤可以发生于任何涎腺,也可发生于浆黏液腺或类似腺体,但约半数发生于大腺体。患者年龄分布宽泛,也是儿童涎腺癌中最常见的类型。该肿瘤的遗传学特征是有涉及MAML2的融合,最常见配体为CRTC1;约5%的病例中配体为CRTC3。除此之外的其他配体罕见。对于黏液表皮样癌来说,大部分情况下首选FISH检测,融合配体和断裂探针检测结果之间的一致性非常好。
虽然并非所有黏液表皮样癌病例都有MAML2融合,但大部分病例如此,且迄今为止这一特点在涎腺肿瘤中用于黏液表皮样癌的诊断也有特异性。不过,很多此前被诊断为黏液表皮样癌的病例随诊分子检测的应用增多,目前则更精准的被诊断为了其他类型肿瘤。此外,将MAML2融合作为黏液表皮样癌诊断的金标准可以让病理医师拓展这一瘤种的形态学谱系。
形态学上,黏液表皮样癌为“三相型”肿瘤,具体为比例不一的黏液细胞、表皮样(鳞状)细胞、所谓的中间型细胞构成,前两者也是该肿瘤得名的部分原因。也常见部分柱状细胞,且所有这些类型的细胞都可以出现透明改变或嗜酸性改变。该肿瘤的诊断一般较为容易,仅根据常规切片即可做出诊断而无需特殊检测。对于形态典型者,一方面无需分子检测,另一方面即使分子检测结果MAML2融合阴性也不影响诊断。由于融合配体的不同不存在预后意义或治疗意义,因此对于诊断明确的黏液表皮样癌真的没有必要进行分子检测。但另一方面,对于非典型或形态学有变异的病例来说,分子检测MAML2融合还是有很大帮助的。
嗜酸细胞性黏液表皮样癌是仅为、或几乎仅为嗜酸性细胞构成的肿瘤,因此很可能与其他嗜酸细胞性肿瘤混淆,如嗜酸细胞瘤、多结节性嗜酸细胞性增生。如果考虑嗜酸细胞性黏液表皮样癌但经广泛取材也未见经典黏液表皮样癌成分,则MAML2检测非常有帮助。实际上也没有其他检测有助于诊断。P40弥漫阳性、黏液染色在细胞间有黏液,也支持嗜酸细胞性黏液表皮样癌的诊断;但无这些特征不能排除嗜酸细胞性黏液表皮样癌。
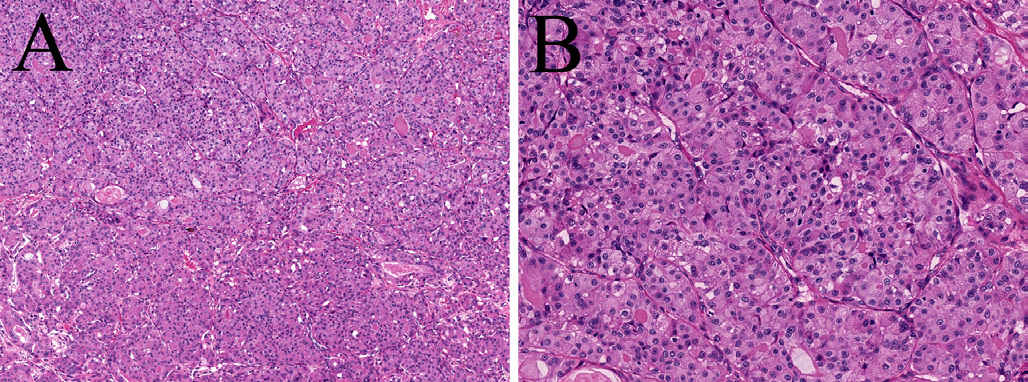 图4.本例支气管肿瘤,为嗜酸性细胞构成背靠背的巢状,有轻度非典型;本例有CRTC1::MAML2融合,提示嗜酸细胞性黏液表皮样癌。
图4.本例支气管肿瘤,为嗜酸性细胞构成背靠背的巢状,有轻度非典型;本例有CRTC1::MAML2融合,提示嗜酸细胞性黏液表皮样癌。
Warthin样黏液表皮样癌为新认识的亚型,因其非常类似Warthin瘤而值得关注。这两种肿瘤均为伴显著淋巴细胞间质的大囊表现,衬覆无明显非典型的多层上皮。与真正的Warthin瘤相似,Warthin样黏液表皮样癌也可以发生于腮腺内淋巴结中。与所有的少见亚型一样,充分取材是最有帮助的,因为可能会发现小灶的经典型黏液表皮样癌从而大大降低诊断难度。不过,没有经典成分的情况下,Warthin样黏液表皮样癌与良性肿瘤(如Warthin瘤、囊腺瘤)的鉴别可能极为困难。有极为明确的双层嗜酸性细胞、即使局灶性,也足以排除Warthin样黏液表皮样癌;但无此特征的情况下,MAML2检测则可以确诊、或排除这一形态貌似温和的黏液表皮样癌。
 图5.Warthin样黏液表皮样癌,低倍镜下非常类似Warthin瘤。病变境界清楚、囊性,伴淋巴细胞性间质。高倍镜下,囊壁衬覆细胞虽然形态温和,但排列无序,并不是那么显著的嗜酸性,且有不规则出芽。
图5.Warthin样黏液表皮样癌,低倍镜下非常类似Warthin瘤。病变境界清楚、囊性,伴淋巴细胞性间质。高倍镜下,囊壁衬覆细胞虽然形态温和,但排列无序,并不是那么显著的嗜酸性,且有不规则出芽。
黏液表皮样癌中还有很多需MAML2检测来明确诊断的罕见亚型。纤毛状黏液表皮样癌在其他方面都类似典型肿瘤,但因为存在纤毛这一几乎从未出现过的细微结构,因此需要进行这一检测确诊。黏液腺泡癌也是黏液表皮样癌的一种类型,即反常的出现腺泡分化,这一特征以前被视为腺泡细胞癌特有;NOR1阴性、MAML2阳性可证实为黏液表皮样癌的形态之一。与此类似,梭形细胞成分、无鳞状分化目前都认为是黏液表皮样癌的形态学谱系,这都得益于MAML2检测。
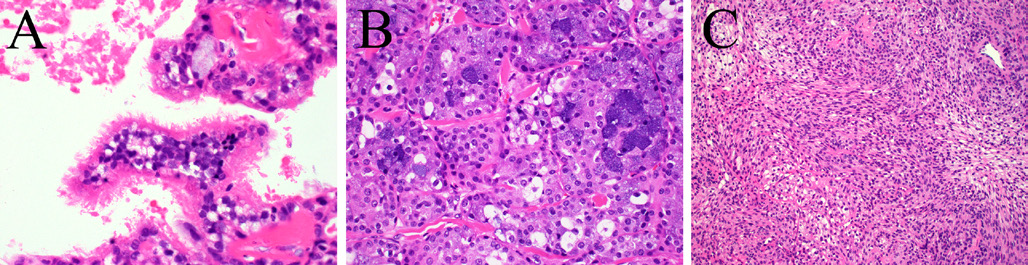 图6.罕见类型的黏液表皮样癌:(A)纤毛状;(B)腺泡分化;(C)梭形表现。
图6.罕见类型的黏液表皮样癌:(A)纤毛状;(B)腺泡分化;(C)梭形表现。
分泌性癌
分泌性癌是由闰管型细胞构成的涎腺腺癌,其特点是形态学、免疫组化特征、遗传学特征都和分泌性乳腺癌相似。分泌性癌最常见累及腮腺(约70%),其次为口腔(20%)和下颌下腺(8%),其余部位则罕见。
分泌性癌中检出的第一个遗传学异常是ETV6::NTRK3融合导致平衡易位t(p13;q25),且目前来说也是这一异常最为常见。后续又发现了ETV6的其他融合配体、以及非ETV6或NTRK3的罕见融合。目前还不清楚分泌性癌中具体融合的相关意义。
如其他融合驱动的涎腺癌一样,已有多项技术可以对分泌性癌进行分子检测。针对ETV6重排的断裂探针进行FISH检测可以检出大部分病例,但不会像RNA测序那样确定配体基因。一般无需了解配体,除非对侵袭性病例准备进行NTRK或RET的靶向治疗。也可以进行免疫组化pan-Trk检测,但没有分子检测的特异性,且会漏掉非NTRK3的融合;但是这一方法快捷、便宜,且90%以上的病例为阳性。
最初刚认识分泌性癌的时候,大部分病理医师都会做些分子检测来证实是分泌性癌这一新病种。随着病理医师对它逐渐熟悉,分子检测也不再那么重要了。相应的,本文作者只有在诊断困难的病例中才做证实性的融合分析。高级别转化可能会掩盖分泌性癌的表现,此时分子检测不仅可以证实为分泌性癌的诊断,还可以从分子基础上找到治疗靶点。对于低级别分泌性癌来说,则要注意鉴别其他的低级别癌。分泌性癌、微分泌性腺癌、导管内癌、多形性腺癌等,都是S100弥漫阳性、且常表达mammaglobin的闰管样细胞构成。一个相对容易的鉴别方案就是免疫组化pan-Trk检测作为筛查:如果阳性,则支持分泌性癌的诊断;但如果阴性,则需较广泛的融合检测。
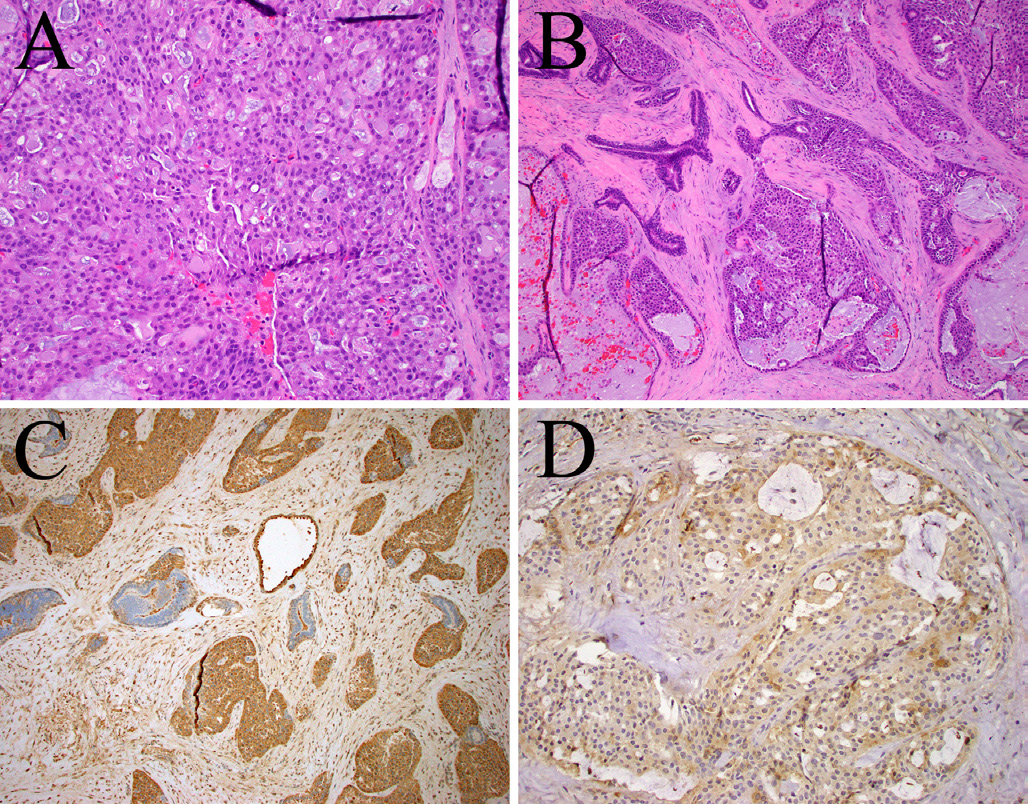 图7.本例腮腺肿瘤在很多方面类似分泌性癌,但却有少见的导管中心性生长方式,且免疫组化mammaglobin阳性(C);Pan-Trk无细胞核着色(D),提示并无ETV6::NTRK3融合;其实本例RNA测序发现有ETV6::RET的融合。
图7.本例腮腺肿瘤在很多方面类似分泌性癌,但却有少见的导管中心性生长方式,且免疫组化mammaglobin阳性(C);Pan-Trk无细胞核着色(D),提示并无ETV6::NTRK3融合;其实本例RNA测序发现有ETV6::RET的融合。
——未完待续——
往期回顾:
攻城略地的分子病理-涎腺肿瘤中的基因融合(一)

















共0条评论