[导读] 编译整理:魏建国,王强
关于肿瘤性病变中遗传学改变的相关知识,近些年呈爆发性增长,涎腺肿瘤也不例外。甚至有专家认为,目前的临床实践已难以跟上分子研究的进展。更有人提出,如果从分子角度考虑,不进行相关检测的情况下,病理医师已经难以做出诊断。事实真的如此吗?
《J Clin Pathol》曾就涎腺肿瘤中的基因融合刊发了专家Bishop的综述文章,其中详尽介绍了具有基因融合的涎腺肿瘤相关特征,并重点介绍了分子检测在病理诊断中的实际应用。当然,本文并不涉及细胞病理相关问题,也不涉及作为涎腺肿瘤极为罕见、且并无独特之处的间叶性肿瘤。为帮助大家更好的了解相关知识点并指导临床实践,我们将该文要点编译介绍如下。
良性涎腺肿瘤
多形性腺瘤
多形性腺瘤是最常见的涎腺肿瘤类型,约占所有涎腺肿瘤的半数。该肿瘤大、小涎腺均可发生,但最常见发生于腮腺。涎腺肿瘤中发现的第一个融合基因就是活化的多形性腺瘤基因1(PLAG1)与CTNNB1的融合;此后又发现了PLAG1的诸多其他配体,如LIFR、CHCHD7、TCEA1、BOC、FGFR1。
多形性腺瘤中第二常见的融合基因是HMGA2,其配体也有很多,具体如FHIT、NFIB、WIF1。总体而言,50%以上的多形性腺瘤具有PLAG1的融合,而HMGA2融合的比例为15-35%不等,且二者是互斥的。当然,并非所有的多形性腺瘤都是融合阳性的,且PLAG1和HMGA2的驱动性改变并不都是基因融合。
多形性腺瘤的诊断一般不是特别困难,也无需任何特殊检查。但个别情况下,确定有PLAG1或HMGA2的融合有助于诊断。从检测方法来说,由于二者的融合配体变化较多,因此断裂探针FISH检测很有吸引力;二代测序的优势在于可以确定出具体的融合配体,但目前为止这一信息的意义有限。二代测序还可以检出其他非融合的基因改变,如结构改变、扩增。
免疫组化检测PLAG1及HMGA2也已广泛应用,文献中的说法是实际工作中结果可靠,但根据本文原作者经验,尤其HMGA2其实特异性并不理想。其实一定要认识到,PLAG1和HMGA2融合并非多形性腺瘤所特有,肌上皮瘤和肌上皮癌也会有这类融合,且融合阳性多形性腺瘤中发生的癌也会保留有多形性腺瘤相关的融合。因此,缺乏特异性也是融合检测对于实际诊断帮助甚少的主要原因。
融合检测有助于多形性腺瘤病理诊断的情况,主要是不满足相关诊断标准的病例中。需要介绍的就是最近发现也有多形性腺瘤相同融合、且生物学行为相似的嗜酸细胞性多形性腺瘤和梁状(小管腺瘤样)多形性腺瘤。此外,这些亚型的多形性腺瘤有时候组织学会存在经典表现的多形性腺瘤,因此目前认为也是多形性腺瘤,但可能完全为单一表现而并无传统诊断多形性腺瘤所需的导管、肌上皮细胞、软骨黏液样间质。
嗜酸细胞性多形性腺瘤仅为、或几乎全部是嗜酸性肌上皮细胞构成,这类细胞强阳性表达SOX10和S100,但其他肌上皮标记仅局灶阳性、或阴性。该肿瘤的细胞核一般有退行性表现的非典型,但核分裂活性低。有文献在该肿瘤中发现有PLAG1融合,相应配体有ZBTB47-AS1、GEM、CHCHD7、NTF3、FBXO32、C1orf116。
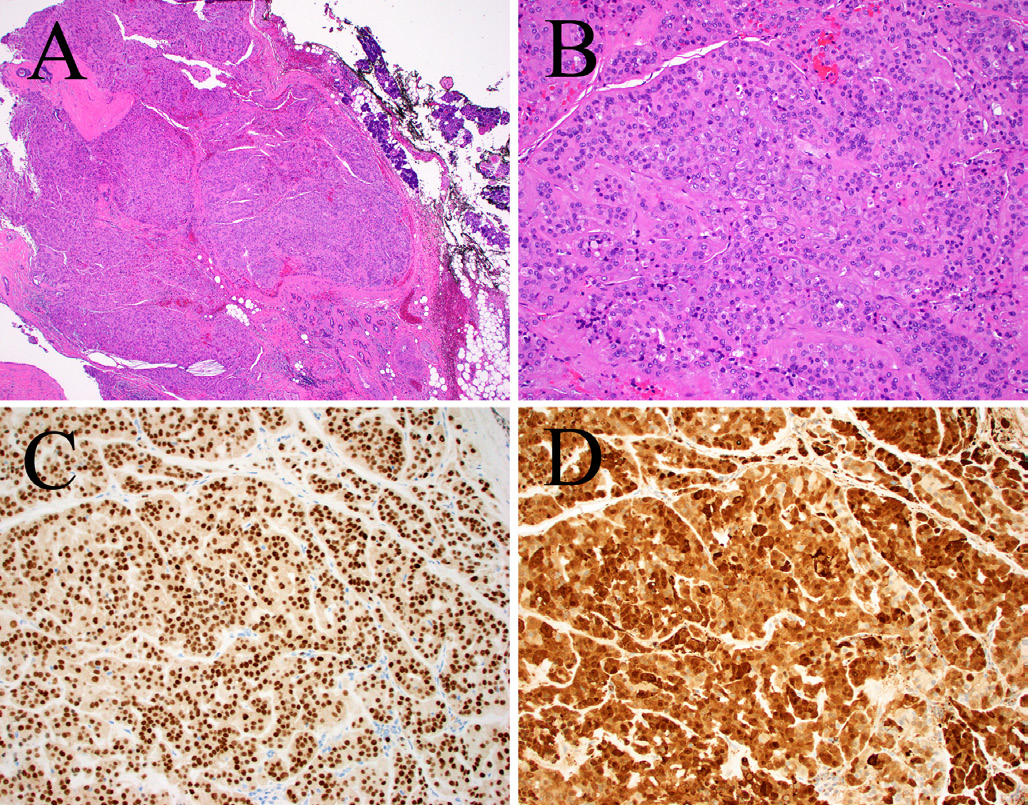 图1.嗜酸细胞性多形性腺瘤:(A)呈模糊的结节状生长,这是多形性腺瘤的典型特征;(B)但仅为嗜酸细胞性肌上皮细胞,无导管或软骨黏液样间质。这一亚型一般弥漫阳性表达SOX10(C)和S100(D);本例最终证实有CTNNB1::PLAG1融合。
图1.嗜酸细胞性多形性腺瘤:(A)呈模糊的结节状生长,这是多形性腺瘤的典型特征;(B)但仅为嗜酸细胞性肌上皮细胞,无导管或软骨黏液样间质。这一亚型一般弥漫阳性表达SOX10(C)和S100(D);本例最终证实有CTNNB1::PLAG1融合。
小管腺瘤样多形性腺瘤仅为、或部分为基底样导管细胞构成,排列呈梁状,偶见融合呈管腔。这些细胞免疫表型总是类似其他复现闰管特征的肿瘤,即阳性表达S100和SOX10,p63为弱阳性或随机着色,p40和SMA阴性。有趣的是,GFAP似乎常见阳性着色,说明这些肿瘤细胞可能有肌上皮分化、以及导管分化。一般来说,该肿瘤最常见的基因融合为HMGA2::WIF1,也可能查见其他融合配体、以及非融合性HMGA2改变。
 图2.(上)本例腮腺肿瘤呈结节状,边缘不规则,考虑为多形性腺瘤,但可疑有浸润性表现;(下)形态学方面,该肿瘤仅为一种类型的细胞构成,结构呈梁状、并聚集成导管,伴黏液样间质。本例具有HMGA2::WIF1融合,因此最终诊断为小管腺瘤样多形性腺瘤。
图2.(上)本例腮腺肿瘤呈结节状,边缘不规则,考虑为多形性腺瘤,但可疑有浸润性表现;(下)形态学方面,该肿瘤仅为一种类型的细胞构成,结构呈梁状、并聚集成导管,伴黏液样间质。本例具有HMGA2::WIF1融合,因此最终诊断为小管腺瘤样多形性腺瘤。
由于这些亚型并无经典多形性腺瘤的常见特征,因此一般并不会考虑到多形性腺瘤、并常送会诊。这类肿瘤也可与其他腺瘤混淆,如小管腺瘤、纹状管腺瘤;问题更严重的是可能会误判为癌。比如多形性腺癌,形态学也是一种细胞构成,免疫表型为S100/SOX10/p63阳性、p40阴性,和具有HMGA2改变的单型性腺瘤非常相似。已知多形性腺瘤的边界可以不规则,甚至可以累及血管;但这些特征出现于良性多形性腺瘤也是可以接受的。
如果嗜酸细胞性多形性腺瘤和小管腺瘤样多形性腺瘤未被判定为多形性腺瘤,此时的包膜不规则就很容易误判为浸润性生长。因此,证实有HMGA2或PLAG1融合则可以合理的推测病例为多形性腺瘤、只是形态学有所改变。如前所述,肌上皮癌也可有PLAG1融合,但其细胞学非典型和核分裂活性要高于多形性腺瘤,且结构呈分带状,即周边细胞丰富、中央细胞稀少。按照本文原作者观点,上述亚型的多形性腺瘤和肌上皮癌之间没有形态学的相似性。
角化囊瘤
角化囊瘤(keratocytoma)为罕见的涎腺肿瘤,仅见于腮腺。患者年龄分布宽泛,儿童也常见发生。此前对这一罕见瘤种的分子特征并不了解,但最近有对7例角化囊瘤的研究发现FISH检测均可检出RUNX2重排,且其中6例为具有特异性的IRF2BP2::RUNX2。这一研究其实就明确定义了这一瘤种的遗传学改变,某种程度上来说仅凭形态学特征来诊断这一肿瘤就不可能了。
角化囊瘤为鳞状上皮肿瘤,具体为衬覆无颗粒层角化上皮的大囊肿、以及囊肿间杂乱分布的的小巢。从细胞学角度来说,其中的上皮形态温和,几乎没有核分裂。背景的腮腺实质一般为炎症表现,具体为淋巴细胞、浆细胞、以及外溢角化物导致的巨细胞反应。文献中有一例发生于8岁儿童、具有神经侵犯的报道,但无其他非典型特征。免疫组化无助于诊断。
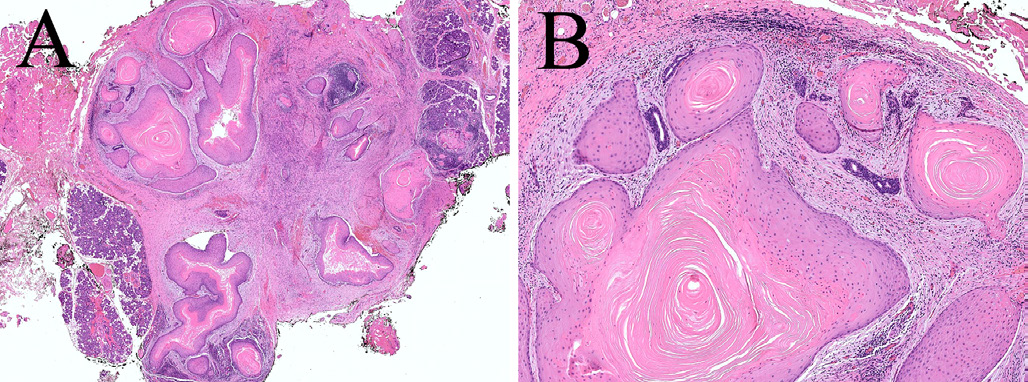 图3.角化囊瘤,为腮腺的囊性鳞状上皮肿瘤(A),囊腔之间有不规则的小巢而类似浸润(B);细胞学上无非典型。
图3.角化囊瘤,为腮腺的囊性鳞状上皮肿瘤(A),囊腔之间有不规则的小巢而类似浸润(B);细胞学上无非典型。
大部分病理医师对于角化囊瘤的诊断其实都很不满意,因为该肿瘤非常罕见,甚至大部分专家也难以碰上一例。最重要的鉴别诊断为转移性鳞癌,由于颜面部淋巴引流的原因,所以在腮腺区域遇到转移性鳞癌也非常常见。角化囊瘤与鳞癌的鉴别,在成人是非常困难的,因为后者其实要比前者更为常见,而角化囊瘤中可以出现神经周围浸润更是加剧了这一困难。目前来说,确定有RUNX2融合可以让病理医师放心的做出角化囊瘤的诊断。虽然目前的研究中采用的是FISH检测,但相应探针可能并未广泛实际应用;因此最适合这一检测的可能是包括RUNX2在内的广谱融合panel检测。
——未完待续——
点此下载原文献
参考文献
[1]Bishop JA. Fusions in salivary gland neoplasms: a review of practical diagnostic applications. J Clin Pathol. Published online October 31, 2024.
doi:10.1136/jcp-2024-209859
















共0条评论