[导读] 编译整理:杨海峰,王强
经典的非浸润性小叶病变:非典型小叶增生及小叶原位癌
背景介绍
小叶瘤变(lobular neoplasia,LN)包括了非浸润性病变中的非典型小叶增生和经典型小叶原位癌,二者在形态学、免疫组化和分子水平具有相似性。这两种病变都被视为发生浸润性癌风险升高的标志,且是乳腺浸润性癌的非特定(non-obligate)前驱病变。
众所周知,这两种病变都是多灶性,且常为双侧发生。不过,二者一般并无典型临床及影像学表现,也多为活检或针对其他病变进行处理的过程中偶见。也正是因为如此,所以该组病变的发生率难以准确判定,但相关研究认为非典型小叶增生在良性乳腺活检中占比0.5-1.2%,经典型浸润性小叶癌在良性乳腺活检中占比0.5-3.6%。
存在非典型小叶增生和经典型小叶原位癌,意味着两侧乳腺发生浸润性癌的风险都升高,但同侧乳腺受累的情况更为常见:相比无相关病变的女性来说,有非典型小叶增生者的相对风险为4-5倍,有经典型浸润性小叶癌者的相对风险为8-10倍。该组病变最常见于绝经前女性,患者年龄平均约50岁;因此也和绝经前乳腺癌的发生风险相关,且小叶瘤变的范围似乎和发生浸润性癌的风险升高有关。
组织形态学及鉴别诊断
典型的小叶瘤变为低级别上皮增生导致终末导管小叶单位扩张,伴或不伴Paget样侵入周围导管。结构上为实性表现,不伴次级管腔形成。非典型小叶增生与经典型小叶原位癌的区分,在于终末导管小叶单位内增生的程度不同:按照目前的世界卫生组织著作意见,如果特征性的肿瘤细胞在受累终末导管小叶单位中累及腺泡的数量不足半数,则为非典型小叶增生;如果超过了半数,则为经典型小叶原位癌。也正因为这一区别有一定程度的武断,因此有作者用小叶瘤变这一名称来涵盖非典型小叶增生和经典型小叶原位癌。小叶瘤变核分裂不活跃;如果有钙化,一般为细腻表现。

图6.小叶瘤变形态学特征。(A)非典型小叶增生。受累终末导管小叶单位中,小而均一的细胞增生累及范围不足半数腺泡。(B)经典型小叶原位癌,小叶瘤变的细胞在受累终末导管小叶单位中占比超过了半数腺泡。(C)小叶瘤变,沿着导管呈Paget样播散,管腔面可见衰减的残余导管上皮;细胞有失黏附的特点,尤其是该导管左侧部分。(D)非典型小叶增生,细胞核圆形,胞质稀少,个别细胞有胞质内黏液,部分有居中的嗜酸性致密黏液滴;胞质内黏液及靶环样黏液并非小叶瘤变所特有,因为也可见于导管病变。
有研究注意到小叶瘤变中的细胞形态有一定差别,因此尝试将其分为A型和B型两种:前者细胞形态均一,后者细胞较大,且大小和形状有差别。不过,原作者也强调,随着对小叶瘤变的认识深入,他们自己也认为这一分类太过简单,“已经抛弃了”。不过,时至今日,典型小叶瘤变中A型细胞和B型细胞的描述仍有一定意义,因为这样的描述有助于鉴别诊断。
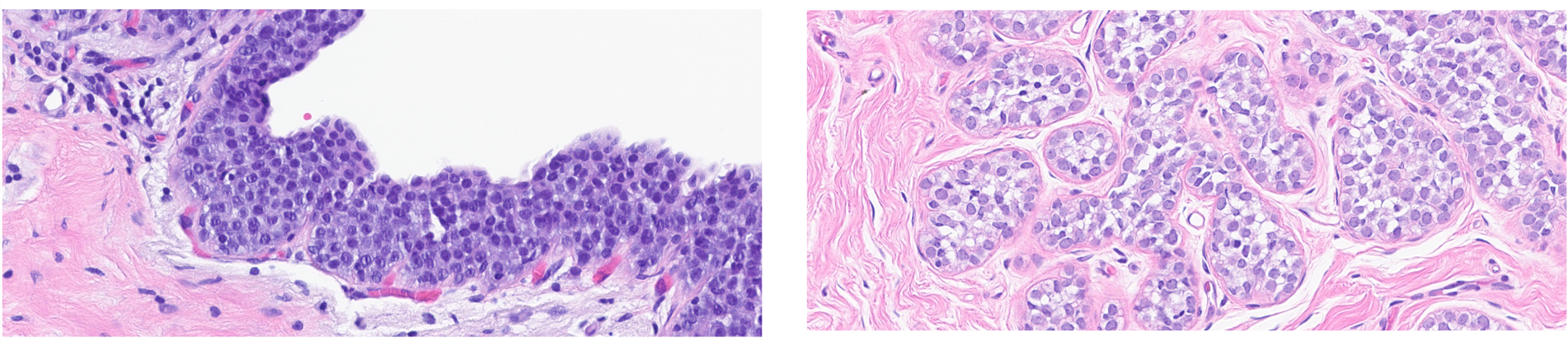 图7.(左)小叶瘤变中的A型细胞,小而均一,细胞核约为淋巴细胞的1-1.5倍,胞质稀少,细胞核圆形、深染;(右)小叶瘤变中的B型细胞,体积更大,细胞核约为淋巴细胞的2倍,胞质更多,细胞核大小和形状有一定差异,有小核仁。
图7.(左)小叶瘤变中的A型细胞,小而均一,细胞核约为淋巴细胞的1-1.5倍,胞质稀少,细胞核圆形、深染;(右)小叶瘤变中的B型细胞,体积更大,细胞核约为淋巴细胞的2倍,胞质更多,细胞核大小和形状有一定差异,有小核仁。
虽然免疫组化并非小叶瘤变诊断所必需,但已知该组病变均一表达ER和PR,而HER2并无过表达。小叶瘤变的鉴别诊断主要取决于终末导管小叶单位受累的范围、或小叶瘤变累及了原有病变(如放射状硬化性病变、硬化性腺病、导管内乳头状瘤、胶原小球病)。免疫组化E-cadherin检测、加仔细结合形态学表现,一般都会做出准确分类。不过,如果病变明确为小叶形态,也有作者提出无需进行E-cadherin免疫组化检测。
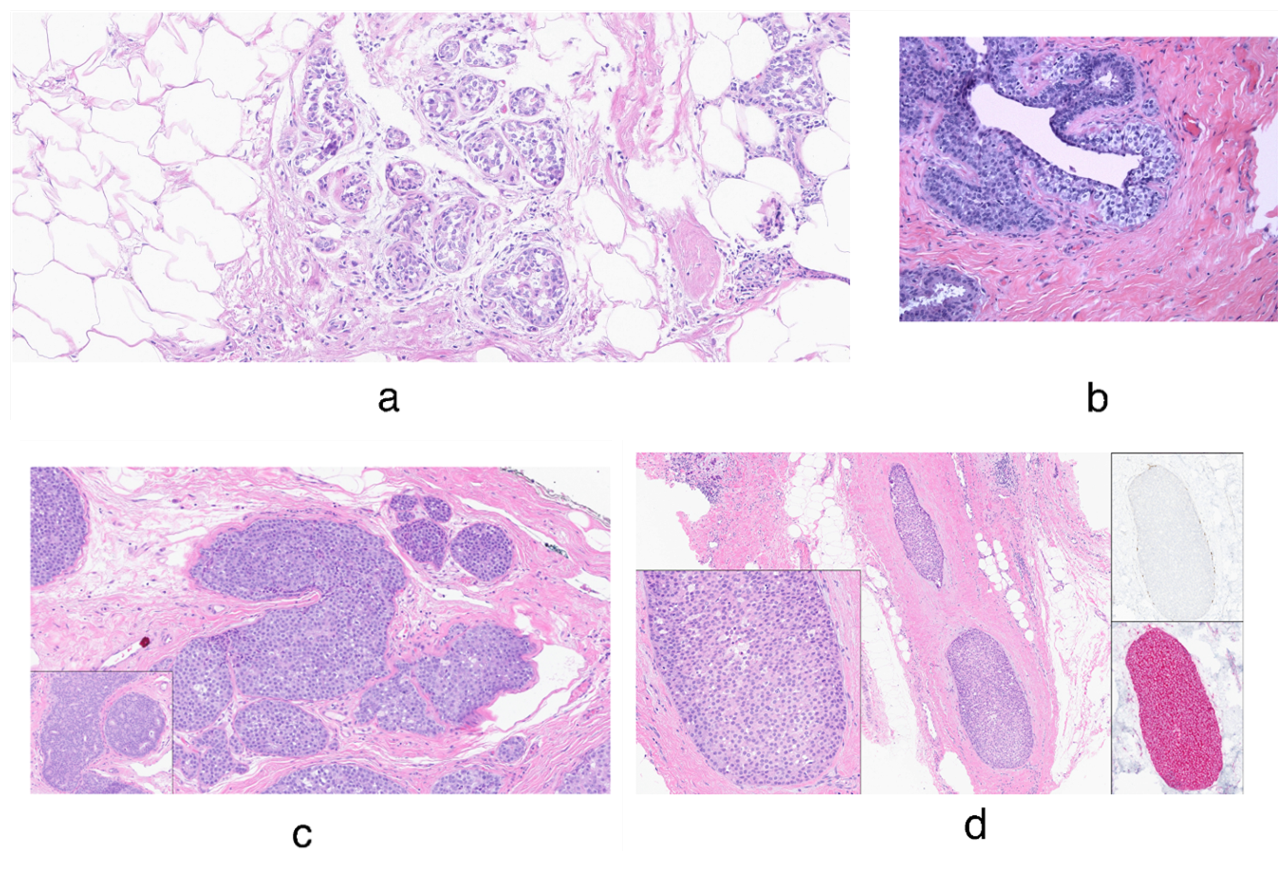 图8.小叶瘤变及类似病种示例。(A)组织固定欠佳,可导致上皮呈失黏附、细胞变圆的表现,会考虑为非典型小叶增生。(B)局灶肌上皮增生,虽然从解剖部位的角度来说是正常的,但此时细胞的胞质透明、“潜伏”于导管上皮下,也会让人考虑非典型小叶增生。(C)经典型小叶原位癌的鉴别诊断,包括导管原位癌,因为二者均可为低级别和/或中级别的细胞核、呈实性结构。如本例所见,其实两个病种存在显著形态学重叠;插图是本例增生性病变的另一区域,可见继发性管腔形成,符合导管分化。(D)一例小叶原位癌,并无细胞失黏附或胞质内黏液的表现;但免疫组化E-cadherin(右上角插图)和p120(右下角插图)证实为小叶原位癌。
图8.小叶瘤变及类似病种示例。(A)组织固定欠佳,可导致上皮呈失黏附、细胞变圆的表现,会考虑为非典型小叶增生。(B)局灶肌上皮增生,虽然从解剖部位的角度来说是正常的,但此时细胞的胞质透明、“潜伏”于导管上皮下,也会让人考虑非典型小叶增生。(C)经典型小叶原位癌的鉴别诊断,包括导管原位癌,因为二者均可为低级别和/或中级别的细胞核、呈实性结构。如本例所见,其实两个病种存在显著形态学重叠;插图是本例增生性病变的另一区域,可见继发性管腔形成,符合导管分化。(D)一例小叶原位癌,并无细胞失黏附或胞质内黏液的表现;但免疫组化E-cadherin(右上角插图)和p120(右下角插图)证实为小叶原位癌。
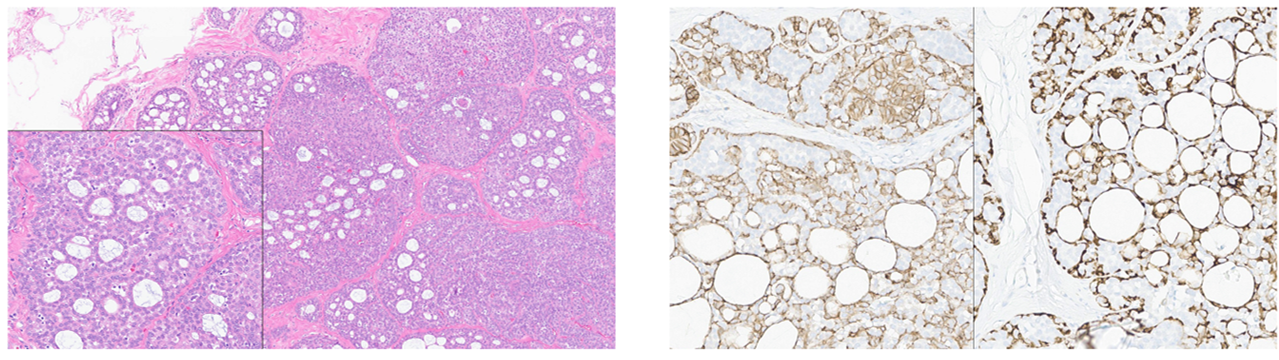
图9.(左)小叶瘤变倾向于定植在原有病变,且相应结构加之非典型上皮,可提示相应诊断。如小叶瘤变定植于胶原小球病,则此时会有形态单一的细胞增生、并有僵硬的结构表现;插图示管腔样结构。(右)左侧为E-cadherin免疫组化,示部分形态单一的细胞表达缺失,而肌上皮细胞仍有着色;右侧为calponin免疫组化,肌上皮细胞呈类似表现。
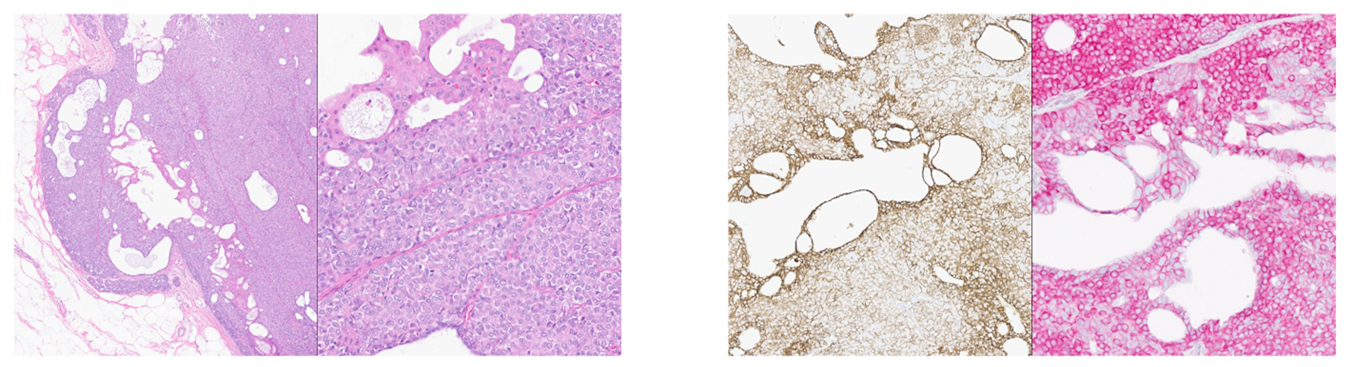 图10.(左)旺炽性小叶原位癌累及导管内乳头状瘤,左侧示纤细纤维血管轴心,并有围绕开放管腔的残余导管上皮,部分伴大汗腺特征;右侧示形态单一的细胞,且上方相邻大汗腺化生处偶有胞质内管腔。(右)左侧为E-cadherin免疫组化,残余大汗腺型上皮仍有细胞膜表达,而心怀鬼胎单一的细胞则部分区域有表达缺失或部分缺失;右侧为p120免疫组化,结果相似,即大汗腺型商品仍有细胞膜着色,而形态单一的细胞呈胞质着色,支持小叶分化。本例也突显了E-cadherin异常着色、以及残余导管上皮过度解读可能存在的陷阱。
图10.(左)旺炽性小叶原位癌累及导管内乳头状瘤,左侧示纤细纤维血管轴心,并有围绕开放管腔的残余导管上皮,部分伴大汗腺特征;右侧示形态单一的细胞,且上方相邻大汗腺化生处偶有胞质内管腔。(右)左侧为E-cadherin免疫组化,残余大汗腺型上皮仍有细胞膜表达,而心怀鬼胎单一的细胞则部分区域有表达缺失或部分缺失;右侧为p120免疫组化,结果相似,即大汗腺型商品仍有细胞膜着色,而形态单一的细胞呈胞质着色,支持小叶分化。本例也突显了E-cadherin异常着色、以及残余导管上皮过度解读可能存在的陷阱。
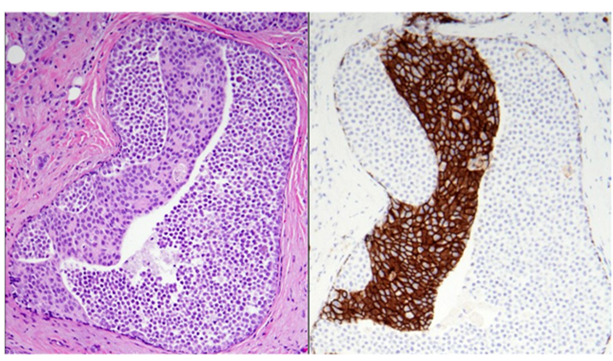
图11.极为罕见的情况下,小叶原位癌和导管原位癌可同时存在,即同一导管腔内存在两种病变。本图左侧部分,可见小叶瘤变中失黏附的形态单一、小圆形细胞,而导管中央为有黏附性的中等级别上皮病有继发性管腔形成;右侧为免疫组化E-cadherin,证实为两种病变。
临床处理相关问题
这些年,小叶瘤变的外科治疗方案已有改变。以往诊断为小叶瘤变,意味着双侧乳腺切除;现在已主要为加强影像学随访以及化学预防了,后者一般为他莫昔芬或芳香化酶抑制剂,具体取决于患者是否绝经。粗针穿刺活检诊断为小叶瘤变、手术切除后病变级别升高的几率不一,主要是因为影像-病理一致性、纳入标准、穿刺针以及穿刺标本大小、穿刺方法(是否真空辅助)等方面的不同导致的。当前的研究中,对于影像-病理意见一致的病例来说,粗针穿刺活检诊断为小叶瘤变后手术切除中出现“更坏病变”(低至中级别导管原位癌、或激素受体阳性且HER2阴性浸润性癌)的几率<5%。
虽然美国各单位这种情况下切除的几率不一,但如果病理-影像学意见一致、且粗针穿刺活检标本中没有其他需要切除的病变情况下,美国乳腺外科医师学会处理指南已不再建议常规切除小叶瘤变。美国国立综合癌症网络(NCCN)乳腺癌筛查和诊断指南中以脚注的方式提出:粗针穿刺活检中诊断累及4个以上终末导管小叶单位的经典型小叶原位癌,也可以考虑切除。影像学-病理意见不一致,有其他高危病变,有肿物,粗针穿刺活检中既有目标病变又有偶见病变的情况下,一般建议手术切除。
未完待续
往期回顾:
乳腺小叶病变-从经典到变异型系列学习(一)



















共0条评论