[导读] 编译整理:强子
p63免疫组化在乳腺病理诊断中的作用
1.证实上皮-间质交界处存在正常的肌上皮细胞,以鉴别良性、原位病变和浸润性乳腺癌。这一情况下的常见诊断应用包括:(1)放射性瘢痕与小管癌的鉴别;(2)复杂硬化性病变与低级别非特殊类型浸润性癌的鉴别;(3)导管原位癌累及硬化性病变与浸润性癌的鉴别;(4)导管原位癌与导管原位癌样浸润性癌的鉴别;(5)根据乳头状病变中纤维血管轴心和病变周边肌上皮细胞的有无、分布来进行分类。
浸润性乳腺癌的特征一般是上皮间质交界处p63着色缺失,而良性或原位病变一般在这一交界处为p63细胞核阳性着色、即有肌上皮细胞。不过,某些罕见的良性增生性上皮病变(如浸润性上皮增殖【infiltrating epitheliosis】)、某些良性大汗腺型乳头状病变在上皮间质交界处可能并无p63表达,至少局灶如此。
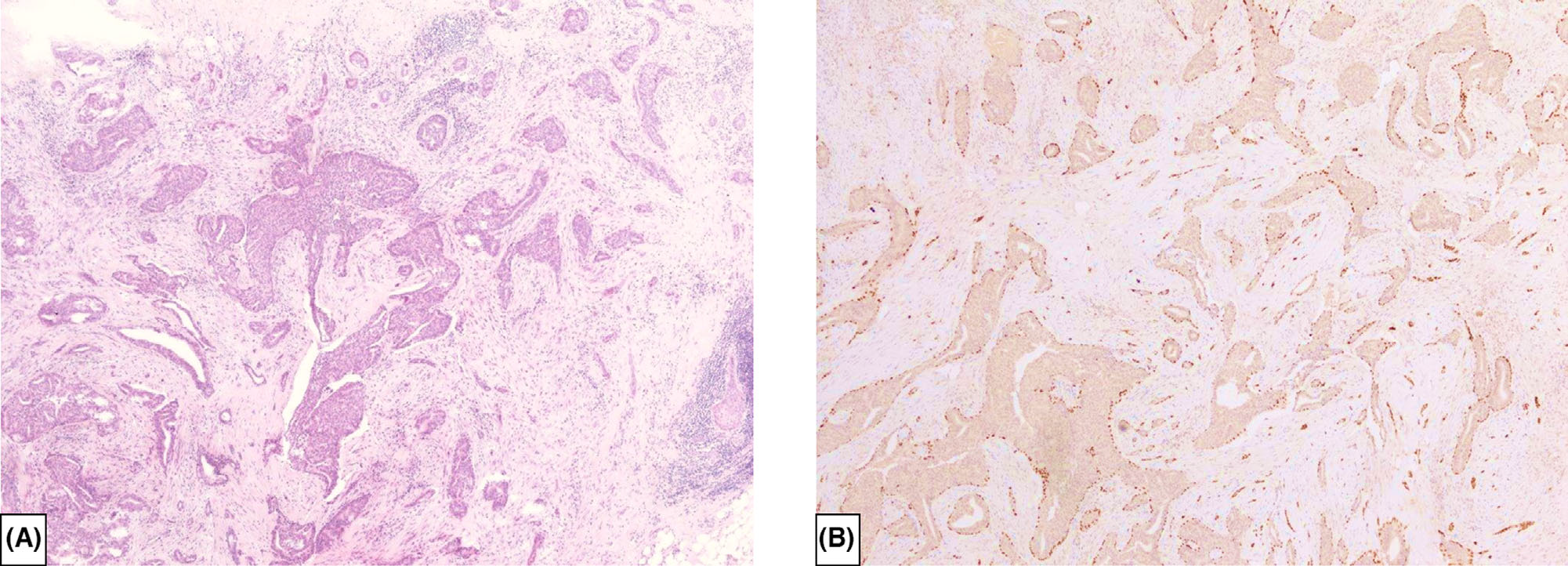
图3.浸润性上皮增殖(A),在上皮间质交界处有局灶的p63表达缺失(B),会考虑为侵袭性病变可能。不过,周边局灶还有p63阳性的肌上皮细胞,且阴性和阳性区域是逐渐过渡的,可以提示我们做出准确诊断。
此外,某些伴鳞状、肌上皮、梭形细胞分化的增生性病变细胞可表达p63,且这一结果不要和正常情况下存在于良性、原位病变周边的固有肌上皮细胞混淆。低级别腺鳞癌就是一个周边可能会存在p63阳性着色的恶性肿瘤实例,这一着色类似固有肌上皮细胞,因此可能会误判为原位病变。
2.证实某些病变中(如腺肌上皮瘤、多形性腺瘤)的增生细胞是管腔上皮表型、还是肌上皮表型;
3.证实化生性乳腺癌中梭形细胞成分的上皮性质,排除其他诊断,如叶状肿瘤。与高分子量CK一样,免疫组化p63阳性在乳腺病理中可用于形态温和表现的上皮来源梭形细胞病变(如纤维瘤病样癌)与间叶或间质来源的梭形细胞病变(良性或局部侵袭性)鉴别、用于肉瘤与梭形细胞型化生性癌的鉴别。
4.证实鳞状细胞型化生性癌、黏液表皮样癌、其他伴鳞状细胞成分的化生性及良性病变中细胞的鳞状性质。免疫组化p63无助于乳腺原发鳞状细胞癌与皮肤鳞状细胞癌或转移性鳞状细胞癌的鉴别。乳腺鳞状细胞癌的评估需要包括病变的精准位置(皮肤、还是乳腺实质)、有无原位癌、其他免疫组化标记、相关临床病史。
5.对伴肌上皮分化的皮肤附属器肿瘤及涎腺样病变进行鉴别,如汗腺瘤及腺样囊性癌;
6.用于原发或转移性乳腺癌累及皮肤与原发大汗腺癌的鉴别。免疫组化p63阳性可见于81%的大汗腺癌,而乳腺癌转移至皮肤时阳性率仅为6%,说明这种情况下p63是乳腺原发大汗腺癌的相对特异性标记。
7.通过排除鳞状分化而辅助Paget病的诊断。
乳腺病理具体病种中p63应用详述(一)
乳头状病变
确定上皮间质交界处有无肌上皮细胞,对于乳头状病变的分类非常关键。经典的导管内乳头状瘤中,免疫组化p63在纤维血管轴心的肌上皮细胞阳性,病变周边也有阳性。非典型或导管原位癌累及的导管内乳头状瘤中,受累区域p63表达缺失,但其余部分和病变周边仍有p63表达。
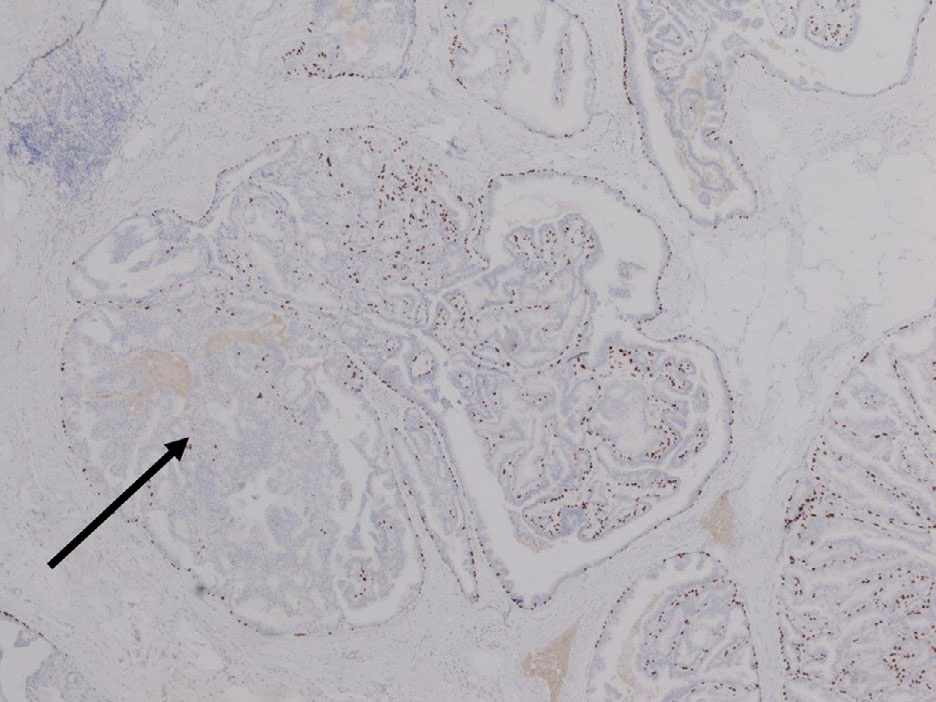 图4. 部分被导管原位癌(黑色箭头)累及的导管内乳头状瘤,肿瘤性增生的区域免疫组化p63局灶缺失;病变周边及良性区域p63还有着色。免疫组化ER和基底型CK证实了病变的克隆性。
图4. 部分被导管原位癌(黑色箭头)累及的导管内乳头状瘤,肿瘤性增生的区域免疫组化p63局灶缺失;病变周边及良性区域p63还有着色。免疫组化ER和基底型CK证实了病变的克隆性。
乳头状导管原位癌中,乳头处不表达p63,但周边仍有表达;包裹性和实性乳头状癌中,病变内不表达p63,但病变周边程度不等的表达、或缺失。
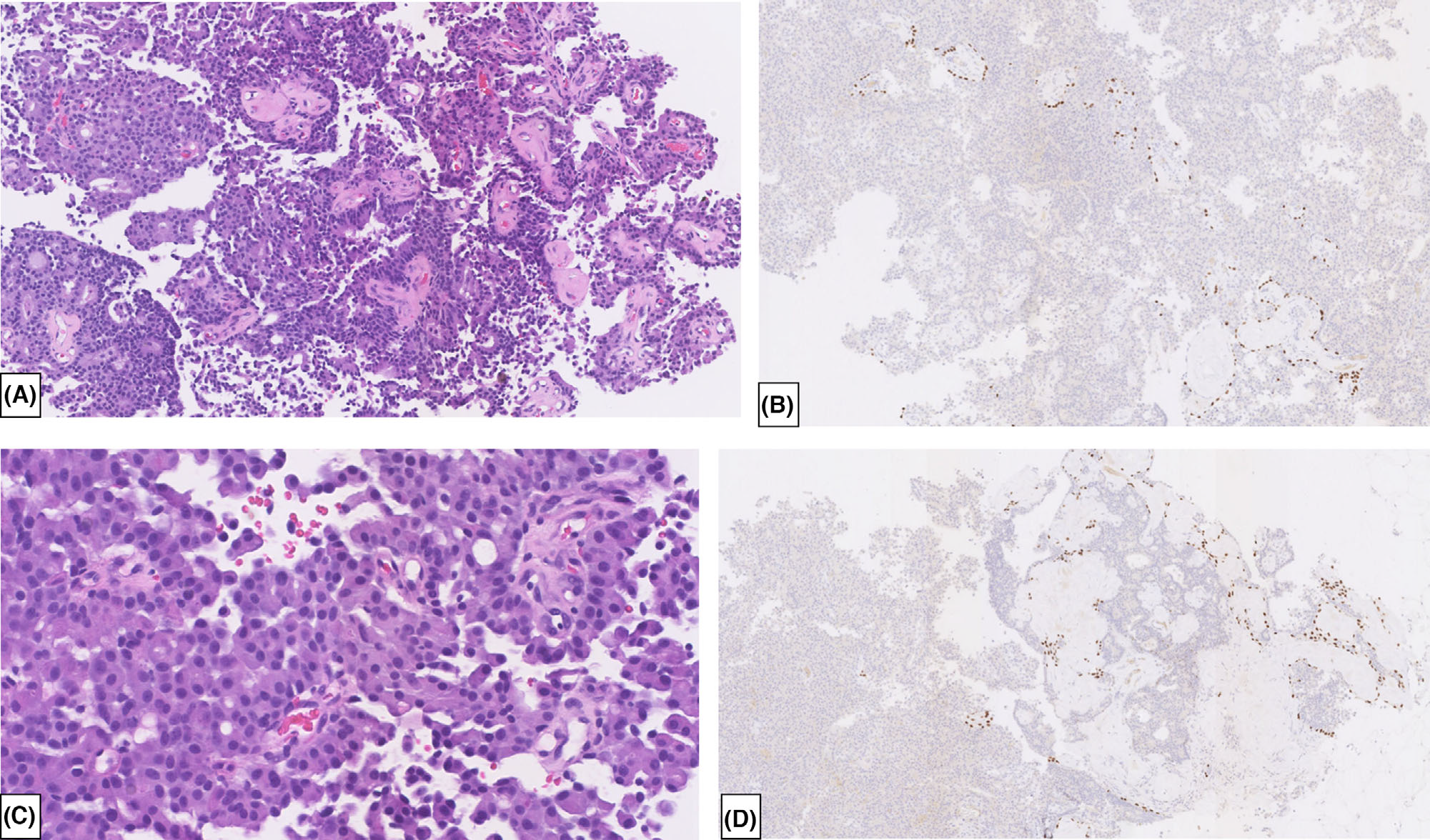 图5. 导管内乳头状病变,粗针穿刺活检,组织学可见部分被低级别细胞核的导管原位癌累及;免疫组化p63显示残余良性或增生性乳头状成分中,上皮和间质交界处还有肌上皮细胞的存在。
图5. 导管内乳头状病变,粗针穿刺活检,组织学可见部分被低级别细胞核的导管原位癌累及;免疫组化p63显示残余良性或增生性乳头状成分中,上皮和间质交界处还有肌上皮细胞的存在。
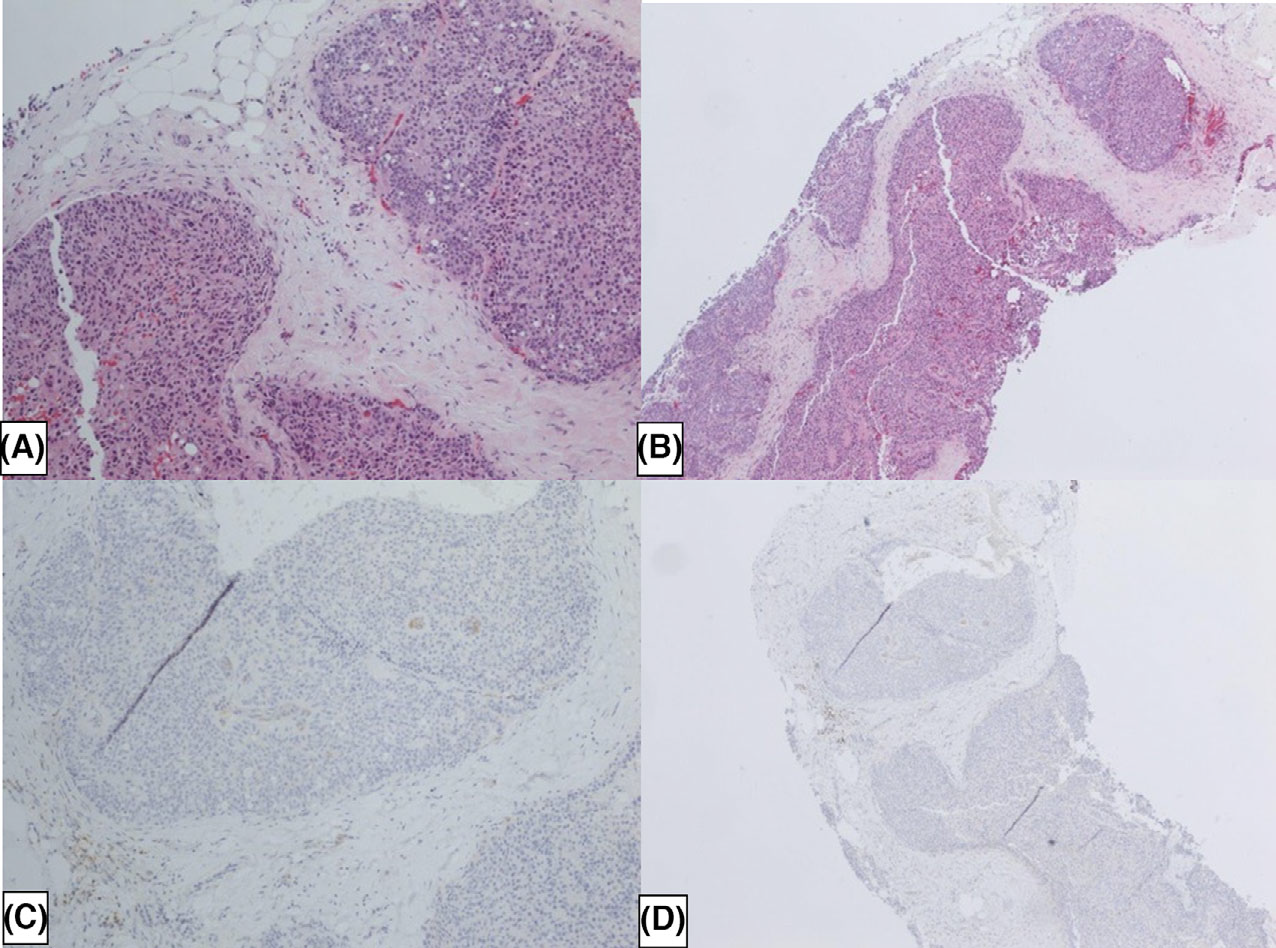 图6. 粗针穿刺活检标本,形态学为实性乳头状癌,周边并无肌上皮细胞,免疫组化p63无着色,因此难以鉴别非浸润性癌和浸润性癌,尤其是呈不规则巢状的多结节状表现时。
图6. 粗针穿刺活检标本,形态学为实性乳头状癌,周边并无肌上皮细胞,免疫组化p63无着色,因此难以鉴别非浸润性癌和浸润性癌,尤其是呈不规则巢状的多结节状表现时。
免疫组化p63用于评估乳头状病变时,一个重要的陷阱是有些增生的上皮细胞可能会p63阳性。这可能是局灶的肌上皮细胞,也可能是某些乳头状肿瘤中可以出现的早期鳞状分化。形态特征与多形性腺瘤存在重叠的乳头状病变中,鳞状分化和肌上皮细胞分化一般较为明显。
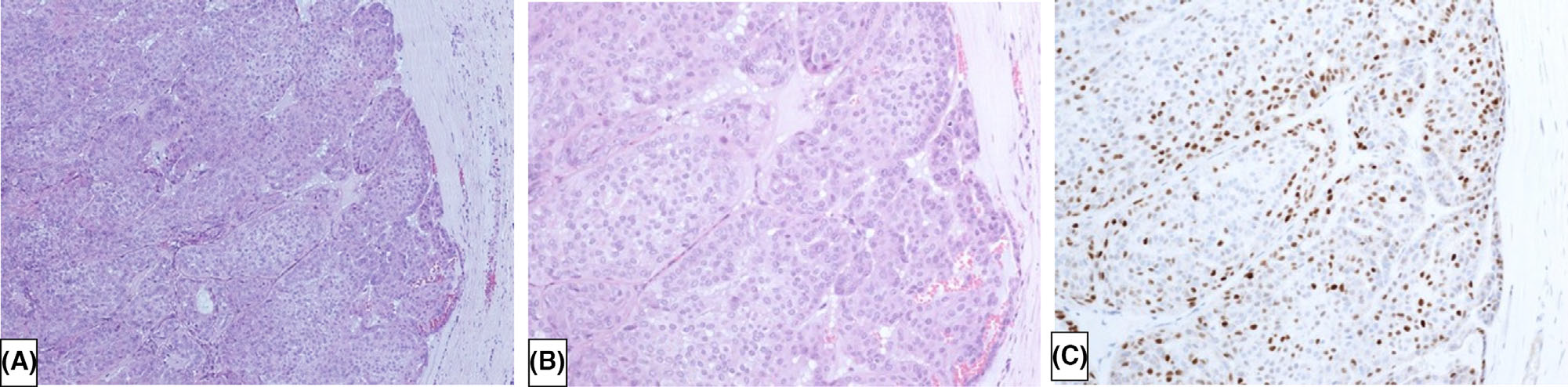
图7. 包裹性乳头状癌,周边的局灶及病变内有显著的p63着色,这可能是局灶的肌上皮细胞、或早期的鳞状分化,在部分乳头状肿瘤中的确可以见到。
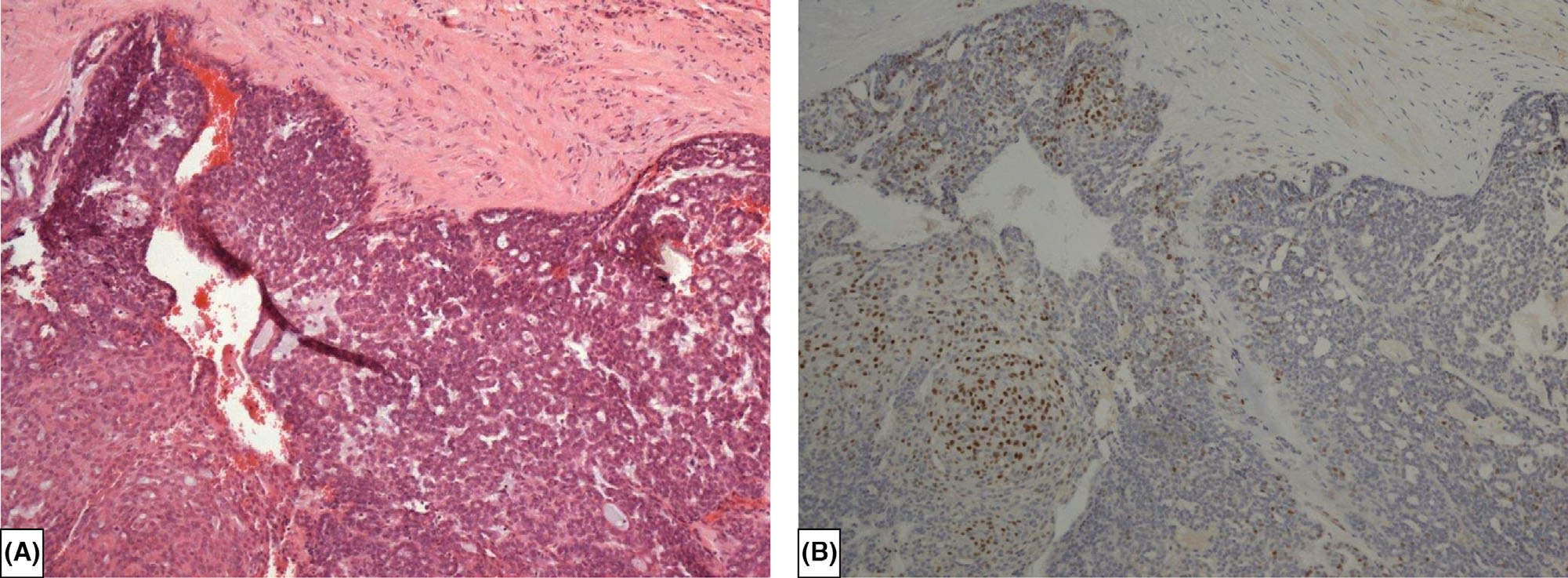 图8. 实性乳头状癌,部分区域有鳞状化生,即对应病变内免疫组化p63阳性区域。
图8. 实性乳头状癌,部分区域有鳞状化生,即对应病变内免疫组化p63阳性区域。
p63还可用于粗针穿刺活检标本中、有时用于切除标本鉴别乳头状瘤和汗腺瘤:汗腺瘤的增生细胞为弥漫、强阳性表达p63(且ER阴性),而乳头状瘤的p63阳性一般仅见于衬覆在纤维血管轴心的细胞及病变周边。
非特殊类型浸润性乳腺癌
非特殊类型浸润性乳腺癌中p63阳性的情况已有报道,但根据本文原作者经验,这一阳性着色并不常见,且如果存在,一般都是局灶、弱阳性。非特殊类型浸润性乳腺癌中偶见p63阳性的可能解释有:肿瘤进展而伴有p63的新表达(neoexpression),恶性上皮细胞的异常分化及向其他细胞谱系的重新编程(转分化,如向鳞状细胞或肌上皮细胞的分化)并有包括p63阳性在内的表型重塑,肿瘤进化早期的异源性分化而导致双相型形态(如腺癌细胞同时有鳞状细胞或梭形细胞,或上皮样肿瘤细胞和肌上皮样肿瘤细胞都有增生)。
全面评估的情况下,这类p63阳性的肿瘤在HE切片中最常见有局灶鳞状特征,且一般高分子量CK阳性。这类肿瘤不要和“基底样”乳腺癌混淆,后者主要表达vimentin、基底型CK(如CK5/6、CK14、CK17)、EGFR、p-cadherin,偶有肌源性标记表达(如SMA、SMMHC),但p63不表达或局灶弱阳性表达。
部分非特殊类型的浸润性乳腺癌还表达S100,且某些癌(如分泌性癌)为弥漫、强阳性。这类肿瘤中的S100表达可能并不是肌上皮细胞表型的反应,这类肿瘤一般是p63阴性的。
非特殊类型浸润性癌中p63的表达,也可能是反应了所用抗体、检测方法、解读标准的不同。众所周知,针对同一靶蛋白的不同抗体在结合特征方面可能有显著不同,检测方案的改变可能对具体蛋白被视为“阳性”的病例比例产生显著影响。
——未完待续——
往期回顾:
乳腺病理中的免疫组化p63(一)
乳腺病理中的免疫组化p63(二)



















共0条评论