[导读] 编译整理:强子
肝细胞腺瘤及肝细胞癌中的分子诊断
肝细胞腺瘤,仍主要根据形态学特征做出诊断。组织学诊断取决于发现形态学温和的肝细胞增生而并无汇管区、伴非配对血管且有轻度增生。肝细胞腺瘤的突破性进展,在于分子技术促进了特殊亚型的识别;临床实践中,已经可以通过免疫组化而识别出这些亚型。
肝细胞腺瘤分子分类的最重要临床意义,在于识别出恶性转化风险高的亚型。另外,肝细胞腺瘤的一个重要并发症是出血,但目前在美国还没有预测临床出血的分子或免疫组化标记的应用或验证。肝细胞腺瘤的分类及其重要的分子、临床、组织学、免疫组化特征,详见表1。
表1.肝细胞腺瘤分子亚型分类

分子技术在肝细胞癌常规诊断和后续处理方面的意义还相对较少。TERT启动子突变常见于部分肝细胞癌,但其他类型肿瘤中并未见这一特征;β-catenin突变与此类似。虽然肝细胞癌的诸多组织学亚型还是形态学识别,且有分子相关性,但在美国来说,常规应用分子检测来确定亚型、或预测治疗效果,还没有成为常规方案。
上皮样血管内皮瘤
上皮样血管内皮瘤是一种罕见的低级别、恶性血管性肿瘤,可发生于肝脏并表现为多灶性。该肿瘤最初是1986年报道于骨或软组织的肿瘤,其生物学行为介于血管瘤和上皮样血管瘤之间。
实际工作中,肝脏上皮样血管内皮瘤必须注意鉴别常见的类似病种,最常见为腺癌。形态学方面,上皮样血管内皮瘤是上皮样细胞、伴泡沫状、空泡状胞质,并有特征性的胞质腔隙形成、内有红细胞,提示为流产型血管表型。病变中央一般可见上皮样细胞呈实性片状。这一特点、加之查见胞质内腔隙,可能会类似腺癌。重要的是,上皮样血管内皮瘤的特征在于有独特的、有时呈玻璃样变的基质,这是日常工作中有助于诊断的线索。
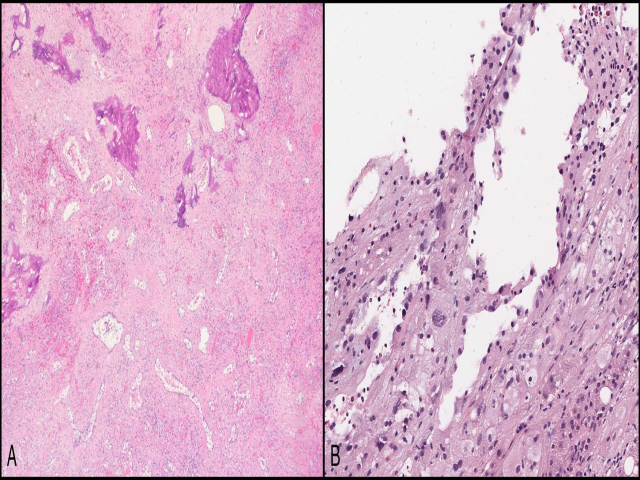
图4.上皮样血管内皮瘤,低倍镜下为上皮样细胞呈实性片状、背景为黏液样间质;高倍镜下,上皮样细胞可见空泡状、泡沫样胞质,并有特征性的、内有红细胞的胞质内腔隙,提示流产型血管表型。
在上皮样血管内皮瘤中发现1号染色体和3号染色体之间的易位-t(1;3)(p36;q25)以及由此产生的融合基因WWTR1::CAMTA1、且其他上皮样血管病变中无此特征,由此使得这一融合被用于支持上皮样血管内皮瘤的诊断标记。此外,免疫组化CAMTA1也已成为临床诊断方案,该蛋白的表达增加是前述基因融合所致。很多专业医学中心已经在实际工作中应用这一免疫组化。
2013年,在部分上皮样血管内皮瘤中通过FISH和RT-PCR检出了YAP1::TFE3融合,这部分病例不仅有CAMTA1重排上皮样血管内皮瘤中特征性的基质、还有明确的管腔形成,且肿瘤细胞有大量组织细胞样胞质,后面这一点也是其他TFE3重排肿瘤的一个特征。
肝脏上皮样血管内皮瘤中,新发现的YAP1::TFE3融合极为罕见,目前文献中具有YAP1::TFE3融合的肝脏上皮样血管内皮瘤仅有2例报道。不过,诊断出这一亚型具有重要临床意义,因为相关数据表明:WWTR1::CAMTA1融合的病例相比YAP1::TFE3融合的病例来说,预后更差。
本文原作者的日常工作中,基于其单位发表的文献及大量实践经验,会注意将TFE3免疫组化作为TFE3重排的替代性标记,但并不像CAMTA1那样信心十足。因此,对YAP1::TFE3融合的病例来说,首选分子检测证实,但免疫组化TFE3弥漫、强阳性可用于分子检测之前的筛查。总之,对于间质性的上皮样血管内皮瘤来说,分子特征的发现也已导致了提供预后信息的新型诊断检测的发展。
肝内胆管癌
胆管癌为胆道原发的恶性肿瘤,可分为三组,即肝外、肝门、肝内的胆管癌。这一区分具有临床和生物学意义:不同组别的胆管癌在临床表现、危险因素、手术方案、具体分子异常方面都有所不同。表2详述了不同组别胆管癌的分子特征。
表2. 用于胆管癌诊断和疗效预测的分子标记

对于肝外和肝门处的胆管癌来说,仅根据胆道刷取标本的细胞学涂片做出诊断可能难度很大。实际上,文献中报道的敏感性也大部分并不理想,遗传学异常的检出可提高诊断的准确性,具体如表2中所述FISH检测、二代测序。
分子特征引出的新型治疗及生物学标记物检测
对于肝内胆管癌来说,几十年来并没有用于无法手术患者的有效药物治疗方案。不过,最近发现的FGFR2融合、互斥性的IDH1/2突变、BRAF突变、罕见的错配修复缺陷及其他遗传学异常已使得肝内胆管癌称为了消化系统恶性肿瘤中最有可能进行靶向治疗的瘤种之一。
肝内胆管癌中常见的FGFR2基因融合有:FGFR2::BICC1、FGFR2::AHCYL1、FGFR2::PPHLN1、FGFR2::KIAA1598、FGFR2::FRK、FGFR2::C10ORF。由于FGFR2基因的融合配体及相应断裂点不同,因此简单的RT-PCR检测用于临床可能比较复杂。FISH检测也仅仅是针对具体融合来检测的。二代测序可以检出不同的FGFR2基因融合,目前主要倾向于用这一方案。
对于FGFR2的融合来说,在肝内胆管癌中所占比例为10%。对于IDH1/2突变来说,所占比例为20%;BRAF突变所占比例为5%,NTRK融合所占比例不足1%,这三种情况的常用检测方案也是二代测序。DNA错配修复缺陷在肝内胆管癌中所占比例为1%,常用检测方案为免疫组化、PCR或二代测序。
上述靶点的确定,促使FDA批准了多种用于肝内胆管癌的靶向药物,胆管癌分子检测也因此而有了显著增加,详见图5。
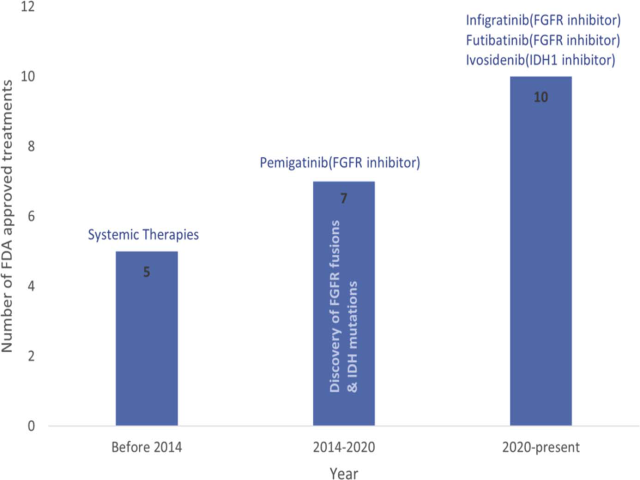
图5.FGFR融合基因的发现,促进了FDA批准肝内胆管癌的治疗从系统性、至靶向性的转变。图中可见,2014年前,肝内胆管癌的治疗方案主要是系统性治疗;2014年至2020年间,因为FGFR融合、IDH突变的发现而有了FGFR抑制剂(培米替尼【Pemigatinib】)的治疗;2020年至今,则有了更多靶向药物,如FGFR抑制剂中的英菲格拉替尼(Infigratinib)、福巴替尼(Futibatinib)和IDH1抑制剂艾伏尼布(Ivosidenib)
——全文完——
往期回顾:
当分子病理遇到肝脏(一)

















共0条评论