[导读] 编译整理:强子
对消化道恶性病变有预测和预后意义的免疫组化指标(一)
对消化道恶性病变有预测和预后意义的免疫组化指标(二)
对消化道恶性病变有预测和预后意义的免疫组化指标(三)
胰腺
胰腺导管腺癌是最常见的胰腺恶性肿瘤,其分子异常已明确,不过却尚未转化为免疫组化标记物的常规应用。前述错配修复蛋白、PD-L1等,偶有检测,但一般是肿瘤科医师要求下才进行。NCCN指南建议对局部进展期的胰腺导管腺癌进行错配修复蛋白检测,主要是建议PD-1抑制剂治疗。
胰腺神经内分泌肿瘤、即高分化神经内分泌肿瘤(neuroendocrine tumor,NET)和神经内分泌癌(neuroendocrine carcinoma,NEC)中,免疫组化的应用更多一些。大部分病理医师熟悉的,是通过Ki-67免疫组化及核分裂计数来对胰腺神经内分泌肿瘤做出分级。由于分级和预后有关,因此Ki-67可间接作为预后标记;也可作为辅助治疗情况下的预测性标记。生长抑素类似物(如奥曲肽、兰瑞肽)可用于控制症状、控制转移性NET患者的疾病播散,且可能对于Ki-67<10%的病例效果最佳。尽管NET和NEC鉴别的Ki-67最高阈值为20%,但有作者提出建议应用另一阈值55%:Ki-67高于55%的NET和NEC似乎都对放射性核素肽受体(peptide receptor radionuclide)治疗效果较差,且Ki-67>55%的NET临床上一般也按照NEC治疗。胃肠道其他部位神经内分泌肿瘤中可能也有类似结果,但一般认为胰腺神经内分泌肿瘤是其中最具侵袭性的类型,且总体的Ki-67增殖指数可能更高,3级NET的几率最高。
胰腺NET中,CK19作为可能标志物也受到了一定关注,因为有几项研究报道称免疫组化CK19表达和预后差之间有相关性。以前版本的美国病理学会(College of American Pathologists,CAP)胰腺神经内分泌肿瘤患者标本检查指南(Protocol for the Examination of Specimens From Patients With Tumors of the Endocrine Pancreas)中有这方面内容,但最新版本中则未涉及这一问题,且也并未得到广泛应用。免疫组化中KIT的表达可能也是一项预后标记,阳性着色与预后差有关。
小肠
小肠腺癌与结直肠腺癌有诸多相似之处,只是前者非常少见。小肠腺癌的生物学标记物研究非常有限,本文也只是简单介绍一下而已。
由于小肠腺癌相对少见,所以其免疫组化中错配修复蛋白缺陷的相关报道也不太一致,但要比结直肠癌中更为常见一些,可能是由于涉及的病例数相对少的原因。小肠腺癌错配修复蛋白缺陷可能具有和其他部位相似的预测及预后意义,但相关数据仍有限。NCCN指南中建议对于小肠腺癌进行错配修复蛋白检测。
小肠腺癌中免疫组化检测PD-L1也有报道,一项研究称121例中25%的病例CPS≥1。此外,发生于乳糜泻或Crohn病的小肠腺癌更可能出现CPS阳性结构,微卫星不稳定高的病例中也是如此。不过,目前小肠腺癌方面还没有公开的临床试验证实免疫组化PD-L1阳性可转化为PD-1抑制剂治疗获益。最近,ZEBRA试验报道,派姆单抗对于非选择性进展期小肠腺癌总体并无获益,但在微卫星不稳定高的病例中展现出了一些希望。
小肠腺癌和结直肠腺癌一样,HER2过表达或扩增并不常见。目前既无小肠评分方案提出,也没有结直肠评分方案的应用研究。尽管如此,实验室模型表明,在某些小肠腺癌中针对ERBB2突变的治疗可能有效。
其他免疫组化标记
胃肠道间质瘤,是消化道最常见的间叶性恶性肿瘤,且具有不同的病理性突变,有些具有预后意义。胃肠道间质瘤大部分具有KIT突变,但免疫组化KIT几乎在所有的胃肠道间质瘤都是阳性,与KIT基因状态无关。约10%的胃肠道间质瘤具有PDGFRA突变,该组肿瘤中具有D842V突变的病例对于经典的伊马替尼治疗无效,但对阿瓦普替尼(avapritinib)治疗有效。最近有研究表明,免疫组化PDGFRA阳性可以作为该突变的预测指标,因此可以用于指导治疗。少数胃肠道间质瘤具有琥珀酸脱氢酶(succinate dehydrogenase,SDH)基因亚基的突变,免疫组化中会有SDHB表达缺失、而与具体SDH哪一基因的突变无关。这类胃肠道间质瘤常见于年轻患者的胃部,形态学呈多结节状生长、细胞呈上皮样形态。该组胃肠道间质瘤对于伊马替尼也无效,但其他类型的酪氨酸激酶抑制剂有效;此外,经典的胃肠道间质瘤风险分层方案(根据部位和核分裂的方案)无法预测该组亚型的进展。
NTRK基因家族包括了NTRK1、NTRK2、NTRK3及其他。NTRK基因融合非常罕见,但却可见于多种类型的恶性肿瘤,如食管鳞状细胞癌、胃腺癌、胰腺导管腺癌、结直肠腺癌(常见于微卫星不稳定高、BRAR野生型中),也可见于某些类似胃肠道间质瘤的罕见胃肠道间质性肿瘤中。具有NTRK融合的恶性肿瘤可以通过拉罗替尼(larotrectinib)治疗,该药抑制原肌球蛋白激酶受体(tropomyosin kinase receptors)TrKA、TrKB、TrKC,且2018年11月美国食品和药品管理局已加速批准其用于具有NTRK基因融合的实体性肿瘤。NTRK基因融合可通过pan-TrK免疫组化来检出:所有的融合方式都可见胞质着色,部分融合为细胞核着色或细胞膜着色。
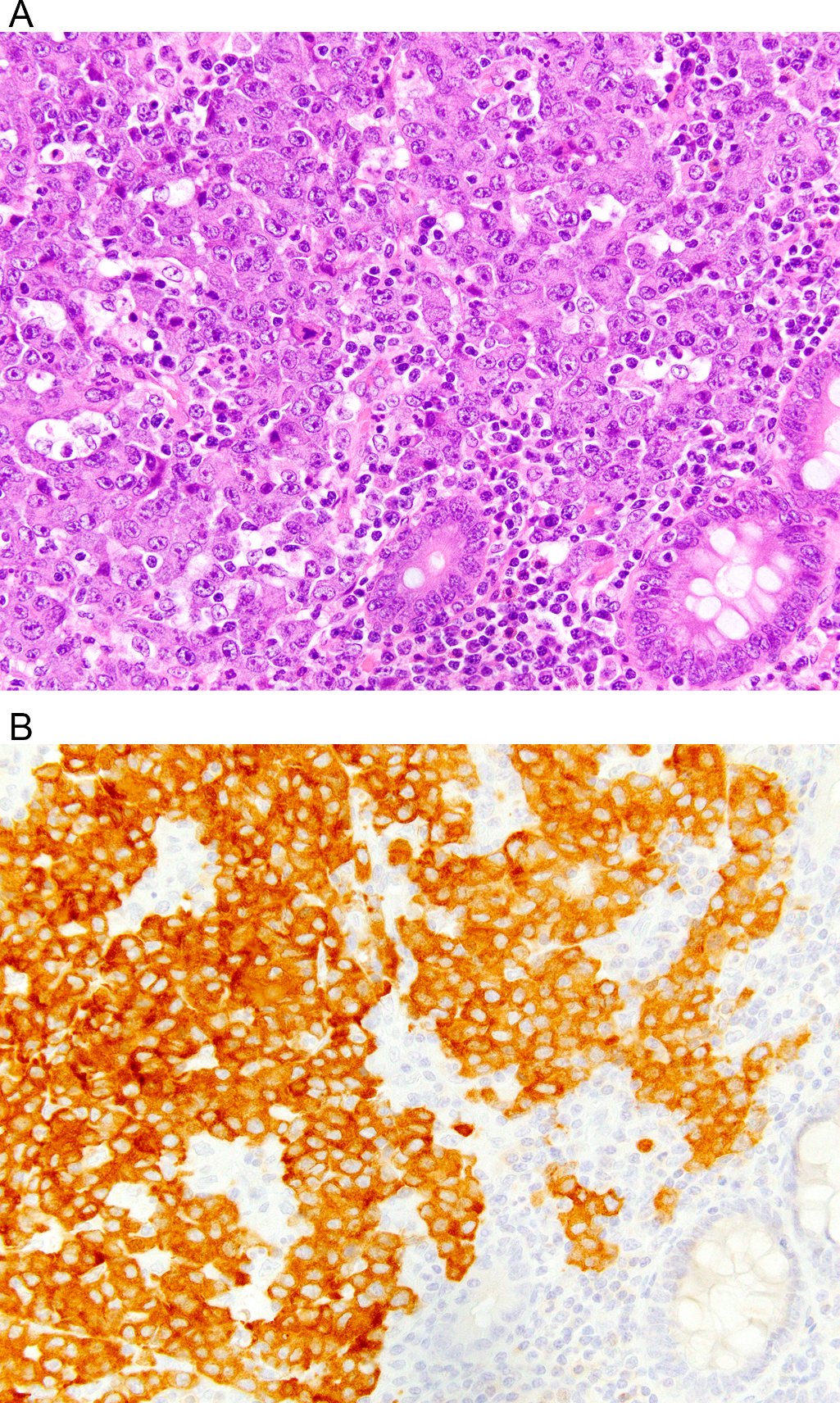
图5. (上)本例结肠癌,HE切片中可见髓样表现,免疫组化证实有错配修复缺陷。(下)免疫组化pan-TrK,肿瘤细胞的胞质阳性着色,后续证实有LMNA-NTRK融合。
SWI/SNF复合体(switch-sucrose non-fermentable complex)的功能是肿瘤抑制因子,相关基因的突变则促进肿瘤发生。发生于这种情况下的恶性肿瘤一般是未分化、伴横纹肌样形态。这类病变在整个胃肠道都有报道,几乎均位于食管/胃食管交界处及结肠。免疫组化可用于这类恶性肿瘤的筛查,因为该组肿瘤一般会有BRG1(由SMARCA4编码)或SMARCA2的表达缺失。这些指标除用于诊断外,还可作为预后判断指标,因为这类癌具有侵袭性行为、预后差。
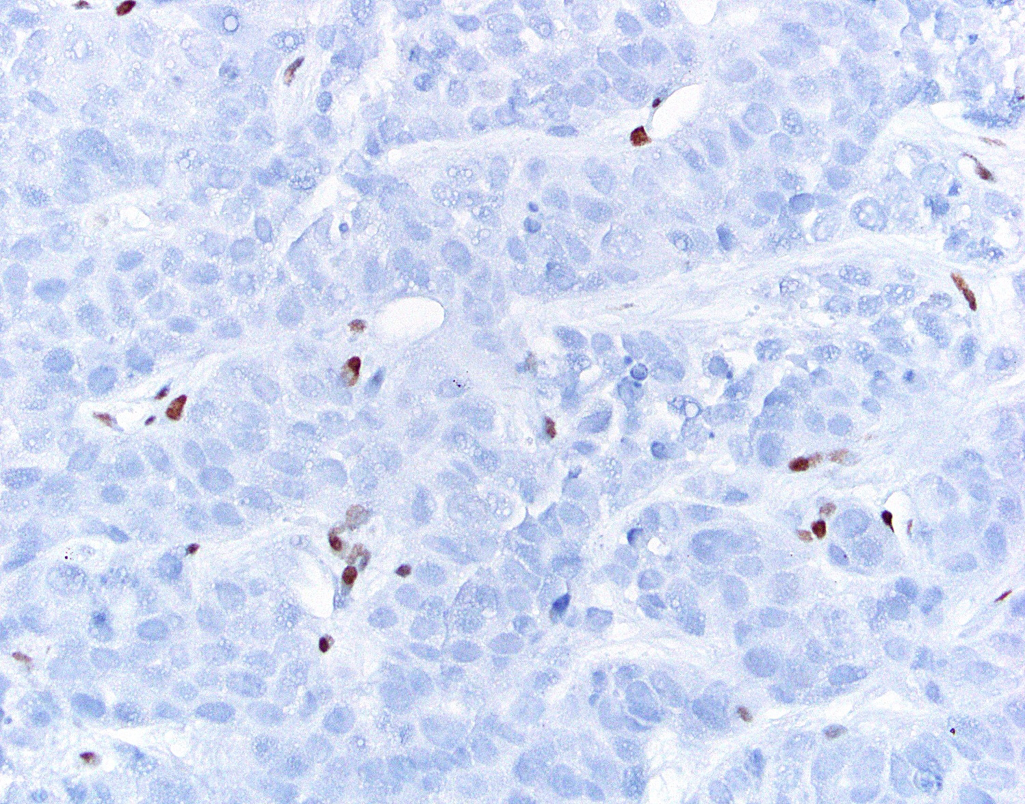
图6. 本例食管未分化癌,免疫组化SMARCA4表达缺失,背景中的淋巴细胞有着色,可作为内对照。
免疫组化p53表达异常可提示TP53基因突变,这一特点在很多恶性肿瘤及前驱病变中常见。不过,p53免疫组化结果有时难以解读,目前也还没有针对TP53突变的治疗方案,且仅TP53突变来说可能没有什么预后意义。因此,免疫组化p53可提高一定信息,但目前并未确定其为胃肠道恶性肿瘤的预测性或预后指标。
全文完
点击下载原文文献
参考文献
Rosenbaum MW, Gonzalez RS. Immunohistochemistry as predictive and prognostic markers for gastrointestinal malignancies. Semin Diagn Pathol. 2022;39(1):48-57.
doi:10.1053/j.semdp.2021.10.003















共0条评论