[导读] 译者:慧海拾穗
弥漫性星形细胞和少突胶质细胞肿瘤(1)
弥漫性星形细胞和少突胶质细胞肿瘤(2)
弥漫性星形细胞和少突胶质细胞肿瘤(3)
弥漫性星形细胞和少突胶质细胞肿瘤(4)
巨细胞胶质母细胞瘤的临床病理学特征
【定义】 是IDH野生型胶质母细胞瘤的组织学亚型,特征性可见奇异的多核巨细胞。巨细胞胶质母细胞瘤通常比普通胶质母细胞瘤预后好。TP53基因突变常见,EGFR基因扩增罕见。
【ICD-0编码】9441/3
【分级】组织学上相当于WHO IV级。
【临床特征】巨细胞胶质母细胞瘤术前病史很短,没有低度恶性前体病变的证据。发病部位和临床症状与IDH野生型胶质母细胞瘤相似。巨细胞胶质母细胞瘤可发生于任何年龄,平均年龄为50岁左右。
【组织病理学】组织学特征是大量多核巨细胞,可包含几个至> 20个细胞核,核仁可以很明显,不典型核分裂象很常见。可有栅栏状和大面积缺血性坏死,可有假菊形团样结构,偶尔可见血管周围淋巴细胞聚集,微血管增生不常见。免疫组化GFAP表达水平不一。80%以上的病例显示P53蛋白阳性,几乎不表达神经元标志物。
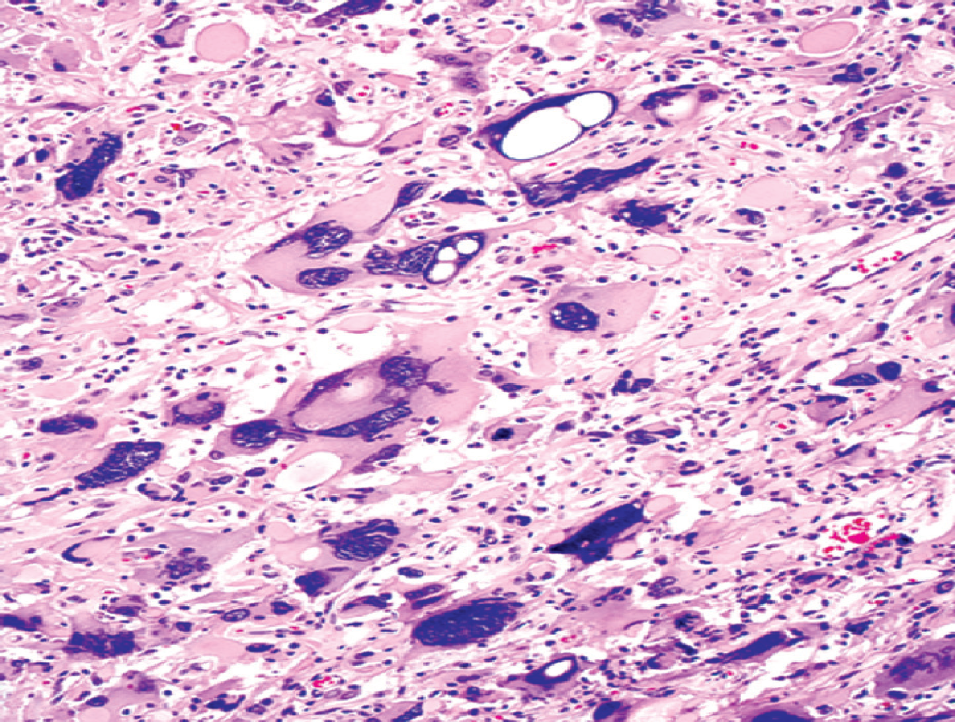
图1:巨细胞胶质母细胞瘤可见奇异多核巨细胞。
胶质肉瘤的临床病理学特征
【定义】 胶质肉瘤是IDH野生型胶质母细胞瘤的一种亚型,其特征是双相组织学模式,交替区域显示胶质细胞和间充质细胞分化。胶质肉瘤主要发生于成年人。该实体最初被定义为胶质母细胞瘤,其中肉瘤成分是增殖的肿瘤血管恶性转化的结果,但有细胞遗传学和分子学证据表明胶质成分和间充质成分均来源于单克隆。虽然通常与典型的(星形细胞)胶质母细胞瘤有关,但胶质肉瘤也可发生在室管膜瘤(室管膜肉瘤)和少突胶质细胞瘤(少突胶质细胞肉瘤)中。胶质肉瘤可以原发性或出现在胶质母细胞瘤的治疗后阶段。预后差。偶有病例全身扩散和/或穿透颅骨。
【ICD-0编码】9442/3
【分级】胶质肉瘤在组织学上相当于WHO IV级。
【流行病学】胶质肉瘤约占所有胶质母细胞瘤的2%,尽管也有更高频率(高达8%)的报道。年龄分布总体上与胶质母细胞瘤相似,好发于40~60岁的患者(平均年龄52岁)。儿童比较罕见。男性稍微多见,男女比例为1.8:1。
【部位】胶质肉瘤通常发生于大脑半球,以频率递减的顺序累及颞叶、额叶、顶叶和枕叶。很少,胶质肉瘤发生在后颅窝,侧脑室或脊髓。像普通胶质母细胞瘤一样,一些胶质肉瘤是多灶性的。
【临床特征】胶质肉瘤的临床表现与IDH野生型胶质母细胞瘤相同,症状持续时间短,反映了肿瘤的位置和颅内压的升高。胶质肉瘤可以在胶质母细胞瘤最初出现时出现,但多数发生于疾病的治疗后过程中。
【影像学】在肉瘤成分占优势的病例中,肿瘤表现为边界清楚的高密度肿块,具有均匀的对比增强,可能类似脑膜瘤。在以胶质瘤成分为主的病例中,影像学特征与胶质母细胞瘤相似。
【扩散】与普通胶质母细胞瘤一样,这种变异型的浸润性生长通常局限于脑实质。侵犯蛛网膜下腔并不常见。血行播散伴颅外转移很少见,但已有报道。
【肉眼检查】由于其结缔组织含量高,肿块边界清晰、质韧,可被误认为转移瘤或(当附着在硬脑膜上时)脑膜瘤。结缔组织不太丰富的病变可能具有胶质母细胞瘤更典型的特征。
【显微镜检查】胶质瘤组织和肉瘤组织的混合物赋予胶质肉瘤一种明显的双相组织模式。胶质部分为星形胶质细胞和间变性,主要表现为胶质母细胞瘤的典型特征。上皮分化表现为癌的特征,伴有腺样或形成腺样和鳞状化生,发生在某些病例的胶质部分。根据定义,肉瘤成分显示恶性转化的迹象(例如核异型性、核分裂活性和坏死),并且通常显示梭形细胞肉瘤的模式,密集的梭形细胞呈长束状并被网状纤维单独包围。偶尔,这种成分有明显多形性。部分病例显示间充质分化,如软骨、骨、骨-软骨样组织、平滑肌和横纹肌的形成,甚至脂肪瘤样特征。原始神经元成分很少出现。组织化学和免疫组织化学联合染色有助于区分这两种成分。三色染色很好地显示了间充质部分的胶原沉积。同样,网状纤维染色显示间充质(但不是胶质)成分中有丰富的结缔组织纤维。恶性间充质成分GFAP阴性对于区分真正的胶质肉瘤和由脑膜侵袭引起的成胶质细胞瘤伴纤维母细胞增生(韧带样增生)很重要。
【免疫表型】无网状蛋白的神经胶质成分对表达GFAP。间充质成分GFAP基本上是阴性的,但是梭形细胞常是阳性的。R132H-突变IDH1的染色几乎在所有病例中都是阴性的。在胶质细胞和间充质细胞成分可阳性表达p53。
【细胞起源】最初,胶质肉瘤被认为是一种碰撞性肿瘤,具有独立的星形细胞成分,肉瘤部分独立于增生的血管。几项免疫组织化学研究似乎支持这一假设,证明了血管性血友病因子、UEA-I和单细胞标志物的免疫反应性。另一种假设是肉瘤部分是由于晚期神经胶质瘤去分化导致的,随后GFAP表达缺失并获得肉瘤表型。在一项使用FISH的研究中,3个胶质肉瘤中有2个在胶质成分和间充质成分中显示出相同的10号和17号染色体数目畸变,而在第三个病例中,X三体仅限于软骨肉瘤成分。在另一项研究中,使用FISH、比较基因组杂交、微卫星等位基因不平衡分析和细胞遗传学分析,在胶质和间充质成分中观察到类似的细胞遗传学模式。这些结果表明这两种成分都来源于肿瘤性神经胶质细胞。对两种肿瘤成分中p53免疫反应的观察进一步支持了这一解释。在2例胶质肉瘤中证明了单克隆起源,其中胶质细胞瘤和肉瘤成分均含有相同的TP53突变。此外,在其他胶质肉瘤病例的胶质瘤和肉瘤肿瘤成分中检测到相同的PTEN、TP53和TERT突变。胶质肉瘤两个组分的单克隆性也通过鉴定两个肿瘤区域中的CDKN2A缺失和MDM2和CDK4共植入得到证实。这些研究有力地支持了肉瘤区域是胶质母细胞瘤细胞表型改变的结果,而不是两种不同肿瘤同时发生的指征的假设。
【遗传表达谱】胶质肉瘤存在PTEN突变、CDKN2A缺失和TP53突变,EGFR扩增不常见,表明它们具有独特的表达谱,类似于IDH野生型胶质母细胞瘤(除了EGFR扩增不常见)。在20例神经胶质瘤中进行的比较基因组杂交发现7号染色体(75%的病例存在)、X染色体(20%)、染色体9q(15%)和20q(15%)获得、10号染色体(35%)、染色体9p(35%)和13q(15%)丢失。在胶质细胞瘤和间充质细胞成分中也发现了类似的基因改变,表明是单克隆起源。间充质肿瘤区域的特征是表达SNAI2、TWIST、MMP2和MMP9,表明上皮肿瘤中的上皮-间质转化机制也可能在胶质肉瘤的间充质分化中起作用。基于微阵列的胶质和间充质肿瘤区域的比较基因组杂交分析也表明间充质成分可能来源于胶质细胞。
【预后和预测因素】 大型临床试验未能揭示胶质肉瘤和典型胶质母细胞瘤之间结果的有任何显著差异。然而,已经有多份关于脑胶质瘤伴全身转移甚至侵犯颅骨的报告。
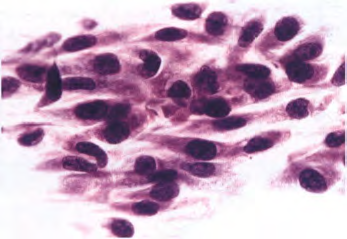
图2 胶质肉瘤:梭形细胞通常具有核分裂活性,是涂片中的典型特征。
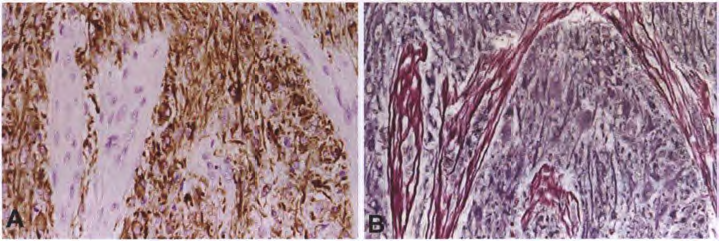
图3胶质肉瘤双相模式:连续切片显示(A)表达GFAP的神经胶质瘤组织和(B)含有网状纤维但缺乏GFAP表达的肉瘤区域交替出现。
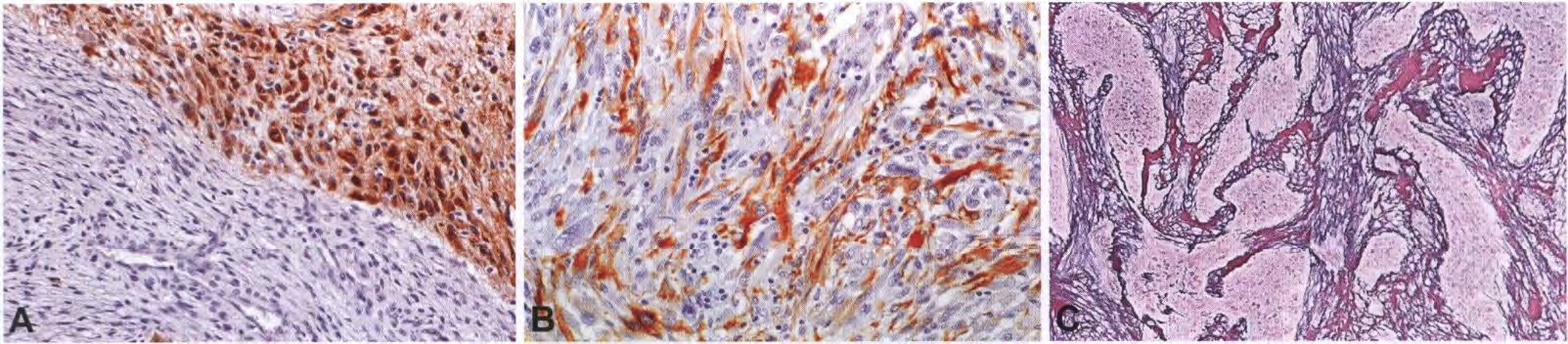
图4 胶质肉瘤:胶质细胞瘤成分强表达GFAP,可能(A)与肉瘤细胞分离或(B)与肉瘤细胞混合。双相组织模式为富含网状蛋白的肉瘤样和无网状蛋白的胶质瘤样成分。
上皮样胶质母细胞瘤的临床病理学特征
【定义】上皮样胶质母细胞瘤是一种高级别弥漫性星形细胞肿瘤变异型,主要由紧密排列的上皮样细胞、一些横纹肌样细胞、活跃的核分裂象、微血管增生和坏死组成。上皮样胶质母细胞瘤主要发生于年轻人和儿童,好发于大脑或间脑,是一种侵袭性肿瘤,生存期短,尤其是儿童。与其他胶质母细胞瘤相比,上皮样胶质母细胞瘤(~50%)携带BRAF V600E突变更常见。上皮样胶质母细胞瘤不同于具有低分化SMARCB1缺陷成分(可能含有横纹肌样细胞并呈现多免疫表型)的胶质瘤或胶质神经元肿瘤。它也不同于伴有上皮化生的胶质母细胞瘤,后者表现为腺体形成和鳞状化生。应避免使用“横纹肌样胶质母细胞瘤”一词。此前报道的肿瘤要么是没有SMARCB1或SMARCA4改变证据的上皮样胶质母细胞瘤,要么是具有SMARCB1缺陷细胞群的罕见胶质母细胞瘤,应区分具有不同遗传特征的上皮样胶质母细胞瘤。上皮样胶质母细胞瘤可能与多形性黄色瘤型星形细胞瘤共存,但上皮样胶质母细胞瘤与多形性黄色瘤型星形细胞瘤恶性进展之间的关系需要进一步阐明。
【ICD-0编码】9440/3
【分级】上皮样胶质母细胞瘤在组织学上相当于WHO IV级。
【流行病学】由于上皮样胶质母细胞瘤的发病率各家报道不一,数据尚不可用。
【病因学】上皮样胶质母细胞瘤的病因和细胞来源尚不清楚,但大多数病例是原发性的。在几个经证实表达SMARCB1的上皮样胶质母细胞瘤病例中,活检证实低级别星形细胞瘤是上皮样肿瘤的先兆或共存肿瘤。多形性黄色瘤型星形细胞瘤的间变性进展可以表现为上皮样胶质母细胞瘤,这一事实增加了这两个实体可能相关的可能性,这种关联增强是因为它们共同有高频率的BRAFV600E突变。
【部位】上皮样胶质母细胞瘤主要发生于大脑皮层和间脑。颞叶和额叶是常见的部位,但任何一个叶都可能受到影响。罕见的例子发生在小脑,但没有发生在脊髓的报告。
【临床特征】上皮样胶质母细胞瘤的临床表现与其他胶质母细胞瘤相似;大多数患者出现颅内压升高的症状和体征,尽管少数患者表现出神经功能缺损或癫痫。研究很少提示前体病变,但是已经有几个关于多形性黄色瘤型星形细胞瘤或WHO II级星形细胞瘤转化的报道。
【影像学】在核磁共振成像上,上皮样胶质母细胞瘤的特征性表现为一个增大的实性肿块,偶尔伴有囊肿。上皮样胶质母细胞瘤易出血,常通过软脑膜扩散。
【扩散】上皮样胶质母细胞瘤表现出遍及神经轴的扩散趋势,在所有患者中多达三分之一的患者表现出软脑膜扩散。有儿童患者扩散到头皮的报道。
【肉眼检查】典型的上皮样胶质母细胞瘤是单病灶,尽管至少有一例报道为多灶性分布,并且可能发生转移。虽然大体检查没有病理特征,但出血和坏死可能很明显。偶尔会发现表面位置,甚至有硬脑膜附着。软脑膜扩散相对常见。囊肿形成时有发生,但不是常见的特征。
【显微镜检查】上皮样胶质母细胞瘤以相对一致的上皮样细胞群为主,表现为局灶性脱落、很少的介入神经细胞、明显的细胞膜、嗜酸性细胞质、缺乏细胞质突起和横向定位的细胞核。电镜下描述或寻找细胞质丝状球的频率有所不同,但在上皮样胶质母细胞瘤中发现了一些横纹肌样细胞。与多形性黄色瘤型星形细胞瘤相比,上皮样胶质母细胞瘤中黄色瘤样改变较少,尽管已注意到异常病例含有巨细胞、脂质化、促结缔组织增生反应或细胞质空泡。Rosenthal纤维和嗜酸性颗粒小体不是上皮样胶质母细胞瘤的特征。根据定义,鳞状细胞巢、腺体形成和腺样特征是不存在的。坏死是存在的,但通常是带状的,而不是栅栏状。一些报道已经注意到微血管增生相对缺乏,但是其他报道已经发现上皮样胶质母细胞瘤和典型胶质母细胞瘤的血管模式没有实质性差异。
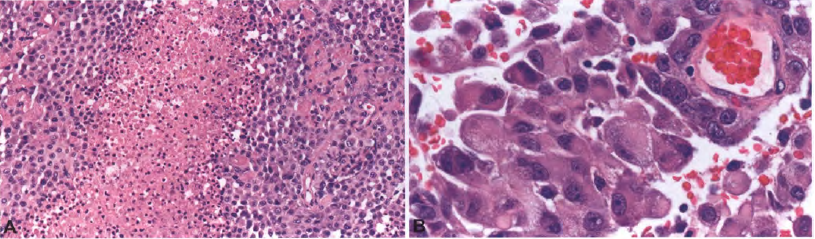
图5 上皮样胶质母细胞瘤:大多数病例可见坏死灶(A),肿瘤细胞可能呈上皮样、横纹肌样或肥胖型细胞形态(B)。
【免疫表型】上皮样胶质母细胞瘤表达S100和vimentin。GFAP的表达通常是不完整的,在少数病例完全不存在于肿瘤的大部分区域。一些上皮样胶质母细胞瘤表达上皮标志物、细胞角蛋白和EMA。因为典型的胶质母细胞瘤有时表达细胞角蛋白AE1/AE3或EMA,在没有额外形态学证据的情况下,不能根据上皮免疫表型而诊断为上皮样变异型。可局灶表达突触素或NFP。上皮样胶质母细胞瘤不表达melan-A、desmin、 myoglobin或SMA。SMARCB1在整个肿瘤细胞群中均阳性表达。也已经证实了存在SMARCA4的表达。使用识别V600E突变BRAF的VE1抗体显示约50%的上皮样胶质母细胞瘤阳性表达,这与测序结果一致。
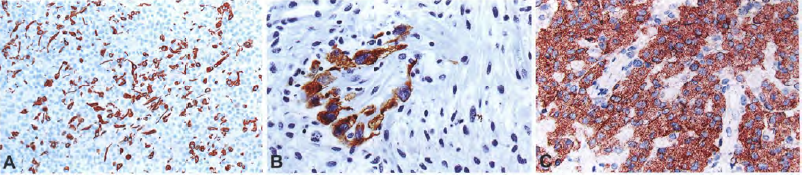
图6 上皮样胶质母细胞瘤:大多数肿瘤含有大量的GFAP阳性细胞,尽管在其他肿瘤中可能很少(A)。局灶性细胞角蛋白表达(B),EMA也可能表达。约半数病例存在BRAF V600E突变,突变基因产物的表达可通过免疫组织化学检测(C)。
【遗传表达谱】在大约一半的上皮样胶质母细胞瘤中检测到BRAF V600E的突变。在单个上皮样胶质母细胞瘤中报告了H3F3A K27M突变,但其他H3F3A和HIST1H3B突变尚未报告。上皮样胶质母细胞瘤也缺乏IDH1和IDH2突变。高级别胶质瘤相关基因的拷贝数改变偶尔出现;EGFR扩增、CDKN2A纯合性缺失和PTEN缺失已有报道,但PDGFRA、PTEN和MET基因的拷贝数改变很少。
【遗传易感性】没有上皮样胶质母细胞瘤与发育异常或遗传性肿瘤综合征相关的报道。
【预后和预测因素】不管是成人还是儿童患者,上皮样胶质母细胞瘤的预后都特别差。尽管有各种辅助治疗,但也容易出现早期进展,中位生存时间分别为成人6.3个月(范围:0.6~82个月)和儿童5.6个月(范围:1.5~9.7个月)。
···未完待续···



















共0条评论