[导读] 译者:慧海拾穗
弥漫性星形细胞和少突胶质细胞肿瘤(1)
弥漫性星形细胞和少突胶质细胞肿瘤(2)
间变性星形细胞瘤,IDH野生型
【定义】
一种弥漫性浸润性星形细胞瘤,具有局灶性或散在间变性和显著的增殖活性,但无IDH基因突变。
IDH野生型间变性星形细胞瘤并不常见,约占所有间变性星形细胞瘤的20%。
尽管如此,在WHO II级和III级弥漫性胶质瘤变异型中,组织学定义的间变性星形细胞瘤野生型IDH1和IDH2的发生率最高。
大多数组织学类似于间变性星形细胞瘤但没有IDH突变的胶质瘤与IDH野生型胶质母细胞瘤具有相同的分子特征,如果H3 K27M突变型胶质瘤优先位于中线位置,有时也具有相同的分子特征。这类肿瘤在临床上比间变性星形细胞瘤更具侵袭性,其临床过程可能与胶质母细胞瘤更相似。
【分级】
IDH野生型间变性星形细胞瘤在组织学上相当于WHO III级。
与其他弥漫性胶质瘤一样,间变性星形细胞瘤在最初的临床表现中可能表现为广泛累及CNS的脑胶质瘤病模式,受影响的区域从一个大脑半球的大部分(三个或更多叶)到两个大脑半球,还累及深灰质结构、脑干、小脑和脊髓。在没有大脑皮质受累的情况下,也可以看到深灰质结构(即基底神经节和丘脑)、脑干、小脑和脊髓类似的广泛弥漫性受累。胶质瘤病曾被认为是一种独特的疾病实体,但现在被认为是一种异常广泛的神经轴受累模式。它可以在任何弥漫性胶质瘤亚型中看到,但在间变性星形细胞瘤中最常见。没有独特的分子标记来区分神经胶质瘤病和特征明确的弥漫性神经胶质瘤亚型,但IDH突变似乎仅限于具有独特实体瘤成分的肿瘤。
间变性星形细胞瘤,非特指型
【定义】
一种具有间变性星形细胞瘤形态学特征的肿瘤,但其IDH突变状态尚未完全评估。
间变性星形细胞瘤中IDH突变状态的全面评估包括对IDH1密码子132和IDH2密码子172突变的序列分析,其中IDH1 R132H突变的免疫组化结果为阴性。
【ICD-0编码】9401/3
【分级】
非特指型间变性星形细胞瘤在组织学上相当于WHO III级。
胶质母细胞瘤,IDH野生型
【定义】
一种以星形胶质细胞分化为主的高级别胶质瘤,其特征是有核异型性、细胞多形性(大多数病例)、核分裂活跃和典型的弥漫生长模式以及微血管增生和/或坏死;并且缺乏IDH基因突变。IDH-野生型胶质母细胞瘤是最常见、恶性程度最高的星形胶质细胞瘤,约占所有胶质母细胞瘤的90%,好发于成人,诊断时患者平均年龄为62岁,男女比例约为1.35:1。正如同义词“IDH野生型原发性胶质母细胞瘤”所示,这种胶质母细胞瘤通常是原发性的,没有可识别的低级别前体病变。好发于幕上是其特征。肿瘤弥漫浸润邻近和远处的脑组织。
【ICD-0编码】9440/3
【分级】
胶质母细胞瘤及其变异体在组织学上相当于WHO IV级。然而,在目前的治疗环境下,IDH突变型胶质母细胞瘤的临床过程可能不如WHO IV肿瘤的典型过程具有侵袭性。
【同义词】原发性胶质母细胞瘤,IDH野生型
【流行病学】
① 发生率
胶质母细胞瘤是成人最常见的恶性脑肿瘤,约占所有颅内肿瘤的15%,约占所有原发性恶性脑肿瘤的45~50%。在大多数欧洲和北美国家以及澳大利亚,年发病率约为3~4例/10万人,而东亚的发病率相对较低,例如韩国为每0.59例/10万人。根据美国标准人群调整后,美国胶质母细胞瘤的年发病率为3.19例/10万人。在瑞士的一项基于人口的研究中,相应的比率(根据欧洲标准人口进行调整)为3.55例/10万人。据报道,亚洲和非洲国家的发生率明显较低,但这可能在很大程度上是由于不确定性。
② 年龄和性别分布
胶质母细胞瘤可以出现在任何年龄的患者中,但好发于老年人,发病率高峰为55~85岁。胶质母细胞瘤是年龄大于55岁的成人中第二常见的颅内肿瘤。胶质母细胞瘤很少发生于40岁以下患者。在美国,胶质母细胞瘤患者的中位年龄为64.0岁,0~19岁年龄组的年发病率(根据美国标准人群进行调整)为0.14例新发病例/10万人。IDH野生型胶质母细胞瘤诊断时患者的平均年龄为62岁。胶质母细胞瘤的男女比例美国为1.60:1,瑞士为1.28:1。
【病因学】
一小部分胶质母细胞瘤是作为特定孟德尔综合征的部分遗传的(见遗传易感性),但大多数胶质母细胞瘤的病因仍然未知。
一系列环境和遗传因素已被认为是胶质母细胞瘤的潜在原因。
迄今为止,这些调查产生了不确定或负面的结果,包括关于非电离辐射(例如来自移动电话)和职业暴露的潜在影响的结果。
唯一确认的风险相关因素是头部和颈部电离辐射后风险增加,有过敏史和/或特应性疾病史的个体风险降低。全基因组关联研究已经确定了一些与胶质母细胞瘤相关的特定遗传风险变异(见遗传易感性)。我们对胶质母细胞瘤异质性的理解随着基因组技术的使用而增加,我们发现和验证胶质母细胞瘤亚型特异性风险因素的能力可能会提高。
【部位】
胶质母细胞瘤最好发于大脑半球的皮质下白质和深层灰质。在苏黎世大学医院的一系列987例胶质母细胞瘤中,最好发部位是颞叶(31%)、顶叶(24%)、额叶(23%)和枕叶(16%)。在美国也可以看到类似的好发部位。原发性、IDH野生型型胶质母细胞瘤具有广泛的解剖分布,而继发性IDH突变型胶质母细胞瘤好发于额叶,尤其是在头侧脑室周围的区域。
一般来说,肿瘤浸润延伸到邻近的皮质,并通过胼胝体进入对侧半球。基底神经节和丘脑的胶质母细胞瘤很常见,尤其是在儿童中。脑干胶质母细胞瘤是不常见的,好发于儿童(另见弥漫中线胶质瘤,H3 K27M突变)。小脑和脊髓是少见的部位。
【临床特征】
胶质母细胞瘤发展迅速。症状在很大程度上取决于肿瘤的位置,主要表现为局灶性神经功能缺损(如偏瘫和失语)和伴随颅内压升高的肿瘤相关水肿。多达半数患者是在首次发作后被诊断出来的。其他常见症状是行为和神经认知改变、恶心和呕吐,偶尔还有严重的搏动性头痛。在对677例IDH野生型胶质母细胞瘤患者的研究中,68%的患者从首次症状到诊断的时间< 3个月,84%的患者< 6个月。对于症状持续时间明显较长的患者,应考虑从低级别星形细胞瘤演变而来的IDH突变型胶质母细胞瘤的可能性。
【肉眼检查】
尽管在许多情况下症状持续时间很短,但胶质母细胞瘤在出现时通常令人惊讶地大,并且可以占据一叶的大部分。病变通常是单侧的,但脑干和胼胝体的病变可以是双侧对称的。幕上双侧延伸是沿着有髓结构生长的结果,特别是穿过胼胝体和连合处。大多数大脑半球的胶质母细胞瘤明显是脑实质内的,脑白质中有一个中心。很少,它们主要是表面的,与软脑膜和硬脑膜接触,可能被神经放射科医师或外科医生解释为转移性癌,或轴外病变,如脑膜瘤。皮质浸润可在脑白质坏死区产生一层增厚的灰色皮质,形成一层保留的回状边缘。
胶质母细胞瘤切面颜色多样,周围为灰色肿瘤块,中心区域因髓鞘破坏而呈黄色坏死。周围的富于细胞区在肉眼表现为一个质软灰色到粉红色的边缘或一个灰色的肿瘤组织带。然而,坏死组织也可能与邻近的脑结构相邻,而没有肉眼可见的肿瘤组织的中间区域。中央坏死可占肿瘤总质量的80%。胶质母细胞瘤通常带有红色和棕色的近期和远期出血病灶。大量出血会发生并导致中风样症状,这有时是肿瘤的第一个临床症状。当存在肉眼可见的囊肿时,囊内含混浊的液体并构成液化的坏死肿瘤组织,与WHO II级弥漫性星形细胞瘤中存在的轮廓清晰的滞留囊肿形成对比。
【显微镜检查】
胶质母细胞瘤是一种典型的富于细胞的胶质瘤,通常由低分化、有时多形性的肿瘤细胞组成,具有核异型性和活跃的核分裂象。显著的微血管增生和/或坏死是重要的诊断特征。
正如过时的术语“多形性胶质母细胞瘤”所示,这种肿瘤的组织病理学变化很大。一些病变表现出富于细胞和核多形性,有许多多核巨细胞;其他的高度富于细胞,但形态相对单一。
肿瘤的星形胶质细胞性质在某些肿瘤中很容易识别(至少局灶),但在低分化肿瘤中很难识别。胶质母细胞瘤的区域异质性明显,使得通过立体定向针活检获得的标本难以进行组织病理学诊断。
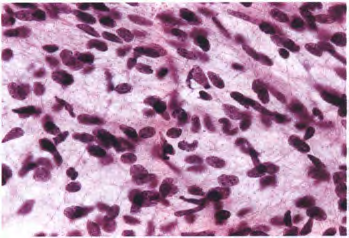
图1 IDH野生型胶质母细胞瘤。这种术中涂片显示小而细长的双极细胞,这是胶质母细胞瘤的特征性成分。
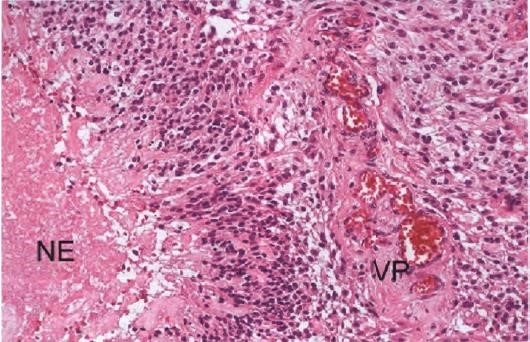
图2 IDH野生型胶质母细胞瘤的诊断标志:缺血性坏死(NE)区域周围可见栅栏状肿瘤细胞和玻璃样变的增生血管(VP)。
胶质母细胞瘤的诊断通常基于组织模式的识别,而不是特定细胞类型。
需要存在高度间变的胶质细胞、核分裂活性和微血管增生和/或坏死。这些关键特征在肿瘤内的分布是可变的,但是大的坏死区域通常占据肿瘤中心,而存活的肿瘤细胞倾向于聚集在外围。富于细胞和异常血管的周围区域对应于影像学上看到的对比增强环,并且是粗针活检的合适目标。微血管增生可见于整个病变,但通常在坏死灶周围和周围浸润区最为明显。
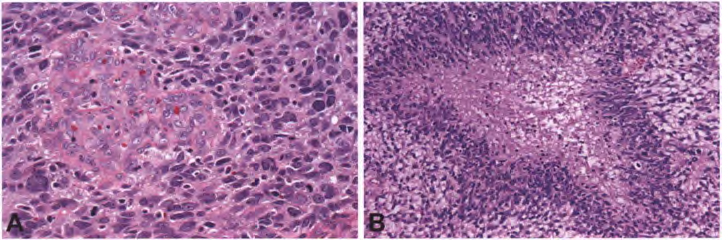
图3 IDH野生型胶质母细胞瘤:胶质母细胞瘤中的微血管增生通常具有肾小球样外观(A)。不规则坏死区周围有密集的肿瘤细胞呈栅栏状堆积(B)。
【细胞组成和组织学模式】
很少的肿瘤像胶质母细胞瘤那样成分不均一。差分化、梭形、圆形或多形性细胞可能占优势,但分化较好的肿瘤性星形胶质细胞通常是可辨别的,至少在局部是可辨别的。对于由WHO II级弥漫性星形细胞瘤进展而来的胶质母细胞瘤尤其如此,但这些是典型的IDH突变型胶质母细胞瘤。仍然具有可识别的星形胶质细胞分化和高度间变性细胞的区域之间的转变可以是连续的或突然的。在肥胖型细胞病变的病例中,间变性肿瘤细胞可能与分化的肥胖细胞广泛混合。形态学的突然改变可能反映了通过获得一种或多种额外的遗传改变而出现了新的肿瘤克隆(参见下面的原始神经元细胞和具有原始神经元成分的胶质母细胞瘤)。细胞多形性包括小细胞、未分化、脂质化、颗粒状和巨细胞。也经常有双极、梭形细胞形成交叉束的区域,并以束状为主。当高度多形性肿瘤细胞具有清晰的细胞质膜轮廓和缺乏细胞突起时可能类似于转移性癌或黑色素瘤。
胶质母细胞瘤中常见几种细胞形态。一些胶质母细胞瘤具有公认的模式,其特征是特定细胞类型占优势。这些形态将在下面的小节中讨论,如果特定的细胞形态占优势,也可以建立相应的胶质母细胞瘤模式。因为这些胶质母细胞瘤模式大部分是在IDH野生型胶质母细胞瘤中发现的,所以在这里讨论它们,但是认识到其中一些变异型(例如,肥胖型星形细胞瘤进展为胶质母细胞瘤)更具有IDH突变型胶质母细胞瘤的特征。
① 小细胞和小细胞胶质母细胞瘤
这种亚型的特点是高度单形的小、圆到稍长、深染的细胞核占优势,具有极少量细胞质,很少有核异型性,以及(通常)活跃的核分裂象。在浸润区,肿瘤细胞可能很难被识别,因为它们体积小,细胞学形态温和。
GFAP染色程度不一,Ki-67增殖指数通常较高。由于肿瘤细胞核规则、核周透亮、可见微钙化和鸡笼样微血管,这些肿瘤与间变性少突胶质细胞瘤有重叠。但与少突胶质细胞瘤不同,小细胞胶质母细胞瘤经常有EGFR扩增(70%的病例存在)和10号染色体丢失(95%以上病例)。
和其他原发性胶质母细胞瘤一样,不存在IDH突变。有报道发现TP53突变在该亚型中稍微不常见,但差异无统计学意义。小细胞亚型的临床表现与其他原发性胶质母细胞瘤相似,中位生存期为11个月;约1/3的病例表现为无强化或最低程度强化的肿块,在组织学上没有微血管增生或坏死的证据。然而,2~3个月后的随访影像通常显示环增强,这些病例的生存期较短(中位时间为6个月),表明这些病例构成WHO IV级胶质母细胞瘤的早期表现,而不是WHO III级间变性星形细胞瘤。
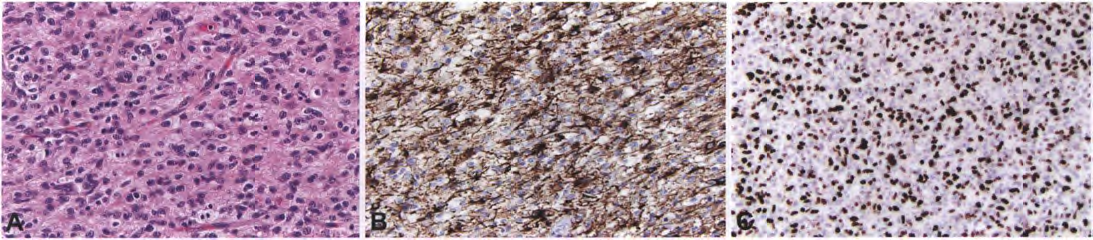
图4 小细胞胶质母细胞瘤:EGFR扩增并1p/19q完整的IDH野生型小细胞胶质母细胞瘤的中央部分显示形态单一的小肿瘤细胞,尽管仅有轻度核异型性,但核分裂象较多(A)。瘤细胞表达GFAP(B),Ki-67增殖指数很高(C)。
② 原始神经元细胞和具有原始神经元成分的胶质母细胞瘤
这种亚型构成了一个典型的弥漫性胶质瘤,有一个或多个看起来像实性的原始结节并显示神经元分化。胶质瘤成分通常是星形胶质细胞,尽管在少突胶质细胞瘤中也报道了罕见的原始神经元成分。原始成分与邻近的神经胶质瘤界限分明,显示明显增加细胞密度、高核质比和核分裂指数。其他特征包括Homer Wright菊形团、细胞内陷和间变性细胞形态,类似于髓母细胞瘤或其他中枢神经系统胚胎性肿瘤。
免疫组化显示原始神经元表达Syn、GFAP表达减少或丧失,以及与胶质瘤的邻近病灶相比Ki-67增殖指数显著升高。
这种亚型表现为原发或从已知的弥漫性胶质瘤发展而来。在这两种情况下,生存时间和遗传背景与一般胶质母细胞瘤相似。然而,这种亚型的特点是脑脊液播散率高(30-40%),MYCN或MYC基因扩增频率高(~40%)。MYC扩增仅在原始出现的结节中发现,鉴于在N-myc驱动的鼠前脑肿瘤中观察到类似的表型,这种改变可能至少部分驱动原始出现的克隆转化。在某些情况下,新的10q丢失或10q丢失的扩展区域也在原始神经元成分中发现。这种亚型的一些例子是继发性胶质母细胞瘤的证据包括一些患者的低级别前体病史,典型的强而弥漫的p53阳性,以及15~20%的病例中存在IDH1 R132H突变。
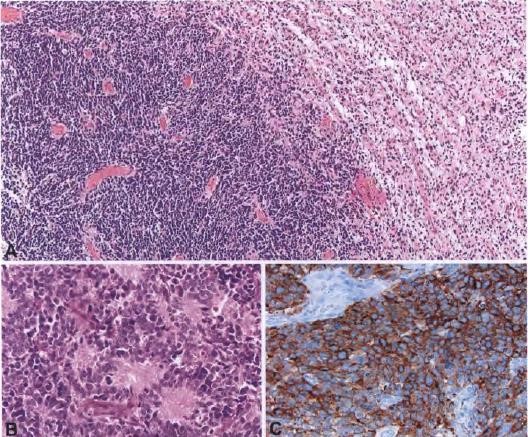
图5 具有原始神经元成分的胶质母细胞瘤:右侧为弥漫性星形细胞瘤成分,左侧为原始神经元成分(A)。Homer Wright菊形团位于胶质母细胞瘤的原始神经元成分中(B)。原始细胞强表达Syn(C)。
③ 少突胶质细胞瘤成分
偶尔的胶质母细胞瘤包含类似少突胶质细胞瘤的成分。这些区域的大小和频率各不相同,各个病理学医生识别少突胶质细胞瘤特征的阈值也各不相同。对恶性胶质瘤的两项大型研究表明,在具有少突胶质细胞和星形胶质细胞成分的间变性胶质瘤中,坏死与明显更差的预后相关;肿瘤坏死的患者比肿瘤未坏死的患者中位总生存期短得多。这种肿瘤被归类为具有少突胶质成分的胶质母细胞瘤,它们可能比标准的胶质母细胞瘤具有更好的预后。最近的研究表明,这是一个异质性肿瘤组,有些病例是IDH1或/IDH2突变的胶质母细胞瘤。WHO目前的分类不认为具有少突胶质细胞瘤成分的胶质母细胞瘤是一个独特的疾病类型;通过遗传学分析,应该可以将这类肿瘤分类为IDH野生型胶质母细胞瘤(特别是小细胞型,与少突胶质细胞的形态重叠)、IDH突变型胶质母细胞瘤或IDH突变型和1p/19q共缺失型间变性少突胶质细胞瘤。
④ 肥胖细胞和肥胖型星形细胞肿瘤
肥胖细胞胞质丰富、玻璃样、非纤维素样,深染的成角细胞核位于细胞一侧。胞质突起短而粗。
GFAP染色多位于细胞外围,中央透明的细胞器丰富的区域基本上没有染色。血管周围淋巴细胞常聚集在肥胖细胞区,但在同一肿瘤的其他区域罕见。当大量存在时,特别是在已知患有预先存在的神经胶质瘤的患者中(例如,IDH突变型肥胖型星形细胞瘤),这些细胞可能在继发性IDH突变型胶质母细胞瘤中构成低级前体病变。在影像学上,分化较好的区域有时可被确定为非对比增强的外周区域,在全脑切片中,可被确定为与胶质母细胞瘤病灶明显不同的WHO II至III级星形细胞瘤。免疫组织化学研究强调了肿瘤性肥胖细胞本身的低增殖率,尽管据报道,WHO II级或III级肥胖型星形细胞瘤发展为胶质母细胞瘤的趋势比相同级别的非肥胖型星形细胞瘤发展得更快。增殖成分表现为具有较大深染细胞核和少量细胞质的细胞群。
⑤ 多核巨细胞
大的多核肿瘤细胞通常被认为是胶质母细胞瘤的标志,其大小和多形性不一。
虽然常见,但多核巨细胞的存在既不是必需的特征,也不与更积极的临床过程相关。尽管外表如此,这些细胞被认为是一种退化性变化。如果镜下以多核巨细胞为主,那诊断为巨细胞胶质母细胞瘤更合适(参见巨细胞胶质母细胞瘤)。
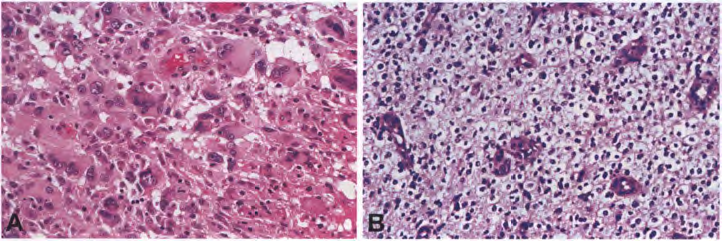
图6 IDH野生型胶质母细胞瘤:多核巨细胞高度间变(A)。局灶少突胶质细胞瘤样成分(B)。
⑥ 颗粒细胞和颗粒细胞星形细胞瘤/胶质母细胞瘤
胶质母细胞瘤内可散在大细胞,这些细胞胞质颗粒状、PAS阳性。极少数病例以颗粒细胞为主,并造成一种形态相似但不相关的垂体柄颗粒细胞瘤的。在大脑半球,颗粒细胞和肿瘤性星形胶质细胞之间的过渡形式在某些情况下可以识别,但在其他情况下,很难识别任何经典的星形胶质细胞瘤成分。尽管肿瘤细胞更大、颗粒更粗,但也类似于巨噬细胞。特别是在血管周围慢性炎症的情况下,肿瘤细胞可能被误解为富含巨噬细胞的病变,如脱髓鞘疾病。考虑到它们的溶酶体含量,颗粒状肿瘤细胞可能表达巨噬细胞标志物CD68,但不表达巨噬细胞特异性标志物CD163。偶尔细胞可能表达GFAP,但大多数细胞是阴性的。一些弥漫性星形细胞肿瘤以广泛的颗粒细胞改变为特征,被称为“颗粒细胞星形细胞瘤”或“颗粒细胞胶质母细胞瘤”。这些病变具有明显的组织学外观,通常以侵袭性胶质母细胞瘤样临床行为为特征,即使组织学仅提示WHO II 级或III级;对59例病例随访发现,WHO II 级病例的中位生存期为11个月,WHO III~IV级病例的中位生存期为9个月。
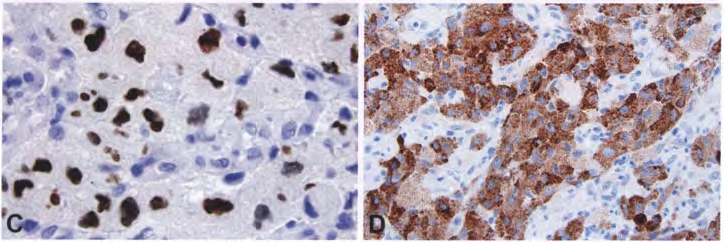
图7 颗粒细胞胶质母细胞瘤。嗜酸性细胞质让人想起垂体的颗粒细胞瘤,但在细胞学上有更不典型的细胞(A)。GFAP阳性表达(B)。细胞核强表达0LIG2有助于建立其神经胶质谱系(C)。与大多数胶质母细胞瘤相反,颗粒细胞变异型通常表达EMA(D)。
⑦ 脂质细胞和重度脂质化胶质母细胞瘤
具有泡沫样细胞质的细胞是胶质母细胞瘤的另一个特征。以具有高度脂质化(泡沫状)的肿瘤细胞为主时被称为少见的恶性胶质瘤。脂质化的细胞可能会明显增大。如果这种病变发生于年轻患者,应考虑诊断为多形性黄色瘤型星形细胞瘤,特别是如果黄色瘤细胞被基底膜包围,网状蛋白染色阳性,并伴有嗜酸性颗粒小体。其他富含脂质的病变具有上皮样细胞学特征。其他完全脂质化(即非泡沫状)细胞呈分叶状时可以类似于脂肪组织。
•••未完待续•••




















共0条评论