涎腺肿瘤的分子病理学研究进展(1)
腺样囊性癌
腺样囊性癌(AdCC)是一种生长缓慢但最终致命的常见唾液腺恶性肿瘤。 AdCC由上皮和肌上皮细胞组成,形成各种结构形态,包括筛状、管状和实性模式。大多数AdCC最终会出现频繁的局部复发、转移和神经周侵犯。在少数AdCC中可以看到高级别转化或去分化。目前的治疗方案不足以有效控制疾病。
AdCC的主要基因组改变是导致MYB-NFIB融合的重现性易位。一个类似的涉及MYBL1-NFIB融合的重排是另一个主要的分子改变。MYB和MYBL1以互斥的方式融合可能是AdCC的驱动突变。 一般来说,AdCC具有相对稳定的基因组,几乎没有其他突变和拷贝数改变。基因组测序分析报告表明,外显子体细胞突变率低,突变多样性广。
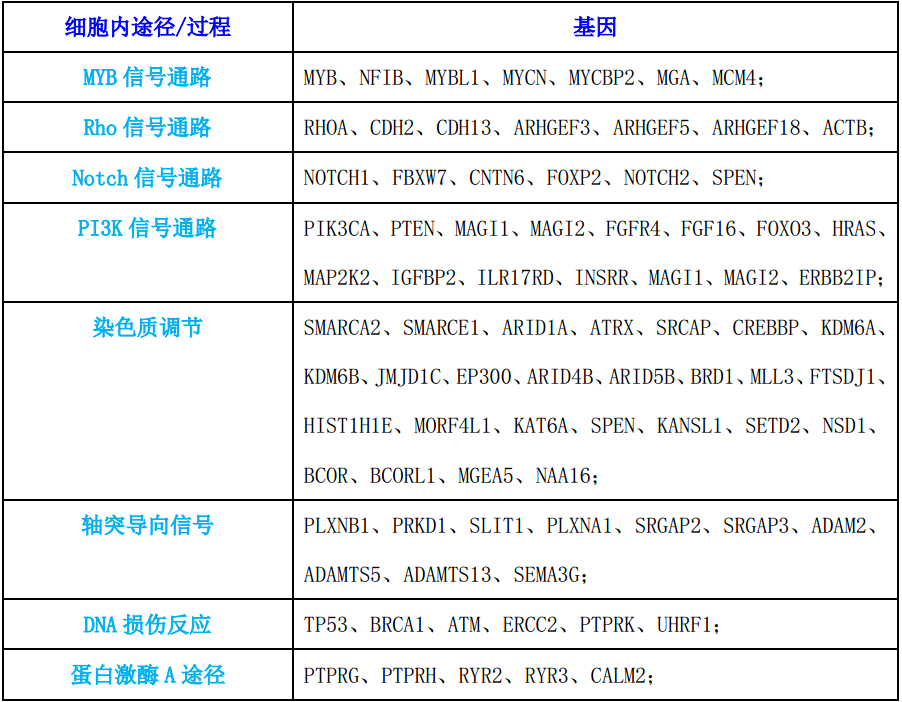
表3总结了与DNA损伤反应、Rho信号通路、Notch信号通路、PI3K信号通路、染色质调节和轴突导向信号有关基因的体细胞突变。
表3:腺样囊性癌中涉及多种细胞内途径/功能的突变基因
29%~86%的AdCC患者出现t(6;9)(q22-23;p23-24)染色体易位导致MYB和NFIB基因融合。MYB(c-MYB)基因位于染色体6q上,编码一个由3个结构域组成的转录因子:一个 N末端DNA结合结构域,一个位于中央的转录激活结构域和一个C末端负调控结构域。特别是,MYB调节造血、结肠和神经祖细胞的增殖和分化。MYB转录因子的靶点超过87个基因,包括增殖相关基因MYC、CCNA1、CCNB1、CCNE1、c-KIT;抗凋亡基因BCL-2、BCL-XL、HSPA5和热休克蛋白70;分化相关基因GATA3、CD4;促炎基因环氧合酶-2和金属蛋白酶1。染色体9p上的NFIB基因编码一种转录因子核因子I/B蛋白,它是造血和上皮细胞的关键调节因子。癌蛋白的融合通常导致截短的MYB蛋白通过负调节元件的丢失和对微小RNA调节位点的控制而过度表达,并激活MYB介导的影响DNA修复、凋亡、迁移、细胞信号和细胞周期控制的途径的转录。除了基因融合,MYB活性还可能通过其他机制增加,包括MYB拷贝数增加,MYB截短,或来自NFIB、RAD51B或TGFBR3基因的超癌序列并置。据报道,在9%~14%的AdCC患者中出现MYBL1-NFIB融合。染色体8q上的MYBL1基因(也称为A-MYB)是MYB家族的成员,其基因产物与MYB共享几乎相同的DNA结合结构域。在少数AdCC中存在MYB-PDCD1LG2、MYB-EFR3A、MYBL1-RAD51B、MYBL1-YTHDF3和NFIB-AIG1融合。
诊断性生物标志物
一般认为MYB/MYBL1重排对涎腺AdCC具有高度特异性。因此,MYB荧光原位杂交是区分腺样囊性癌和其他类型涎腺肿瘤的有价值的诊断生物标志物。在其他解剖部位,如肺、乳腺、鼻腔、气管等,它也是一种有用的辅助诊断检查。最常见的检测突变的方法之一是利用MYB基因的断裂探针进行荧光原位杂交。然而,在MYB/MYBL1改变的非典型模式中,FISH的帮助可能是有限的。逆转录聚合酶链反应可能是检测融合变异体的有用方法。MYB易位的过度表达也见于其他肿瘤,如T细胞急性淋巴细胞白血病中的MYB-TCRb融合,急性嗜碱性粒细胞白血病中的MYB-GATA1融合,和血管中心性胶质瘤中的MYB-QKI融合。在多达65%~85%的病例中观察到细胞核MYB表达增加。MYB-NFIB易位并不总是相关的;一般来说,MYB免疫表达在MYB-NFIB融合的AdCC患者中较高。这一发现可能表明,在缺乏MYB-NFIB融合的AdCC类型中,MYB过度表达可能涉及额外的机制。多种癌症中观察到免疫组织化学显示的MYB免疫表达,包括造血系统、乳腺、结肠、胰腺恶性肿瘤、黑色素瘤和胶质母细胞瘤,以及其他涎腺肿瘤,包括基底细胞腺瘤(BCA)、多形性腺癌(SDC)、涎腺导管癌(AciCC)、基底细胞腺癌(BCAC)、黏液表皮样癌(MEC)、上皮-肌上皮癌(EMC)、鳞状细胞癌和多形性腺瘤(PA)。
预后生物标志物
MYB-NFIB融合的预后重要性仍有争议,它似乎不能提供预后判断。通过Notch1的功能获得突变或SPEN的功能丧失异常激活NOTCH通路的突变似乎与高级别转化有关。
预测性生物标志物
AdCC中的MYB激活可能是AdCC的一个潜在治疗靶点。潜在的方法包括使用短干扰RNA介导的基因表达沉默,靶向MYB下游效应物,并阻断转录复合物中的蛋白质-蛋白质相互作用。此外,Notch信号通路抑制剂(包括γ-分泌酶抑制剂和Notch受体靶向抗体)和PI3K/IGF/FGFR1通路抑制剂是部分ACC的潜在治疗靶点。在几个病例报告中报告了对Notch信号通路抑制剂的部分反应。通过免疫组化Notch胞内结构域表达是检测NOTCH1突变的敏感工具。
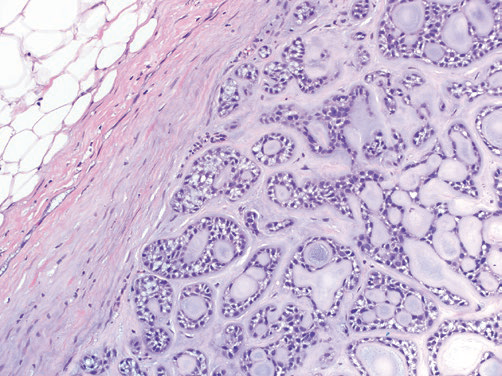
图1(H&E,20×)腺样囊性癌,肿瘤边界清楚
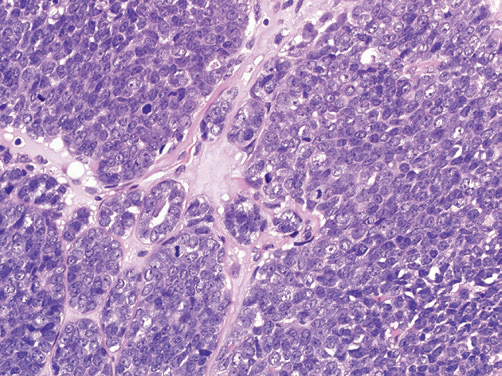
图2(H&E,40×)腺样囊性癌,实性生长模式
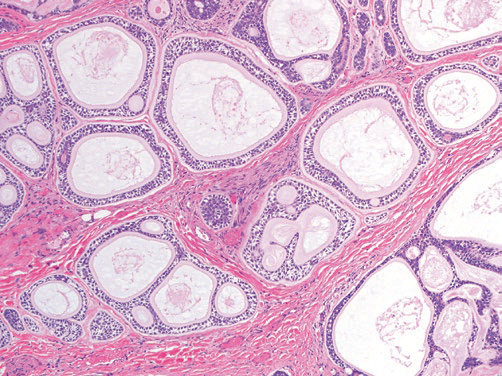
图3(H&E,10×)腺样囊性癌,管状生长模式
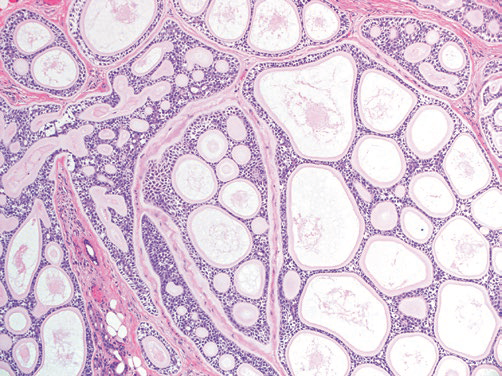
图4(H&E,10×)腺样囊性癌,筛状生长模式
未完待续
备注:图1-4来自书籍《Atlas of Salivary Gland Pathology》。


















共0条评论