[导读] 编译整理:强子
病理不讲理-皮肤上皮样非上皮性肿瘤概述(一)
病理不讲理-皮肤上皮样非上皮性肿瘤概述(二)
病理不讲理-皮肤上皮样非上皮性肿瘤概述(三)
病理不讲理-皮肤上皮样非上皮性肿瘤概述(五)
病理不讲理-皮肤上皮样非上皮性肿瘤概述(六)
伴黏液样或肌上皮分化的上皮样肿瘤
1.皮肤共质体型肌上皮瘤
皮肤共质体型肌上皮瘤(cutaneous syncytial myoepithelioma,CSM)表现为年轻人、中年人四肢真皮表浅部位的斑块或结节,男性稍多。临床一般较小,直径中位数小于1cm;生物学行为为良性,仅切除不完整时有罕见复发表现。
镜下肿瘤细胞为卵圆形、组织细胞样及梭形,呈片状分布;瘤细胞有中等量、弱嗜酸性胞质,细胞核形态均一。表现温和、空泡状,核仁不明显。细胞之间界限不清,呈合体样表现;具有数量不一的黏液样间质。部分病例中可见脂肪化生。常见淋巴细胞簇,一般位于结节周边。核分裂指数低,大部分情况下很难查见核分裂。
免疫组化方面,大部分病例共表达EMA及S100,少数情况下可出现GFAP、SMA、p63的阳性。重要的是,该肿瘤不表达ALK,可以将其与上皮样纤维组织细胞瘤鉴别开来,而这两者临床特征具有显著重叠。
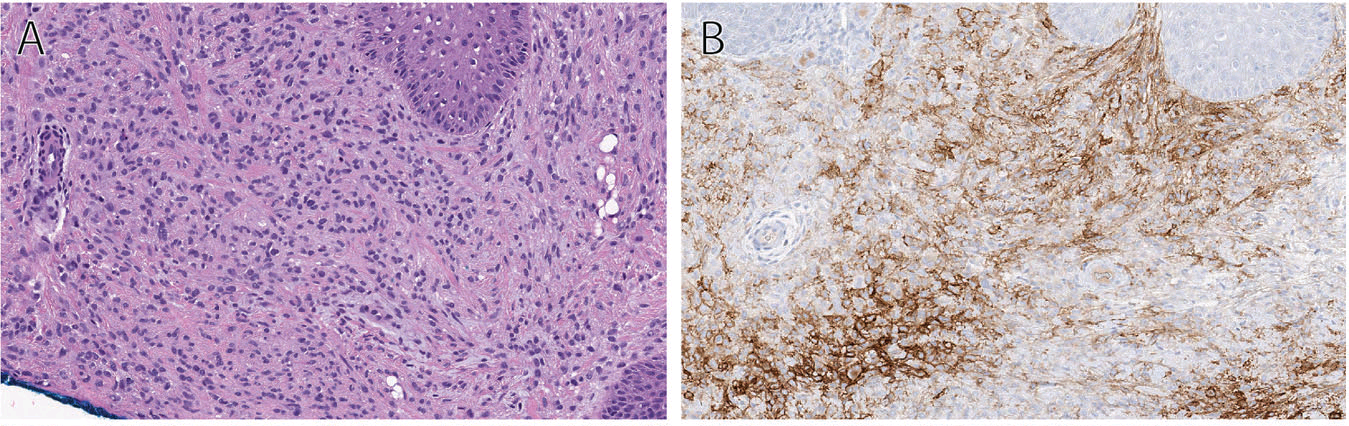
图1. 皮肤共质体型肌上皮瘤;细胞为形态均一的组织细胞样细胞,胞质中等量、弱嗜酸性,细胞核形态温和,细胞之间界限不清,整体呈片状排列;左图中偏右侧可见脂肪化生。大部分病例中,免疫组化EMA阳性(右图)。
皮肤共质体型肌上皮瘤相比皮肤的软组织肌上皮瘤来说形态更为单一、且CK阳性少见,但遗传学方面二者也有重叠:高达45%的软组织肌上皮瘤会有EWSR1重排,皮肤共质体型肌上皮瘤中,约80%具有EWSR1基因重排。这一点与软骨样汗管瘤(也称为伴导管分化、富于肌上皮的皮肤黏液瘤)不同。大部分皮肤黏液瘤会有PLAG1基因的改变。
2.混合瘤及肌上皮瘤
皮肤混合瘤(软骨样汗管瘤)及肌上皮瘤均有肌上皮分化特征和相同的间质特征,同时临床特征也有诸多共同点;但皮肤混合瘤的定义是至少局灶有导管分化,且其遗传学改变与涎腺混合瘤类似。
临床上,皮肤混合瘤表现为皮肤及皮下小而无痛的结节或斑块,多见于头颈部或四肢;皮肤肌上皮的临床表现与此类似,部位也近似,但肢带处发生率更高。这两种肿瘤临床生物学行为均为惰性,约20%的病例有复发,一般是切除不完整所致。
形态学上,皮肤混合瘤一般表现为真皮内的界清、无包膜结节,而皮肤肌上皮瘤更多见为多结节、并侵入皮下组织。二者细胞均为上皮样、浆细胞样、梭形,排列方式多样;背景为黏液样、软骨样、玻璃样变的间质。也曾有主要表现为横纹肌样形态、或透明细胞改变的报道。胞质嗜双色性或嗜酸性,细胞核形态温和、卵圆形,染色质细腻,核仁小或不明显。具体排列方式为条索状、网状、巢状、片状等混杂,大部分病例会表现为多种方式共存、某种方式为主。少部分病例中可见局灶骨化生、软骨化生、脂肪化生。皮肤混合瘤中有导管分化,可以和肌上皮瘤鉴别开来。恶性混合瘤极为罕见,该肿瘤以及恶性肌上皮瘤(即肌上皮癌)的诊断主要在于细胞学的显著异型性。良性肌上皮瘤中也可以出现核分裂、坏死,但一般并不显著,且无非典型核分裂。
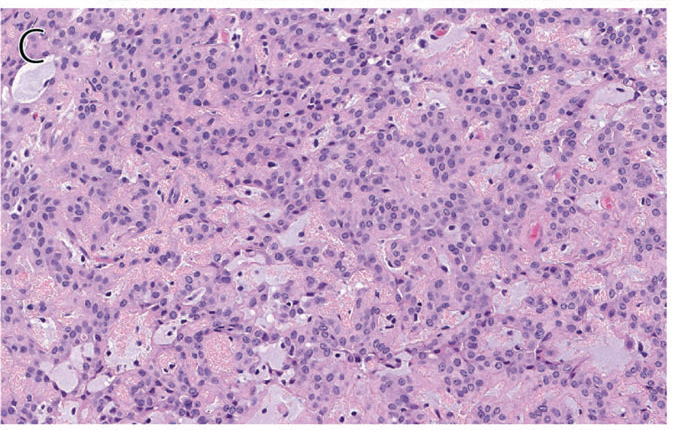
图2. 皮肤肌上皮瘤,细胞为上皮样、浆细胞样、梭形,排列呈条索状、巢状、网状,背景为黏液样或软骨黏液样间质。
免疫组化方面,约90%的病例会同时表达S100、CK或EMA。混合瘤及肌上皮瘤中常见SOX10阳性(约80%),但肌上皮癌中仅极少数阳性。其他肌上皮分化标记物如p63、GFAP、SMA、calponin等也常见阳性,但阳性率较低。
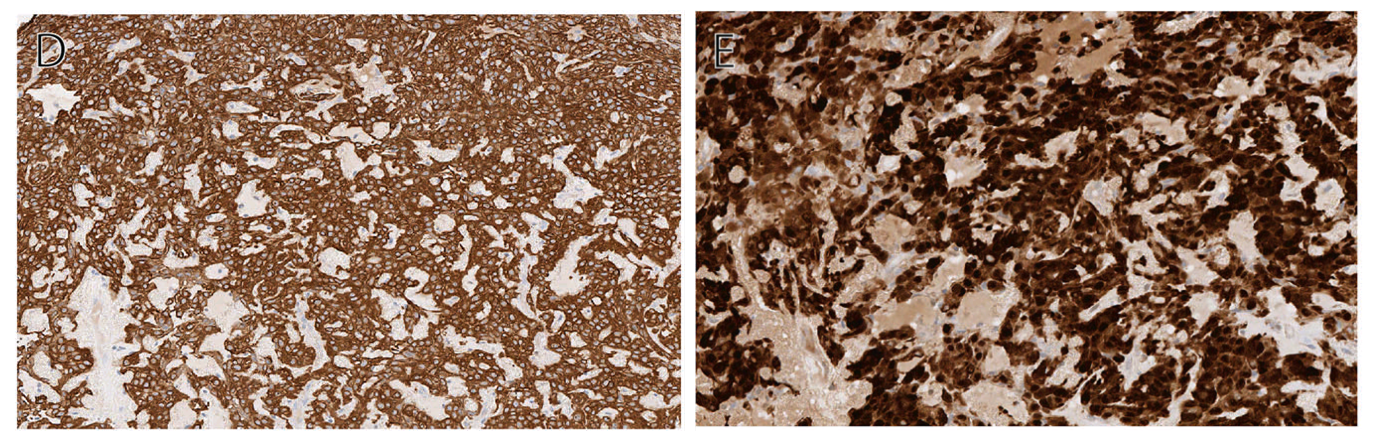
图3. 皮肤肌上皮瘤共表达AE1/AE3(左图)、S100。
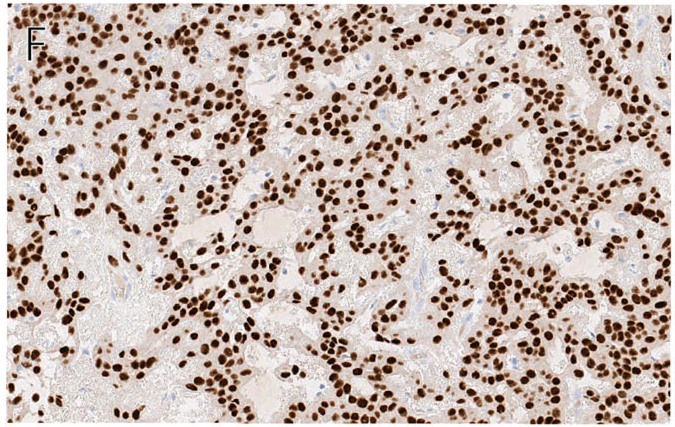
图4. 皮肤肌上皮瘤,常见SOX10阳性。
尽管皮肤混合瘤和肌上皮瘤由于形态学均具有肌上皮分化,因此有时候常视为一组病变,但最近分子遗传学研究的进展表明二者有所不同。混合瘤常见染色体8q12处PLAG1基因重排,这一点与涎腺多形性腺瘤相同;也可以通过免疫组化检测PLAG1表达(细胞核阳性)。富于肌上皮的肿瘤中出现PLAG1基因改变、或免疫组化阳性表达,与出现导管分化高度相关。此外,PLAG1重排似乎与EWSR1重排是互斥的;后者可见于小部分皮肤肌上皮瘤,其检出率低于皮肤共质体型肌上皮瘤。EWSR1重排肌上皮瘤中,对应重排可有FOU5F1、ZNF444、ATF1,皮肤共质体型肌上皮瘤中常见的EWSR1-PBX3重排并不常见。
3.肌上皮癌
皮肤肌上皮癌在形态学、临床病程方面与肌上皮瘤有诸多相似之处。该肿瘤发生于四肢、肢带处、头颈部。生物学行为相比发生于深部软组织的肌上皮癌来说,侵袭性要弱,但复发率和转移率约在40%左右。
肌上皮癌形态学上类似肌上皮瘤,比如细胞主要表现为上皮样或浆细胞样,排列呈片状、巢状、条索状、网状;其不同点在于有显著细胞学异型性,具体如细胞核大而不规则、染色质粗糙、空泡状,核仁显著。细胞核中的异型性特征,与侵袭性生物学行为密切相关,也正是基于这些特征来鉴别良性肌上皮肿瘤。相比肌上皮瘤来说,肌上皮癌中更多见显著坏死、核分裂易见且有非典型核分裂、边界呈浸润性,但这些表现并无独立的预后不良意义,只是出现这些特征则支持恶性诊断。

图5. 肌上皮癌;形态学与肌上皮瘤相似,但具有细胞核的异型性,具体如染色质空泡状、显著核仁、显著核分裂且有非典型核分裂、显著坏死。
与肌上皮瘤一样,肌上皮癌也几乎全部会表达AE1/AE3、CAM5.2、S100,;SMA、calponin、GFAP阳性率不一;仅30%左右的肌上皮癌会表达SOX10,显著低于肌上皮瘤中的阳性率。肌上皮癌相比肌上皮瘤来说,EWSR1重排比例更高,约为50%左右。需要注意的是,少部分肌上皮癌中免疫组化可见INI1表达缺失,且这一现象在具有横纹肌形态的儿童病例中更为常见。
除肌上皮瘤外,肌上皮癌还应注意鉴别上皮样肉瘤、上皮样恶性外周神经鞘瘤。上皮样肉瘤免疫组化并不表达S100,而上皮样恶性外周神经鞘瘤则不表达CK。这种情况下的鉴别诊断中,INI1表达缺失并无帮助。
4.皮肤血管周上皮样细胞肿瘤
皮肤血管周上皮样细胞肿瘤(perivascular epithelioid cell tumor,PEComa)最常见于深部软组织,但罕见情况下也可局限于真皮、仅伴局灶的皮下受累。主要发生于皮肤的PEComa一般表现为中年人四肢的单发肉色结节或斑块。迄今为止,报道的病例生物学行为均为良性。不过,得出这些结果的数据有限,因此目前对于主要发生于皮肤的PEComa仍建议完整切除。
皮肤PEComa一般界限欠清,组织学为大的上皮样细胞,胞质透明或弱嗜酸性,呈片状、条索状、巢状排列,周围可有胶原束,并有分枝状毛细血管。细胞核一般形态温和,染色质空泡状,有小核仁。
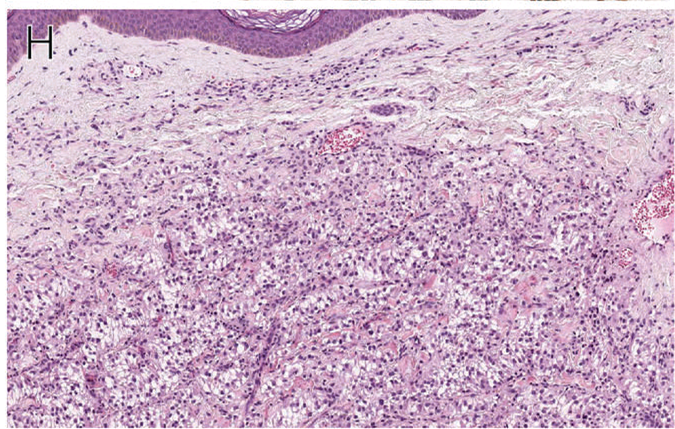
图6. 皮肤PEComa;细胞为较大的上皮样,胞质透明或弱嗜酸性,呈巢状、条索状、片状排列,并有分枝状毛细血管。
免疫组化方面,PEComa表达黑色素相关标记如Melan-A、HMB45、MiTF、NKI/C3,同时表达平滑肌标记如SMA、calponin、desmin。S100一般阴性,可借此与胞质透明的黑色素相关病变鉴别。皮肤PEComa的这些免疫组化标记中,HMB45、MiTF、NKI/C3最为敏感,阳性率均大于90%。
深部软组织PEComa常与mTOR通路中的TSC1/2基因改变、结节性硬化有关,但皮肤的PEComa并无该基因的异常。皮肤PEComa免疫组化中也并不表达TFE3,荧光原位杂交中并无TFE3基因改变。此外,该肿瘤也并无黑色素病变相关的基因改变,如BRAF、GNAS、NRAS、KIT。目前有研究认为该肿瘤也有mTOR通路的相关异常,但具体细节仍有待进一步研究。
皮肤PEComa的鉴别诊断范围较广,具体如同时有平滑肌分化和黑色素分化的肿瘤。呈透明细胞表现的皮肤肌上皮肿瘤可表达EMA、CK;这些标记的阳性也可以鉴别具有透明细胞表现的癌转移至皮肤,如转移性肾细胞癌、转移性肝细胞癌。因此,在做出皮肤PEComa诊断之前,应注意多做几项角蛋白标记。具有透明细胞形态的黑色素病变并不表达平滑肌标记、而S100弥漫阳性。需要注意的是,皮肤颗粒细胞瘤也可表达S100,但并不表达黑色素相关标记。
点击下载英文文献
参考文献
Carter CS, Patel RM.Cutaneous soft tissue tumors: diagnostically disorienting epithelioid tumors that are not epithelial, and other perplexing mesenchymal lesions[J].Modern pathology,2019.
DOI:10.1038/s41379-019-0387-5



















共0条评论