[导读] 编译整理:强子
软组织病理诊断新进展(一)
软组织病理诊断新进展(三)
软组织病理诊断新进展(四)
三.上皮样脉管肿瘤的分子分类
自2001年在上皮样血管内皮瘤中发现有分子遗传学改变后,相关研究进展迅速,将脉管肿瘤引入了分子分类的时代。后续在上皮样脉管肿瘤中发现了更多遗传学改变,很多已转化为诊断标志物。
1.上皮样血管内皮瘤
上皮样血管内皮瘤被认为是低级别恶性肿瘤,容易发生于四肢及躯干部的软组织,常与大血管有关,但也可发生于肺、肝、骨,且发生于这些部位时常为多灶。局部复发几率15%,(软组织处肿瘤)转移几率30%,死亡率在软组织肿瘤为15%,而发生于肝和肺者可达50%。
组织学上,上皮样内皮细胞胞质淡染嗜酸性至透明样,胞质内可见空泡,细胞呈条索样排列,常位于透明黏液样(myxohyaline)或胶原样间质中。免疫组化上皮样血管内皮瘤表达CD31、ERG,同时表达CK(约25%的病例)。
2011年有两个研究小组发现约90%的上皮样血管内皮瘤具有t(1;3)(p36.3;q25),因此导致WWTR1-CAMTA1融合。后续对肝脏多发上皮样血管内皮瘤的研究也证实,肿瘤内有相同的WWTR1-CAMTA1融合转录,这也证实为肝内转移性病变、而非此前所推测的多原发病变。WWTR1-CAMTA1融合导致免疫组化中CAMTA1过表达,且最近已证实CAMTA1免疫组化是上皮样血管内皮瘤与其他上皮样脉管肿瘤鉴别的高度敏感标记物。
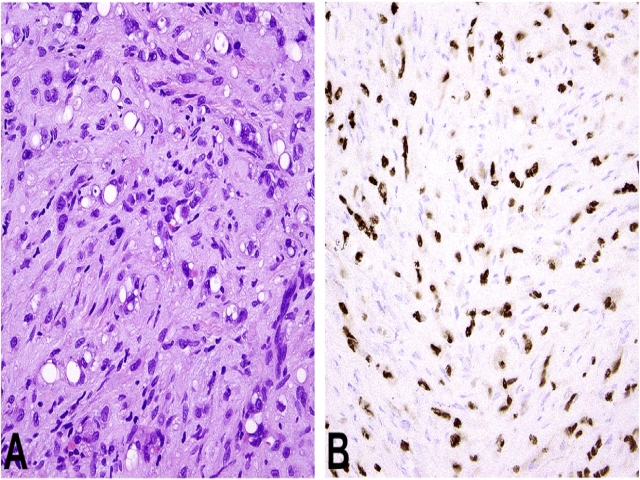
图4. 上皮样血管内皮瘤,组织学为特征性空泡状的上皮样内皮细胞,呈条索样排列,间质为透明黏液样;免疫组化表达CAMTA1,提示存在WWTR1-CAMTA1融合。
约5%的上皮样血管内皮瘤具有另一种遗传学异常t(X;11)(p11;q22),因此导致YAP1-TFE3融合。该组肿瘤具有独特形态学特征,如局灶有发育良好的脉管、肿瘤细胞具有显著的、丰富的嗜酸性胞质。该组肿瘤免疫组化不表达CAMTA1,但表达TFE3,未来可能会对这部分肿瘤单独区分出来。
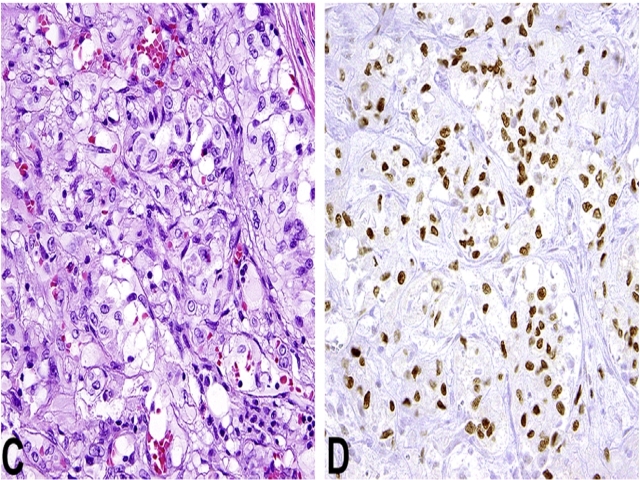
图5. 上皮样血管内皮瘤,该例可见显著血管形成,瘤细胞胞质呈空泡状,但免疫组化表达TFE3,提示存在YAP1-TFE3融合。
2.上皮样血管瘤
该组肿瘤为良性,常发生于中年成人头颈部、躯干、四肢及深部软组织,临床表现为境界清楚、分叶状肿物,常与血管相关。组织学上可见伴靴钉样表现的上皮样内皮细胞,且上皮样血管瘤常表现出特征性的分带现象,即外周为发育完善的血管、中央则为显著受压的血管。细胞核异型性无或轻度,一般无多形性,核分裂一般数量不多。上皮样血管瘤约20%表现为多灶。该肿瘤尽管不发生转移,但约30%会有局部复发。
近些年已发现上皮样血管瘤有几种特殊形态亚型。此前被称之为血管淋巴组织增生伴嗜酸性粒细胞增多(angiolymphoid hyperplasia with eosinophilia)的病变也是上皮样血管瘤的一部分,其特点为好发于年轻成人的头颈部,组织学伴有显著的淋巴细胞、嗜酸性粒细胞构成的混合性炎症。最近还描述了一种“细胞性”上皮样血管瘤,主要发生于骨、阴茎,约25%的病例为多灶性,影像学上常表现出令人担心的特征。该组肿瘤血管形成相对较少,反而表现为显著富于细胞、或片状生长。约20%的“细胞性”上皮样血管瘤可见t(19;19)(q13.2;q13.2)或内部del 19(q13.2-3),导致ZFP36-FOSB基因融合;或出现另一种异常即t(3;19)(q25;q12),导致WWTR1-FOSB融合。需要注意的是,FOSB重排并非上皮样血管瘤所特有,还可见于假肌源性血管内皮瘤。此外,2015年首次发现骨与软组织发生的上皮样血管瘤(包括经典型及细胞型)约20%为t(1;14)(q22;q24)、t(10;14)(p13;q24)、或t(3;14)(q25;q24)导致FOS基因重排而致病。与前述肝脏多发上皮样血管内皮瘤一样,也有一例骨多发上皮样血管瘤具有相同融合转录的报道,证实其为局部的转移的推测。
3.假肌源性血管内皮瘤
该肿瘤常发生于年轻至中年男性,特征性表现为某一解剖部位、同时累及多个组织层面(如皮肤、皮下组织、筋膜、骨骼肌、骨)的多发性肿瘤。该肿瘤转移潜能较低,但可局部、多次复发。组织学上为胖梭形、上皮样细胞呈疏松、浸润性筋膜炎样,瘤细胞胞质嗜酸性,常有横纹肌母细胞样形态,一般伴中性粒细胞浸润。
免疫组化方面,假肌源性血管内皮瘤既表达内皮标记(如CD31、ERG)又表达CK,且具有t(7;19)(q22;q13)、导致SERPINE-FOSB1融合,这是一个可用于诊断、并高度敏感的指标。不过需要指出的是,约5%的上皮样血管瘤(包括前述血管淋巴组织增生伴嗜酸性粒细胞增多亚型)可见FOSB阳性。
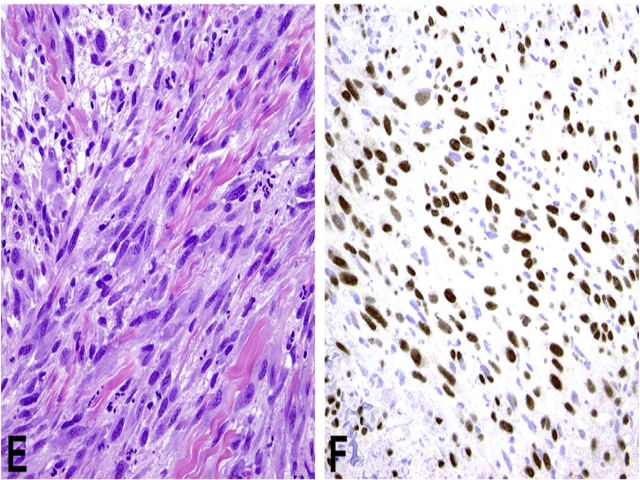
图6. 假肌源性血管内皮瘤,瘤细胞呈特征性的拉长、横纹肌母细胞样,且免疫组化表达FOSB。
关于假肌源性血管内皮瘤详细信息,可参阅本网站此前编译文章。
http://news.ipathology.cn/article/3476.html
四.脂肪性肿瘤新进展
关于脂肪性肿瘤,梭形细胞型/多形性脂肪瘤好发于中年男性肩部、上背部、颈部,组织学上为形态温和的梭形细胞、混有数量不等的成熟脂肪细胞,多形性脂肪瘤时则有形态怪异、深染至多核的细胞。瘤细胞的胞核呈短粗样,细胞分界清晰,周围为纤维黏液样间质并伴显著绳索样胶原束,可见脂肪母细胞。与乳腺型成肌纤维瘤、细胞性血管纤维瘤一样,梭形细胞型/多形性脂肪瘤属于13q14导致RB1缺失肿瘤家族,免疫组化中有RB1的缺失。
相反,去分化脂肪肉瘤一般发生于中、老年,最多见于腹膜后深部软组织、精索、四肢或纵膈、头颈部,可发生于高分化脂肪肉瘤/非典型脂肪瘤样肿瘤背景中。病理性细胞遗传学改变有巨大或环状染色体,其中涉及12q13-15区域的扩增,而这些区域包括了MDM2、CDK4、HMGA2位点。这些结构异常导致MDM2和CDK4及HMGA2的扩增,可通过免疫组化检测出来。
一般可根据形态学并加做MDM2、CDK4、RB1免疫组化或FISH检测来鉴别梭形细胞型/多形性脂肪瘤和非典型脂肪瘤样肿瘤/高分化脂肪肉瘤。
1.非典型梭形细胞脂肪瘤样肿瘤
随着研究的深入,逐渐发现有些具有梭形细胞形态的非典型脂肪源性肿瘤并不能很好的符合现有诊断方案。这部分肿瘤的特征有:呈非典型梭形细胞表现,脂肪成分数量不等,有局部复发风险,但无去分化或远处转移。
这组低级别肿瘤被称为非典型梭形细胞脂肪瘤样肿瘤(atypical spindle cell lipomatous tumour),主要发生于中年人,尤其好发于四肢、肢带(limb girdle)、手足等处。组织学上该肿瘤边缘不清,由非典型梭形细胞构成,间质为纤维性或黏液样,伴显著程度不等的脂肪成分,且脂肪细胞大小不一,局灶可有细胞核异型性,常伴脂肪母细胞。
与梭形细胞型/多形性脂肪瘤一样,非典型梭形细胞脂肪瘤样肿瘤也表达CD34而RB1缺失(约见于60%的病例),不表达MDM2和CDK4。不过,约10%的病例会免疫组化局灶表达MDM2或CDK4,而FISH检测并无MDM2的高水平扩增。也可出现S-100(约40%的病例)及desmin(约20%的病例)阳性。
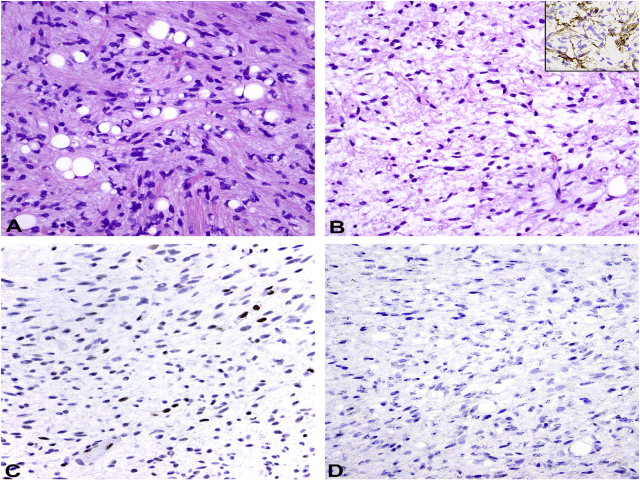
图7. 非典型梭形细胞脂肪瘤样肿瘤,(A)瘤细胞呈梭形,细胞核轻度非典型,背景为胶原性间质,混有脂肪母细胞;(B)其他区域瘤细胞的细胞核粗短,背景间质黏液样更加显著,免疫组化表达CD34(插图所示),但不RB1表达缺失(C),其中的小血管及炎症细胞可作为内对照。免疫组化MDM2阴性(D)。
该组肿瘤生物学行为大部分为惰性,13%可见局部复发,但无远处转移或死于该病的报道。这也更体现了需将其和其他非典型脂肪瘤样肿瘤鉴别开来的意义,主要在于避免激进的手术治疗:非典型梭形细胞脂肪瘤样肿瘤患者如完整切除,预后极好。
点击下载英文文献
参考文献
Schaefer IM, Fletcher C.D.M. Recent advances in the diagnosis of soft tissue tumours[J].Pathology,2018,50(1):37-48.
DOI:10.1016/j.pathol.2017.07.007

















共0条评论