[导读] 编译整理:强子
软组织肿瘤小活检标本中的免疫组化及分子检测应用(一)
软组织肿瘤小活检标本中的免疫组化及分子检测应用(二)
软组织肿瘤小活检标本中的免疫组化及分子检测应用(四)
软组织肿瘤小活检标本中的免疫组化及分子检测应用(五)
三. 软组织上皮样肿瘤
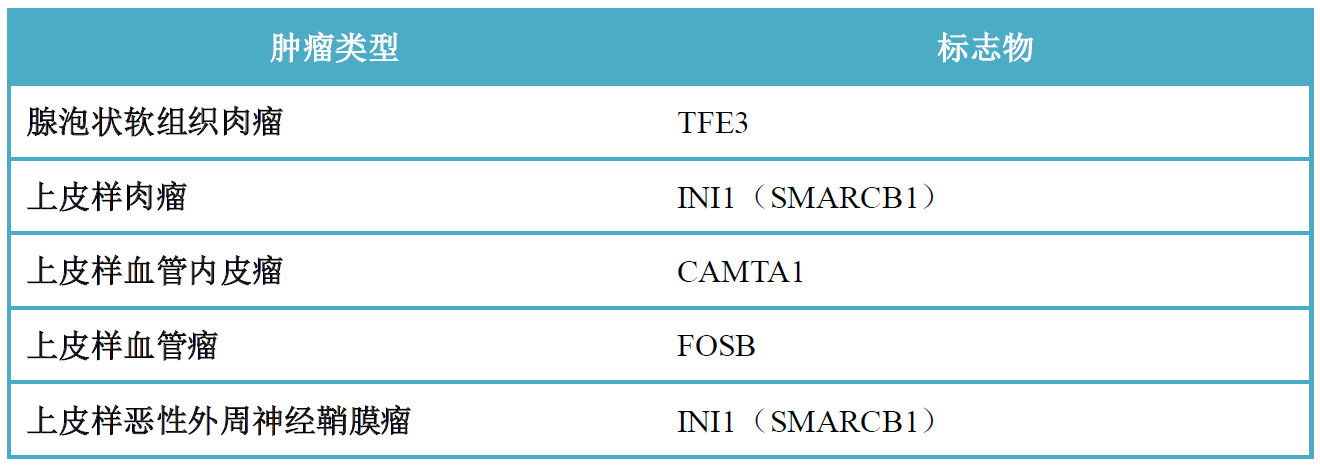
软组织肿瘤中,有很多会出现上皮样的细胞学形态。毋庸置疑,这种情况下诊断软组织肿瘤之前,必须先排除更为常见的转移性癌、转移性恶性黑色素瘤。综合分析结构、细胞学特点,并结合间质特点、解剖学部位,可有助于缩小鉴别诊断范围。近些年对这类肿瘤也发现了部分特异性分子遗传学改变,且有些可以通过免疫组化的方法来进行检测,详见表4。本文重点讨论上皮样血管内皮瘤(epithelioid hemangioendothelioma)。
表4. 软组织上皮样肿瘤中部分免疫组化指标
上皮样血管内皮瘤
上皮样血管内皮瘤最初被视为生物学行为中间类型的间叶性肿瘤,但目前被归为肉瘤;不过,相比血管肉瘤来说,它的侵袭性稍差。尽管该肿瘤具有内皮分化,但却并不会形成真正的血管腔,这也增加了其诊断难度。
上皮样血管内皮瘤顾名思义为血管内皮细胞构成,细胞形态方面一般细胞核形态温和,胞质嗜酸性,偶见胞质内空泡。瘤细胞呈条索状或巢状,间质显著黏液样变或玻璃样变。该肿瘤不仅可发生于软组织,还可发生于肝脏、肺、骨等,发生于这些部位时常见为多中心性。上皮样血管内皮瘤免疫组化常见CK阳性,这一特点、加之组织学表现、以及临床为多灶性时,很容易误诊为转移癌,尤其是误诊为乳腺小叶癌、胃低黏附性癌(包括印戒细胞癌)。
临床实践中,只要考虑到上皮样血管内皮瘤可能,通过血管标记相关免疫组化指标如CD31、ERG等证实有血管内皮分化,一般已足以明确诊断。不过,有20%左右的病例细胞核异型性程度会相对显著,且常伴核分裂增加、有时还会出现片状结构;这种情况下和上皮样血管肉瘤的鉴别可能很困难,尤其活检小标本时,由于典型组织学表现可能不足,诊断更是困难。但这一鉴别却具有显著临床意义:后者更具侵袭性,且对化疗更敏感。
2001年,有人报道两例上皮样血管内皮瘤具有t(1;3)(p36.3;q25)易位。2011年,又有两个独立小组发现了由于该易位导致的特异性基因重排WWTR1-CAMTA1。约85%至90%的上皮样血管内皮瘤中可见这一基因融合,免疫组化CAMTA1可作为这一遗传学异常的替代指标:具有WWTR1-CAMTA1重排的上皮样血管内皮瘤表现为CAMTA1细胞核阳性,而和上皮样血管内皮瘤形态学类似的上皮样血管肉瘤、癌、其他上皮样间质肿瘤(如上皮样肉瘤)均为阴性。这一标志物在肝脏粗针穿刺活检标本的鉴别诊断中尤其有用:上皮样血管内皮瘤的瘤细胞在肝细胞之间浸润性生长时,很难识别出来。
具体实例

图3. 肝脏上皮样血管内皮瘤。该例为60岁女性、肝脏多发结节,粗针穿刺活检标本。肝实质细胞形态与正常肝细胞几乎一样,高倍观察可见散在部分深染、异型细胞,个别多核细胞;肝窦内尤其明显。免疫组化CAMTA1检测,肝窦内异型细胞可见细胞核阳性。
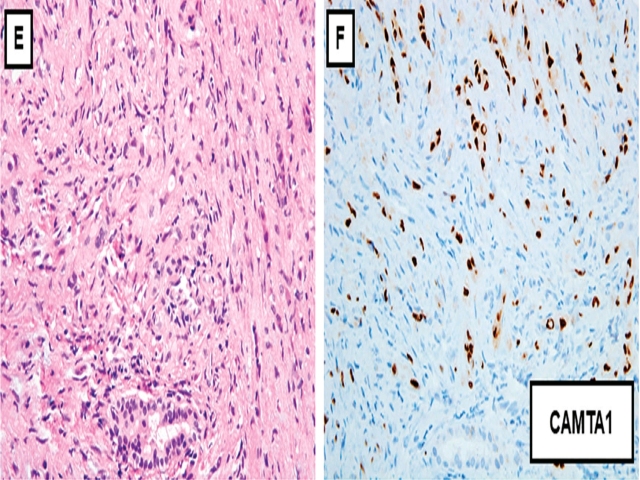
图4. 肝脏上皮样血管内皮瘤,图3中病例的另一个区域,细胞学及结构的异型性更为显著,瘤细胞呈条索状,偶见胞质内空泡;背景为胶原性间质。免疫组化CAMTA1检测瘤细胞的细胞核阳性,且条索样结构更加明显。
点击下载英文文献
参考文献
Limited biopsies of soft tissue tumors: the contemporary role of immunohistochemistry and molecular diagnostics[J].Modern pathology,2019.
DOI:10.1038/s41379-018-0139-y
















共0条评论