[导读] 编译整理:强子
软组织肿瘤小活检标本中的免疫组化及分子检测应用(二)
软组织肿瘤小活检标本中的免疫组化及分子检测应用(三)
软组织肿瘤小活检标本中的免疫组化及分子检测应用(四)
软组织肿瘤小活检标本中的免疫组化及分子检测应用(五)
现有软组织肿瘤超过一百种,其中包括了80余种良性及中间型肿瘤和40余种肉瘤。准确诊断取决于组织形态学、细胞学特征的识别。不过,不同软组织肿瘤之间存在显著形态学重叠,因此有时极具挑战性;加之越来越多的标本为小活检组织,更是增加了准确诊断的难度。这种情况下,结合免疫组化和分子检测的鉴别诊断意义重大。近些年,软组织肿瘤的免疫组化指标已有了很多进展,分子检测指标更是层出不穷。近日,哈佛大学附属布列根和妇女医院(Brigham and Women’s Hospital)软组织病理专家Hornick在美加病理学会(United States and Canadian Academy of Pathology)官方期刊《Modern Pathology》就小活检标本中结合免疫组化和分子检测诊断软组织肿瘤问题,针对某些具体肿瘤类型进行了详细讲解。为帮助大家更好的了解相关进展,并用于指导实践,我们将该文中要点编译介绍如下。
一.软组织肿瘤及相关检测概述
软组织肿瘤并不多见,约占所有恶性肿瘤的1%;但其种类繁多,如前所述,具体包括了80余种良性及中间型肿瘤和40余种肉瘤。也正是由于软组织肿瘤少见、但种类繁多,加之目前遇到的活检或小标本越来越多,因此其诊断难度越来越大。
面对类似情况,当然可以加做免疫组化、分子检测等帮助我们做出最终诊断。但作为病理医师都深知:考虑的方向一旦出现错误,有时候辅助检查反而会使得诊断更加复杂化。从实际来说,标本有限的情况下,可以先尽量从临床实际出发、解决最重要的问题。比如首先确定该肿瘤的良恶性,因为这对于手术方案的制定(局部切除、还是扩大切除)、以及是否需采取新辅助治疗来说极为关键。其次,明确为恶性肿瘤的情况下应尽量确定组织学分级;大部分情况下,对于中间级别和高级别肉瘤来说还是会采取新辅助放疗。最后,对于某些特殊类型肿瘤来说,还是要尽量做出最明确的分类诊断;如某些肿瘤的手术范围是有特殊要求的(黏液纤维肉瘤及上皮样肉瘤对切缘范围要求较高),某些肿瘤的化疗方案有自己的特殊性(如Ewing肉瘤、滑膜肉瘤、某些横纹肌肉瘤等)。
实际工作中,并非所有病例均可完美的解决上述三个问题,尤其是小活检标本。此时结合影像学等其他检查结果,对于诊断也是极有帮助的,如影像学查见坏死,则即使该肿瘤活检分级仅为1级,后续分级也极大可能会上调。
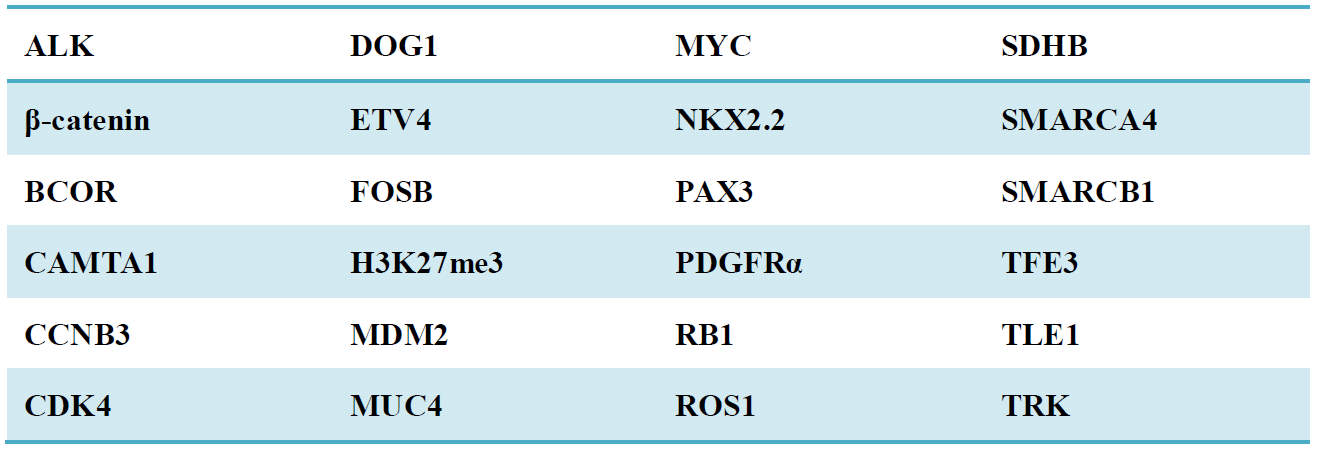
传统的免疫组化指标主要作用在于确定肿瘤细胞的分化谱系,这对软组织肿瘤的诊断很有意义;不过,很多病例仅确定分化谱系并不足以做出明确诊断。近些年已有多种基于遗传学改变的新型、特异免疫组化指标,具体见表1。
表1. 基于分子遗传学改变、或基因表达谱的软组织肿瘤新型免疫组化指标
除免疫组化检测外,包括荧光原位杂交(fluorescence in situ hybridization,FISH)、逆转录多聚酶链反应(reverse transcriptase-polymerase chain reaction,RT-PCR)、二代测序、新型的多基因融合分析等技术,在粗针穿刺、细胞块、细胞涂片等标本中已得到了部分应用;尤其FISH检测,在软组织肿瘤的分类中应用最为广泛。
表2. 软组织肉瘤诊断中常用的FISH检测探针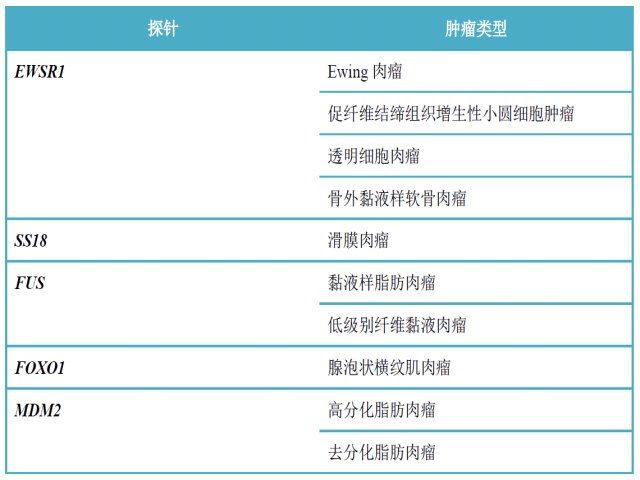
需要指出的是,同一分子遗传学改变常见于多种肿瘤,因此其敏感性还有欠缺,需结合临床、组织学及免疫组化结果综合分析。如EWSR1基因最初仅描述于Ewing肉瘤,但目前发现它与多种肿瘤的基因重排有关,且不仅限于肉瘤,也涉及某些良性及中间型软组织肿瘤。不过,大部分情况下FISH检测确定有EWSR1重排已足以做出鉴别诊断。
点击下载英文文献
参考文献
Limited biopsies of soft tissue tumors: the contemporary role of immunohistochemistry and molecular diagnostics[J].Modern pathology,2019.
DOI:10.1038/s41379-018-0139-y















共0条评论