编译整理:强子
一文掌握乳腺大汗腺型病变(一)
一文掌握乳腺大汗腺型病变(三)
非典型大汗腺型增生
非典型大汗腺型增生是指导管内或终末导管小叶单位出现满足前述细胞学异型性标准的大汗腺型上皮增生、和/或出现比乳头状大汗腺型增生复杂程度高的结构表现(如微乳头、罗马桥形成、尚不足以考虑为导管原位癌的筛状结构)。Tavassoli及Norris曾提出非典型大汗腺型增生有两种模式:一种是具有前述细胞学特征的改变(细胞核大小差异超过3倍,一般伴显著核仁)且核呈复层;另一种是具有相关结构改变(如罗马桥形成、筛状结构)但细胞核仅为轻度多形性。非典型大汗腺型增生与非高级别的大汗腺型导管原位癌形态学类似,可能很难区别;一般非典型大汗腺型增生不会出现坏死、异常核分裂、导管周围的炎症或纤维化。
大汗腺型导管原位癌是经典型导管原位癌亚型之一,但部分研究者认为它具有形态学及免疫组化上的特殊之处,如AR阳性、ER阴性、PR阴性。目前对于大汗腺型导管原位癌尚无一致性诊断标准,接受度最广的是肿瘤性大汗腺型细胞充满导管;细胞核可呈现低、中、高级别不等,可出现实性、筛状、微乳头状等结构模式。
高级别大汗腺型导管原位癌一般容易识别,其细胞核多形性显著,可见异常核分裂、管腔内坏死、管周可见显著炎症细胞及纤维化。非高级别的大汗腺型导管原位癌形态学改变则并不这么显著,但也可出现导管周围炎症及纤维化,且这一特征支持导管原位癌的诊断;可以没有核分裂及坏死,这两点也并非诊断所必需。导管原位癌的结构特征如形态僵硬的微乳头状结构、实性生长、筛状结构等有助于非高级别大汗腺型导管原位癌的诊断,但不要将其误判为伴复杂乳头的旺炽性大汗腺化生。
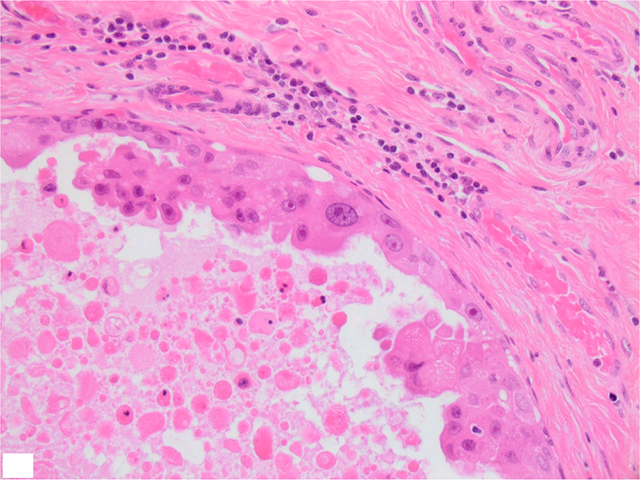
图3. 高级别导管原位癌,细胞核具有显著非典型,管腔内可见坏死,管周可见纤维化。
也有研究提出病变范围可作为大汗腺型导管原位癌的辅助诊断指标,但并非所有的专家均支持这一观点,他们认为病变性质才是最关键的。本文作者支持Tavassoli等提出的病变范围>2mm标准。
大汗腺型导管原位癌由于形态学并不一致,因此对其进行组织学分级难度较大,但却具有一定生物学意义。有研究根据细胞核大小(与周围无非典型的大汗腺型细胞相比,1-2倍为小,3-4倍为中等,5倍及以上为大)、多形性、核仁特点而将细胞核分为1、2、3级,再结合有无坏死而将大汗腺型导管原位癌分为低、中、高三个级别。其中细胞核级别的判定是根据核多形性最显著的区域而定。低级别是指细胞核1级或2级、无坏死,高级别是指细胞核为3级(体积大、多个核仁、染色质粗糙)且有广泛坏死,中级别则是指细胞核为1级或2级但有坏死、或细胞核为3级但无坏死。这一分级方案与Ki-67增殖指数、HER2表达情况、有无伴随浸润性癌均有相关性。
非典型大汗腺型病变与非高级别大汗腺型导管原位癌的鉴别
前述大汗腺型导管原位癌的诊断标准并未得到公认,加之这类病变并不多见,因此非典型大汗腺型病变与非高级别大汗腺型导管原位癌的鉴别尤其困难。本文作者结合文献及自己经验,提出具备下列特征时应考虑为非高级别的大汗腺型导管原位癌:大汗腺型细胞相互之间胞核差异大于3倍,核仁显著、不规则或多个,可见凋亡及导管周围改变(炎症及纤维化),这类细胞充满导管内,且病变范围>2mm。如细胞核无显著多形性,但有导管原位癌中充分的筛状、实性或微乳头状结构,且病变范围>2mm,也可诊断为非高级别的大汗腺型导管原位癌。坏死及核分裂并不一定存在,且并非诊断所必需。
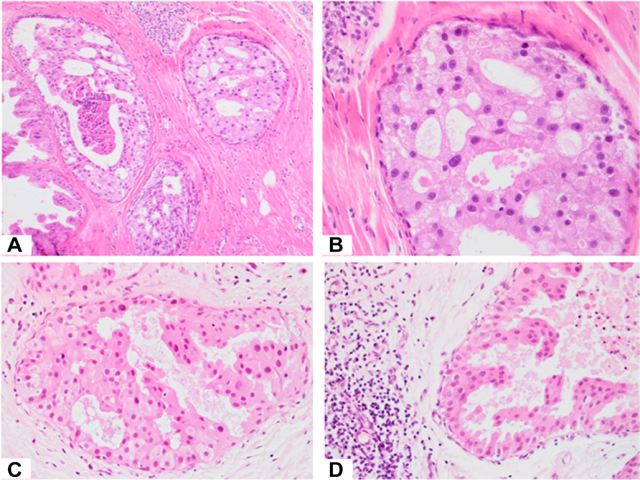
图4. A、B为非典型大汗腺型增生,虽然镜下非典型大汗腺型上皮中可见显著核仁及凋亡,病变充满导管腔,且具有筛状结构,但切除标本中病变范围仅1mm,无显著坏死,无导管周围的炎症,细胞核无2级或3级改变。C、D为非高级别的大汗腺型导管原位癌,病变同样累及整个导管,但切除标本中病变范围数个厘米。同时图中可见微乳头状结构及似筛状结构,管腔内坏死,管周可见炎症细胞浸润。
切除标本中如非典型大汗腺型增生仅局灶存在(不超过2mm),也无导管原位癌中充分的筛状、实性或微乳头状结构,无坏死且细胞核分级不足中等级别或高级别,则建议诊断为非典型大汗腺型增生。硬化性病变中符合低级别(无坏死、细胞级别非中等级别或高级别)大汗腺型导管原位癌的病变周围存在类似病变时,则诊断为低级别大汗腺型导管原位癌;如周围无类似病变,则诊断为大汗腺型非典型病变位于硬化性病变中。
总之,其他方面为良性表现的大汗腺型增生细胞核可出现退行性改变,如核深染、增大,但此时不足以诊断为非典型或原位癌;严格掌握细胞核差异在三倍以上这个标准,结合不规则、增大的核仁,可以避免这类病变的过诊断。具体诊断策略可以参阅图5。
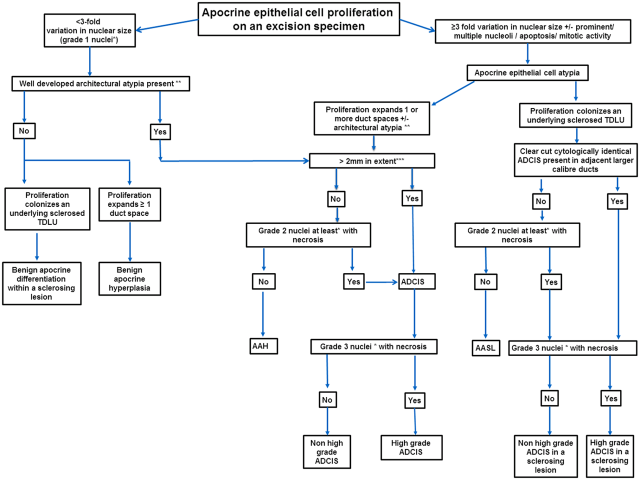
图5. 切除标本中大汗腺型增生病变的诊断策略。AAH:非典型大汗腺型增生;AASL:非典型大汗腺型病变位于硬化性病变内;ADCIS:大汗腺型导管原位癌;TDLU:终末导管小叶单位。
由于目前大汗腺型非典型病变与非高级别的大汗腺型导管原位癌相关诊断及鉴别诊断标准并未得到广泛公认,也未经临床证实,因此对于粗针穿刺活检标本中出现大汗腺非典型病变时,后续处理方案应慎重考虑。如无明显恶性特征,如细胞核显著非典型、坏死、非典型核分裂,或病变范围局限(不超过2mm),则可以发非典型或可疑诊断,并建议对病变区域进行切除或进行多学科讨论。
英国国家医疗服务系统乳腺筛查项目(National Health Service Breast Screening Programme,NHSBSP)工作组曾制定了类似情况下非典型病变的治疗方案,着重强调了影像学引导、真空辅助切除(vacuum-assisted excision,VAE),而并不强调手术切除。本文作者则认为,由于目前研究数据表明非典型大汗腺型增生切除术后病变级别升高(非典型小叶增生、非典型导管增生、伴非典型的柱状细胞改变)的数据很少,因此在大规模、长期随访数据出现之前,可以考虑诊断性手术切除。
点击下载英文文献
点击下载英文文献
参考文献
1.D'Arcy Clare, Quinn Cecily.Apocrine lesions of the breast: part 1 of a two-part review: benign, atypical and in situ apocrine proliferations of the breast[J].Journal of clinical pathology,2018.
DOI:10.1136/jclinpath-2018-205484
2.D'Arcy Clare, Quinn Cecily.Apocrine lesions of the breast: part 2 of a two-part review Invasive apocrine carcinoma, the molecular apocrine signature and utility of immunohistochemistry in the diagnosis of apocrine lesions of the breast[J].Journal of clinical pathology,2018.
DOI:10.1136/jclinpath-2018-205485
















共0条评论