针对乳腺癌HER2指南2013版中模棱两可、难以解读的问题,2018版进一步做了更新,特别是针对“HER2不确定”各种情况的细化,取消了“不确定”的诊断,在临床上减少了医生和患者的很多困扰。
2018版重点关注了5个临床问题,特别是在最后第5个问题的细化和讨论:“每个细胞内HER2拷贝数平均值≥4.0、但<6.0,且HER2/CEP17比值<2.0的浸润癌,这部分此前被认为是ISH中HER2结果疑似阳性的病例,该如何更加精确的处理?”。
新版指出,这类情况应结合IHC进一步工作后方可明确诊断。
A:如果IHC结果为3+,则诊断为HER2阳性;
B:如果IHC结果为2+,则由另一位医师在不知道前述ISH结果的情况下对ISH进行重新评判,在IHC结果为2+的浸润性癌区域计数至少20个细胞;
(1)如ISH重新评判的结果与前次结果不同,则根据内部规定来确定最终结果;
(2)如HIS重新评判的结果仍为每个细胞内HER2拷贝数平均值≥4.0、但<6.0,且HER2/CEP17比值<2.0,则诊断为HER2阴性并备注;
(3)如IHC结果为0或1+,则诊断为HER2阴性并备注。
在第5问题的章节讨论中,涉及的一些问题需要我们注意,这里与大家分享。
1:“HER2拷贝数平均值≥4.0、但<6.0,且HER2/CEP17比值<2.0”(Group 4)在各大临床试验中的发生率约5%左右(1%-16%范围)。放在我们国内,如果医院只挑2+样本来做的话比例可能会更高。
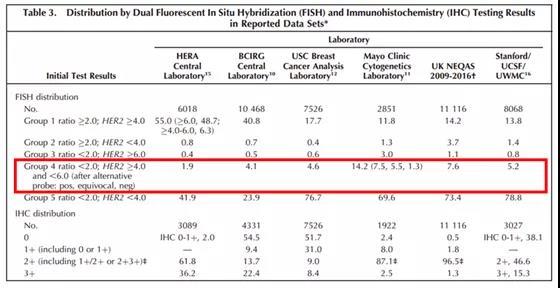
2:文中指出,MayoClinic的数据(总共2851例)显示其中有14%为“不确定”,而这些有高达一半的结果后来经另一探针验证为“阳性”(D17S122位点探针替代CEP17着丝粒探针)。换了内对照探针就有这么大的变化,这一结果挺耐人寻味,请往下看。
A:这些病例往往表现为CEP17拷贝数增加(注意:往往增加数目较少,如三体/四体,而不是很高或成簇扩增),而这可能与(1)着丝粒区域的局部区域获得(gain);(2)17号整条染色体增加了一条/数条;(3)17号染色体的一大部分区段获得;(4)HER2和着丝粒区域共扩增等原因相关。特别是,由于HER2基因处于17q12,离着丝粒区域挨得很近,感觉发生共扩增的可能性会更大。
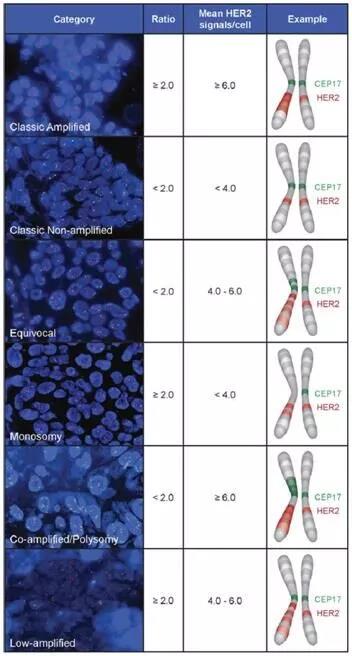
如上图:CEP17当内参时HER2扩增类型示意图。
B:D17S122用于HER2不确定的进一步细究的文献已见有多篇报道。如下图,Donaldson AR等人(2017年)从310例不确定中揪出49例阳性(2007标准)或67例(2013标准),而其中很大部分(25例)就是表现为上述Group 4类型。

C:其探针设计图如下,用的较多的是与HER2同臂的RARA;除了D17S122外,还有短臂的TP53、SMS和RAI1,其中RAI1在SMS范围内。

D:也有paper用多个17号短臂探针一起分析,如下两图。注意:17号短臂的基因(或区段)在肿瘤中容易发生缺失,如TP53基因在多种肿瘤中多可发生杂合子缺失。RAI1和D17S122也有约13%的缺失发生率。

如上图:CEP17着丝粒内参与其他基因RAI1、D17S122、TP53当内参的比较,注意红色框内HER2疑似多体和扩增时的显著差异。
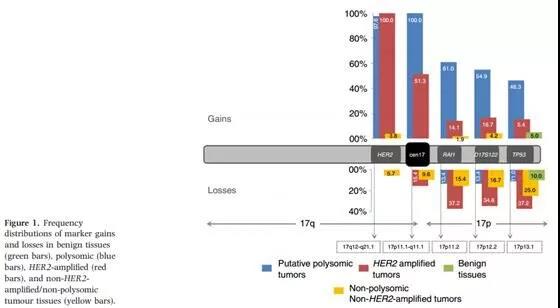
如上图:注意17p各基因(RAI1、D17S122、TP53)当内参时大约有10%多的几率出现缺失。
E:那究竟是以RAI1还是D17S122替代CEP17来当HER2的内参呢?不得不说到2017年发表的这篇paper(Hui Ling et al.)。作者认为,在The Cancer Genome Atlas (TCGA)乳腺癌数据库中,RAI1基因发生高水平扩增的概率大于仅有1%,且仅有不大0.1%的概率与HER2发生共扩增。所以,相对CEP17而言,RAI1扩增的概率非常低,可很好鉴别由于CEP17发生共扩增而导致的比值为不确定。但是,TCGA数据库中显示有一半为RAI1缺失,且韩国Jang等人(2015)数据显示RAI1缺失可能会导致比值变大而变成HER2扩增阳性。但是,Hui Ling认为,韩国的结果受计数方法的偏倚影响较大,其数据显示仅有3.1%(3/97)为RAI1缺失。其采用的标准(特别是不确定定义感觉更合理)供大家参考:
HER2不扩增:HER2/RAI1比值<2.0,每细胞RAI1平均数大于或等于1.5,且40个细胞中有不超过16个细胞表现为只有1个RAI1信号;
HER2扩增:HER2/RAI1比值>2.0;
HER2不确定:RAI1缺失时,RAI1缺失定义:每细胞RAI1平均数小于1.5,且40个细胞中有超过17个细胞表现为只有1个RAI1信号。
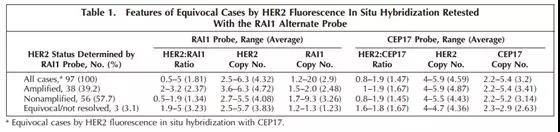
如上图:97例不确定中用RAI1挖掘出38例扩增阳性(39.2%)。
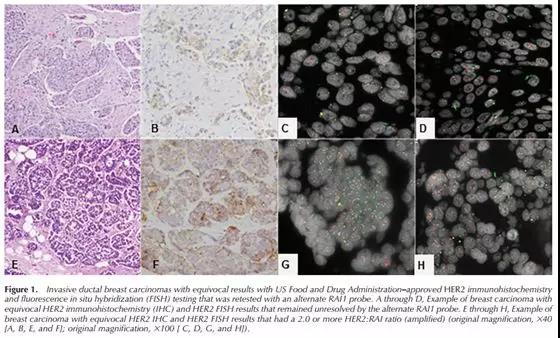
如上图:A-D为一例用RAI1验证后仍为不确定的样本;E-H则也为扩增。
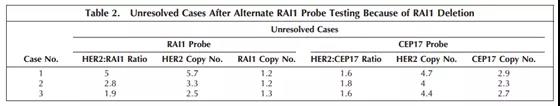
如上图:RAI1发生缺失的3例样本(3/97)。
所以,考虑到RAI1在TCGA数据库中发生扩增的概率很低、及17p各基因都有一定的出现缺失的可能性(约10%多),我们选择了RAI1当内参来鉴别CEP17当内参而表现为不确定的样本。
下图为我们HER2/RAI1(红/绿)外周血培养涂片和组织样本的检测示意图。RAI1探针比CEP17着丝粒探针更短(仅有439kb,而着丝粒探针往往长达几M至几十M),镜下信号更集中结实,不易弥散,利于计数。
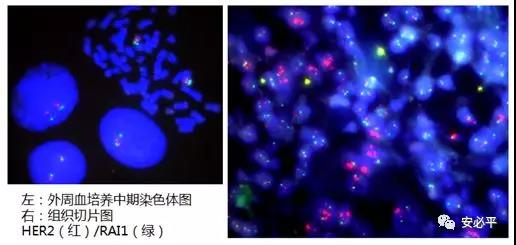
注意:HER2/RAI1产品名称及代码为:
“F.01360-01 HER-2(17q12) /RAI1(17p11)基因检测探针试剂(荧光原位杂交法)”
同时,可能部分老师对HER2扩增的样本有科研需求,比如需要鉴别HER2扩增的区域有多大,有无涉及临近基因(比如TOP2A和RARA)。所以,我们一并设计了两种17q上不同区段(17q21和17q25)的探针,可用于此目的:
F.01361-01 RARA(17q21) / RAI1(17p11)基因检测探针试剂(荧光原位杂交法)
F.01362-01 ASPSCR1(17q25) / RAI1(17p11)基因检测探针试剂(荧光原位杂交法)
需要注意:正如2018版HER2检测指南更新所说的那样,虽然HER2/RAI1有助于进一步细分Group 4“每个细胞内HER2拷贝数平均值≥4.0、但<6.0,且HER2/CEP17比值<2.0的浸润癌,这部分此前被认为是ISH中HER2结果疑似阳性的病例,该如何更加精确的处理?”,但由于这类样本临床继续用药和跟踪的数据很少,鉴别出来为HER2阳性的患者即便用药,其疗效如何仍需大量数据补充。
引用文献:
1:Wolff AC et al., Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Focused Update. Arch Pathol Lab Med. doi: 10.5858/arpa.2018-0902-SA.
2:Hui Ling et al., RAI1 Alternate Probe Identifies Additional Breast Cancer Cases as Amplified Following Equivocal HER2 Fluorescence In Situ Hybridization Testing. ArchPathol Lab Med (2017) 141:274-278.
3:Jang MH et al., Assessment of HER2 status in invasive breast cancers with increased centromere 17 copy number. Breast Cancer Res Treat (2015) 153:67-77.
4:Griffin BB et al., Double-Equivocal HER2 Invasive Breast Carcinomas. Arch Pathol Lab Med (2017).doi: 10.5858/arpa.2017-0265-RA.
5:Ballard M et al., ‘Non-classical’ HER2 FISH results in breast cancer: a multi-institutional study. Modern Pathology (2017) 30:227-235.
6:Donaldson AR et al., Impact of an Alternative Chromosome 17 Probe and the 2013 American Society of Clinical Oncology and College of American Pathologists Guidelines on Fluorescence in Situ Hybridization for the Determination of HER2 Gene Amplification in Breast Cancer. Cancer (2017) 123:2230-9.























共0条评论