[导读] 新辅助化疗的应用越来越广泛,而治疗后标本的病理评估可以提供疗效评估、重要的预后信息,甚至指导进一步治疗。这方面的相关评估方案也层出不穷。匹兹堡大学医学中心及梅奥医学中心两位专家曾就胃肠道及胰腺癌新辅助化疗后病理评估相关问题撰写了综述,并发表于病理界著名杂志《Modern Pathology》。我们择其要点为大家编译介绍如下,希望对各位同仁的日常工作有一定帮助。
整理作者:自在随云
胃肠道癌及胰腺癌新辅助化疗后病理评估概述(2)——连载
胃肠道癌及胰腺癌新辅助化疗后病理评估概述(3)——连载
胃肠道癌及胰腺癌新辅助化疗后病理评估概述(4)——连载
直肠腺癌
近些年,直肠癌的治疗模式出现了显著改变:术前影像学(如内镜超声或MRI)确定为II期、III期的中、低位直肠癌患者,应先行新辅助放化疗,然后再手术切除,这对减少术后的局部复发、提高生存率都有好处;当然,仅就手术方案而言,全直肠系膜切除术也可降低局部复发。
1.直肠腺癌新辅助化疗后的形态学改变
大部分直肠腺癌经新辅助化疗后,仍会有黏膜异常,多表现为溃疡;但也可见外生性病变。不过,黏膜的表现在预测有无腺癌残留方面价值有限。
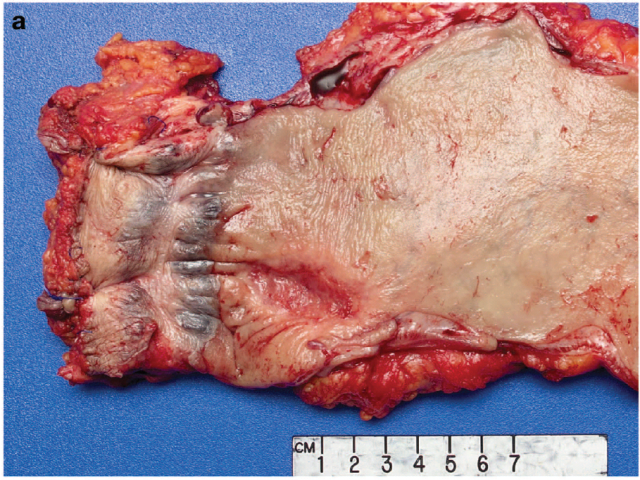
图1. 直肠癌治疗后残余的黏膜异常情况不一,该例中大体表现为4cm、形态相对温和的溃疡;组织学检查证实有肿瘤残余。
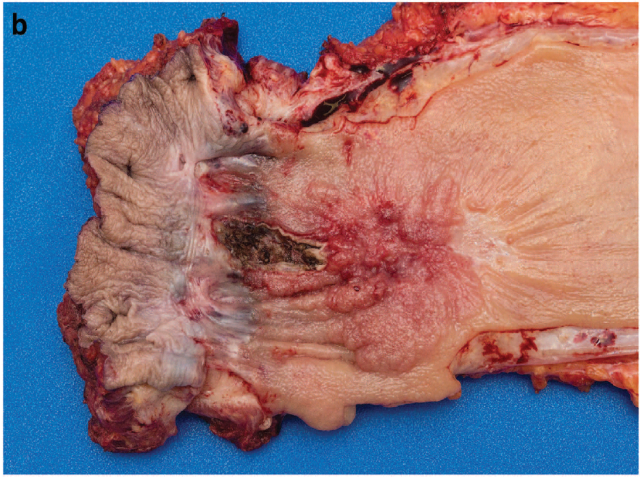
图2. 直肠癌新辅助治疗后的腹会阴联合切除标本,大体仍可见一形态显著的肿瘤。
残余肿瘤细胞可表现为不同程度的治疗反应。最常见的如胞质嗜酸性、空泡化,核仁显著。不过,胞质嗜酸性并没有预后意义。此外,细胞核还可以出现显著非典型、甚至怪异的表现,偶见多核瘤巨细胞。免疫组化方面,部分残余肿瘤细胞神经内分泌表达增强,不过这并不意味着存在神经内分泌癌,可能只是一种治疗反应而已。
新辅助治疗后癌灶周围血管及间质也会有显著改变,如新辅助放疗所致血管内皮显著增生、毛细血管扩张、血栓机化。内皮细胞可以出现显著异型性,间质也常见怪异的成纤维细胞;还可出现含铁血黄素沉积、组织细胞反应(包括巨细胞反应)、纤维化。非肿瘤区的黏膜则可出现凋亡增加、核深染、核多形性等,部分甚至很难与肿瘤性黏膜鉴别。
胃肠道腺癌治疗后都可以出现黏液湖或黏液池。此时要与治疗前活检相比较,以证实是否的确为黏液癌。如黏液湖中没有肿瘤细胞,则这种情况对生存没有不利影响,可以认为是病理学完全缓解。如切缘或淋巴结存在这种无细胞的黏液池,也应认为无肿瘤残余。
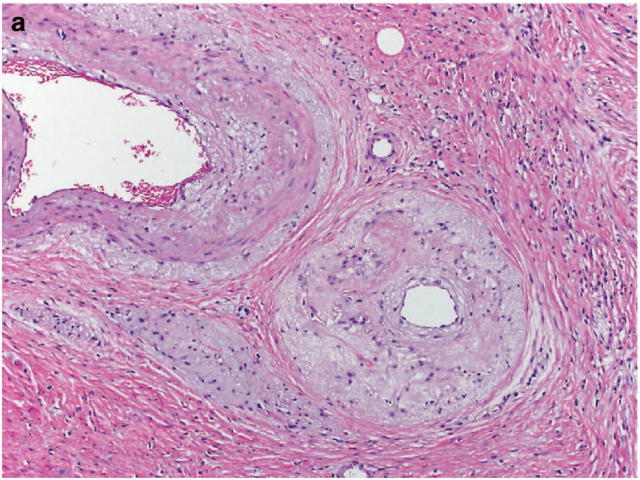
图3. 直肠癌新辅助治疗后,病灶处血管改变十分显著:主要为显著的血管内皮增生。
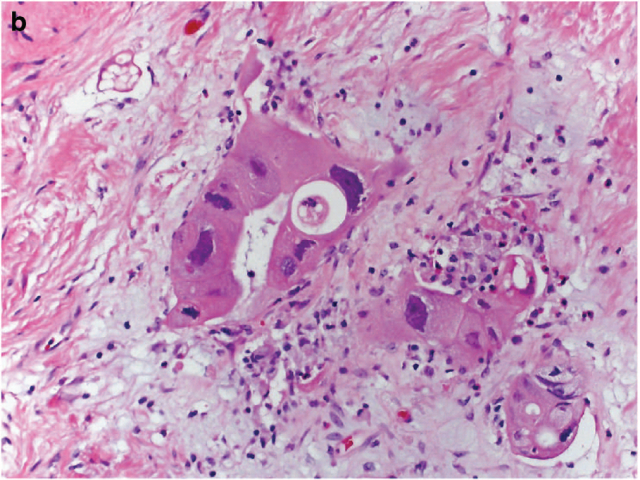
图4. 直肠腺癌新辅助治疗后,多见胞质嗜酸性、核仁显著,核非典型性显著。
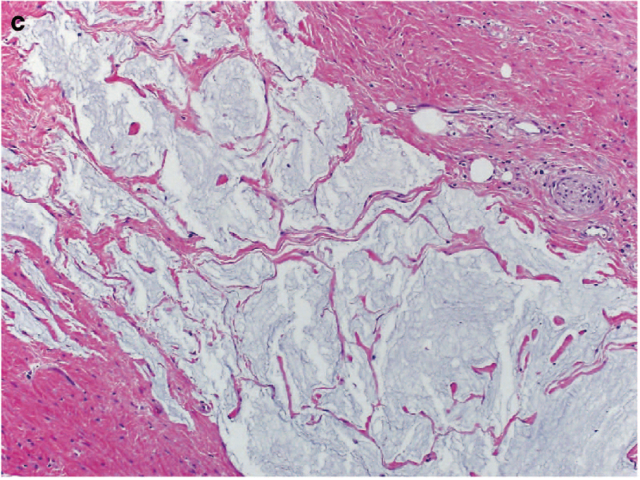
图5. 直肠腺癌新辅助治疗后,常见无细胞的黏液湖,不应误认为是肿瘤残余、且不能据此进行治疗后分期。
2.疗效分级
直肠癌新辅助化疗后评级体系众多,详见表1。
表1.直肠癌新辅助治疗后评级体系概述
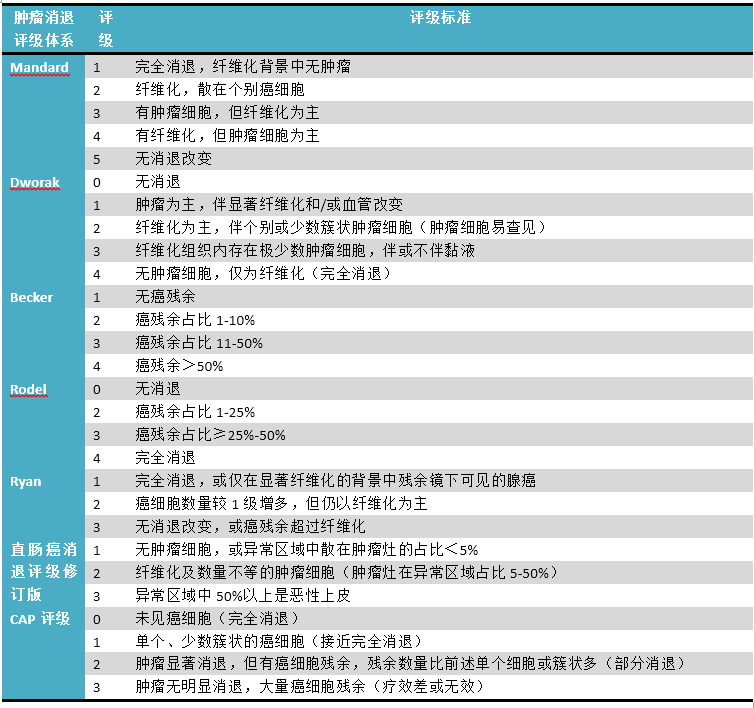
由表1可知,上述评级体系仅对瘤床处进行评估,而不涉及区域淋巴结,且一般是评估纤维化和残余肿瘤的比例,或者评估残余肿瘤与治疗前的比例。两种评估方法各有利弊,且治疗所致的纤维化、肿瘤本身的促纤维结缔组织反应鉴别起来也有困难。当然,对所谓“瘤床”的大小判定也很有难度。
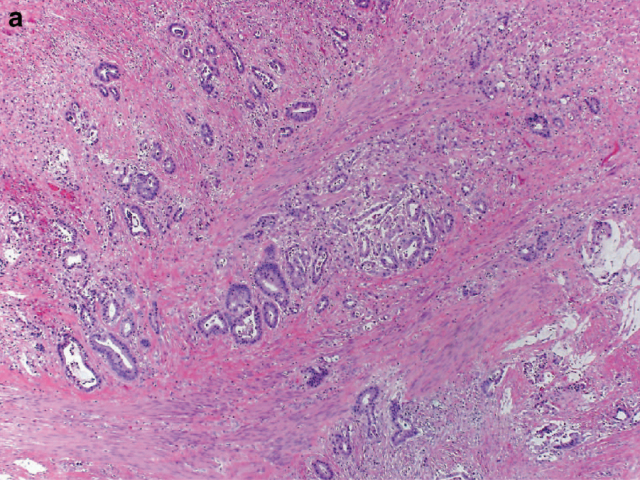
图6. 直肠癌新辅助治疗后消退评级,CAP方案需评估残余肿瘤与纤维化的比例;本例则为疗效较差:大量肿瘤残余,CAP评级3级。
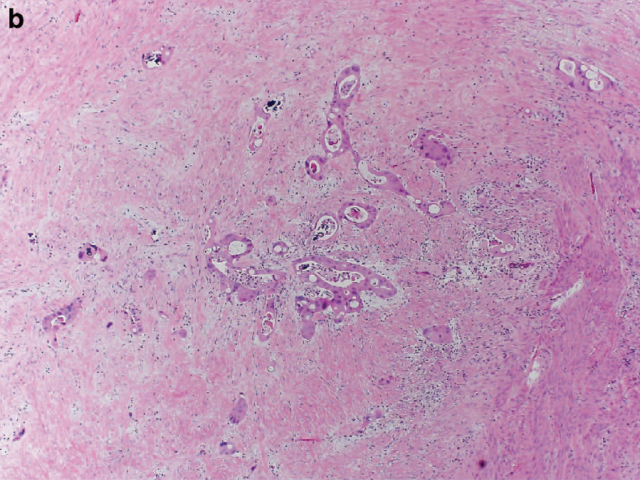
图7. 直肠癌新辅助治疗后消退评级,本例可见肿瘤残余,但纤维化为主,因此按照CAP方案评级为2级。
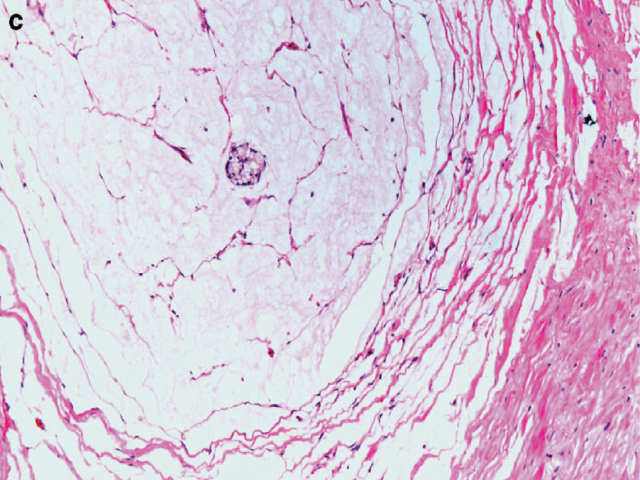
图8. 直肠癌新辅助治疗后消退评级,本例中仅有一簇肿瘤细胞残余,其余均为黏液湖,因此按照CAP方案评为1级。
3.直肠癌新辅助治疗后标本处理及病理报告要点
直肠癌新辅助治疗后标本的病理评估可以提供重要的预后信息,如直肠系膜是否完整切除、镜下疗效评估、环周切缘情况等。其中如肿瘤距环周切缘不足1mm,则视为阳性。其余信息如淋巴结情况、肿瘤与切缘距离、切缘情况等,该文不再赘述。
如前所述,病理疗效评估中涉及瘤床及纤维化情况,因此标本规范化处理很关键。具体如切开方式、固定时间(有人提出至少48小时)、取材时要仔细评估肿瘤与周围各组织及切缘(如环周切缘)的关系,取材间隔厚度3-5mm等。如黏膜面残余病变较小(≤3cm),建议全部取材。除黏膜面异常区域下方外,有时肿瘤可存在于远离该处的区域,甚至2cm之外也有可能。因此应对残余病灶周边进行取材。淋巴结取材更要标明具体部位,以利于后期评估阳性淋巴结与肿瘤的关系。就环周切缘而言,至少应取材三块。
就淋巴结数量而言,目前AJCC及CAP指南均建议至少12枚淋巴结时,分级才算得上精确。理论上讲,全直肠系膜切除标本中约有25-30枚淋巴结;检出数量越多,TNM分期越精确。当然,新辅助治疗情况下检出淋巴结可能很困难,必要时可以采取特殊处理,以提高淋巴结的检出数量。
镜下疗效评估详见前述。具体采取哪种方案,应在病理报告中注明。当然,就病理完全缓解而言,需是建立在整个病灶详尽评估的基础上。
点击下载英文文献
参考文献:
Pai RK.Pathologic assessment of gastrointestinal tract and pancreatic carcinoma after neoadjuvant therapy[J].Modern pathology ,2018,31(1):4-23.






















共0条评论