[导读] 新辅助化疗的应用越来越广泛,而治疗后标本的病理评估可以提供疗效评估、重要的预后信息,甚至指导进一步治疗。这方面的相关评估方案也层出不穷。匹兹堡大学医学中心及梅奥医学中心两位专家曾就胃肠道及胰腺癌新辅助化疗后病理评估相关问题撰写了综述,并发表于病理界著名杂志《Modern Pathology》。我们择其要点为大家编译介绍如下,希望对各位同仁的日常工作有一定帮助。
整理作者:自在随云
胃肠道癌及胰腺癌新辅助化疗后病理评估概述(1)——连载
胃肠道癌及胰腺癌新辅助化疗后病理评估概述(2)——连载
胃肠道癌及胰腺癌新辅助化疗后病理评估概述(4)——连载
食管及胃食管交界处的癌
食管腺癌的发病率有所增加,但生存率也显著改善,其原因众多,包括早期检出、辅助治疗的进展等。
1.食管及胃食管交界处癌新辅助治疗后的形态学
一般而言,食管及胃食管交界处癌新辅助治疗后的形态学改变与大肠癌类似,如胞质嗜酸性、核固缩、核碎裂。当然,疗效评估中最重要的是判定瘤床内治疗相关间质改变与残余癌的比例。
这一部位的腺癌新辅助治疗后也会出现黏液湖,其中细胞数量不一,可出现于食管壁的任意部位。与大肠癌不同的是,新辅助治疗后具有黏液湖的食管及胃交界处腺癌大部分在治疗前活检中即表现为具有黏液样分化、或印戒细胞分化的腺癌。
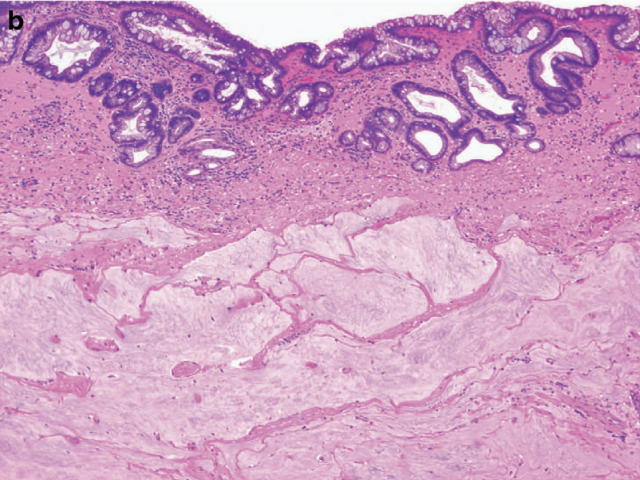
图1. 胃及食管交界处腺癌新辅助治疗后切除标本,组织学检查见Barrett食管,食管壁内大量无细胞的黏液。
需要注意的是:治疗后分期时,含细胞的黏液湖并非分期依据,只有明确的残余癌才是分期依据;手术切缘及浆膜面含细胞的黏液湖与复发及转移无关,因此不能判读为阳性;淋巴结中只有纤维化、或只有无细胞的黏液湖,也不应判读为阳性。
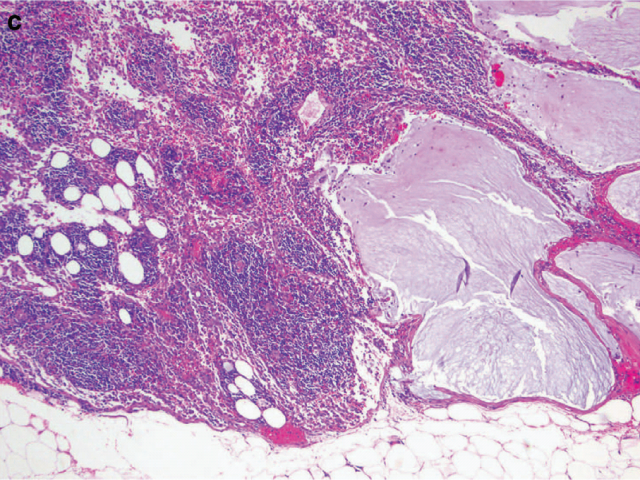
图2. 新辅助治疗后食管切除标本,淋巴结内可见无细胞的黏液,不要误判为转移。
新辅助治疗后的鳞癌也会有些组织改变,如大量无细胞的角蛋白伴巨细胞反应,此时不要误判为癌;无细胞核的鬼影状肿瘤性鳞状细胞,也不要判为癌。免疫组化角蛋白染色无助于鉴别。食管黏膜下腺体的鳞状化生出现治疗相关改变时,非常类似浸润性鳞癌,但其轮廓仍为圆形,具有分叶状结构,且间质无促纤维结缔组织反应,可以与浸润性鳞癌区分。
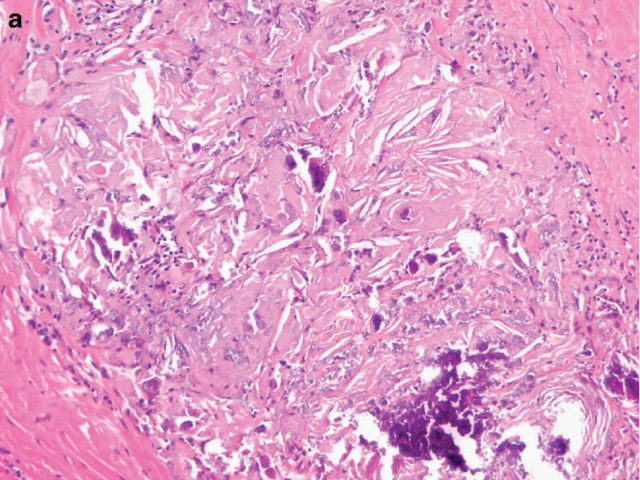
图3. 食管鳞癌新辅助治疗后切除标本,可见大量角化物,黏膜下可见钙化。
新辅助治疗后的食管及胃食管交界处癌可以出现神经内分泌分化,如免疫组化表达Syn、CgA,且有研究表明这种情况预后更差;作者推测这可能是神经内分泌分化的肿瘤耐药性更强所致。
2.疗效分级
这方面方案众多,详见表3。
表3.食管及胃食管交界处癌新辅助治疗后标本肿瘤消退评级方案概述
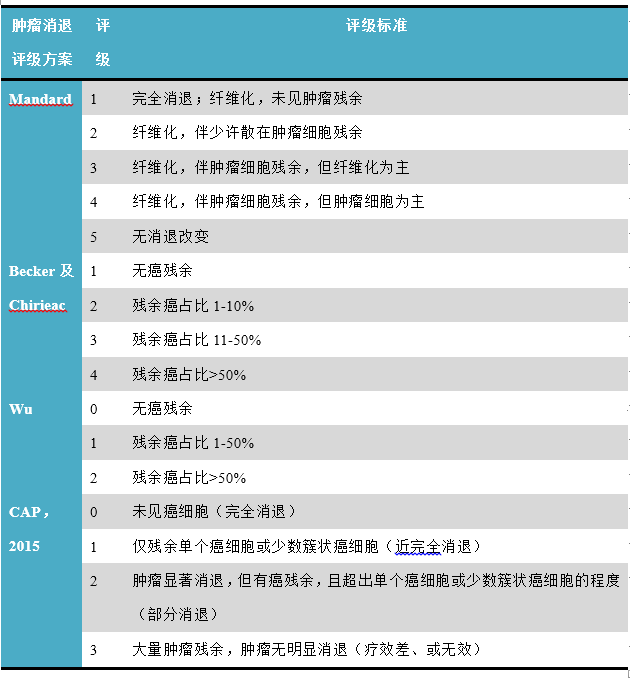
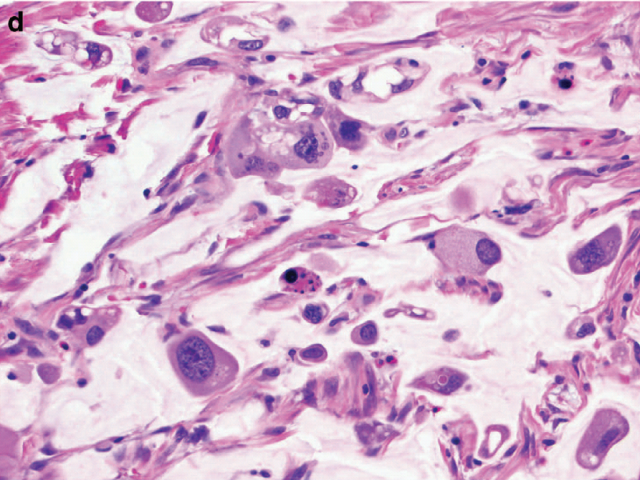
图4. 新辅助治疗后食管切除标本,瘤床全部送检,仅为黏液湖中散在少数簇状腺癌细胞(在瘤床中的占比<10%),细胞学特征符合治疗后改变;按照CAP方案评级为1级,近完全消退。
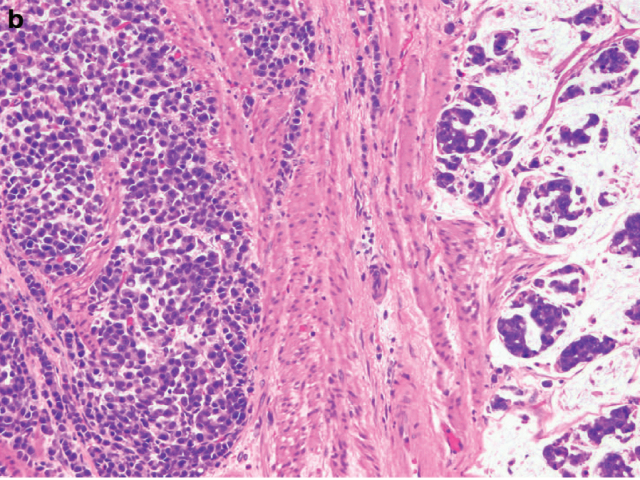
图5. 新辅助治疗后食管切除标本,可见大量癌细胞残余,按照CAP方案评级为3级,疗效差;图中左侧可见神经内分泌分化,右侧则为黏液癌分化。
3.食管及胃食管交界处癌新辅助治疗后标本处理及病理报告要点
大体未见肿瘤残余的病例,需对整个瘤床进行组织学检查以评估有无肿瘤残余;对于大体有肿瘤残余者,则应广泛取材;大体有残余而初检镜下未见肿瘤者,应对整个瘤床全部取材。标本中应检出淋巴结的数量最低值尚无统一意见,NCCN指南建议最少15枚;如详细检查后淋巴结数量仍不达标,则应将食管周围、胃周围的脂肪组织全部取材镜检。
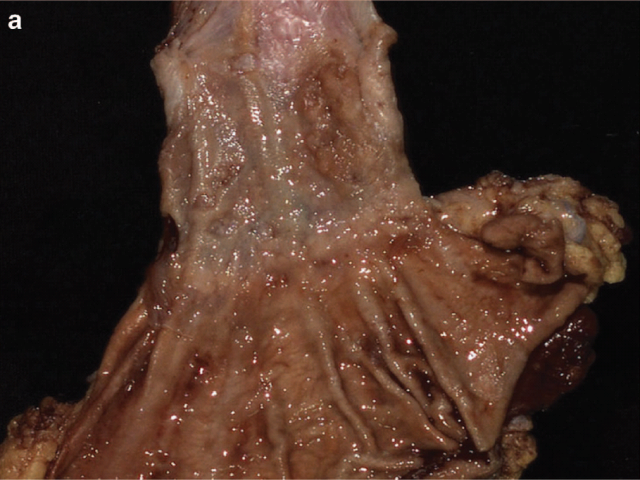
图6. 新辅助治疗后食管切除标本,大体可见柱状上皮被覆于食管远端,黏膜不规整,但未见明显肿物。
治疗前后的分期可能有所差异,应在病理报告中体现出来。如有印戒细胞分化也应记录在报告中,治疗前活检中可能无此改变。
点击下载英文文献
参考文献:
Pai RK.Pathologic assessment of gastrointestinal tract and pancreatic carcinoma after neoadjuvant therapy[J].Modern pathology ,2018,31(1):4-23.




















共0条评论