[导读] 一个偶然的机会在“中美加宫颈病理学交流群”中听闻一位华人病理学家提及了《Robbins Basic Pathology》这本书,出于对“Basic”的兴趣(想必也是最基础、最基本的知识以及各个器官系统的常见病、多发病),在华夏病理学网下载第9版进行了学习,现将“女性生殖系统”的部分内容编译如下,不当之处恳请批评指正……
▌译者:王巍伟 山东省诸城市妇幼保健院病理科
(三)乳腺肿瘤
肿瘤是女性乳腺最重要的一种病变。虽然肿瘤可以起源于结缔组织或上皮组织结构,但常见乳腺肿瘤多为上皮组织起源。
1、纤维腺瘤(Fibroadenoma)
纤维腺瘤是目前女性乳腺最常见的良性肿瘤。这是一种双相性肿瘤,由纤维性间质和衬覆上皮的腺体构成;然而,仅有间质细胞为克隆性生长且为真正的肿瘤性成分。纤维腺瘤通常发生于年轻女性,发病高峰为30岁。一般表现为实性、离散的、活动性肿物。雌激素的增加绝对或相对促进了纤维腺瘤的发生发展。另外,月经周期晚期和妊娠期,纤维腺瘤可能增大;绝经后,它们可以发生退变和钙化。
| 形态学特征 |
| 纤维腺瘤可以形成离散性肿物,直径1cm-10cm,呈实性(图6)。切面呈均匀的棕黄色-白色,间以柔和的黄-粉色斑点(含有腺体的区域)。组织学检查显示,疏松的纤维性间质中含有导管样、衬覆上皮、形状和大小不一的腔隙。与正常乳腺组织一样,这些腺样腔隙内衬腺上皮细胞和肌上皮细胞,伴有明确、完整的基底膜。 |
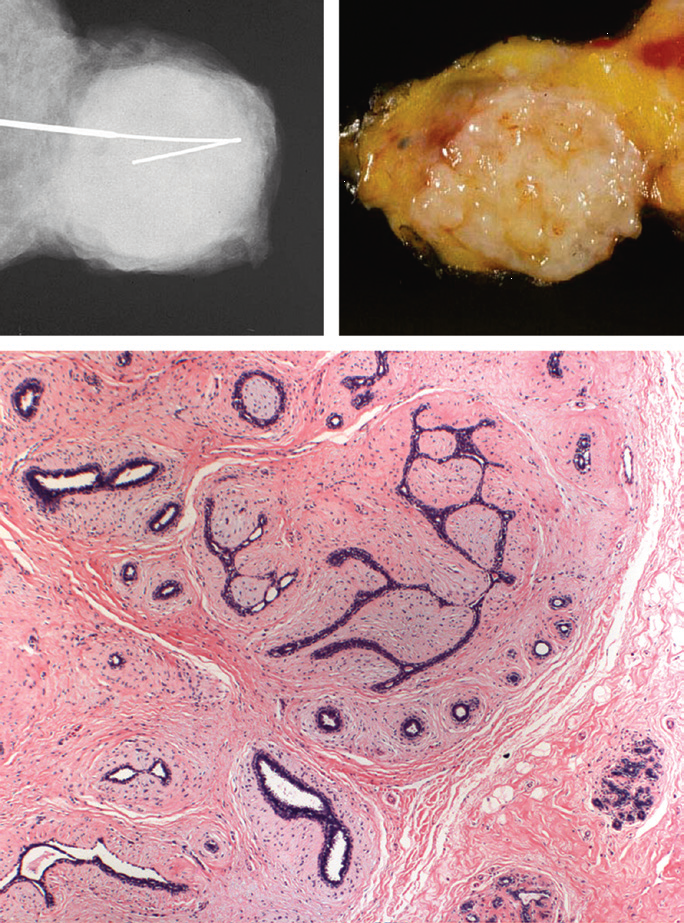
图6 纤维腺瘤。
A,X线影像学显示特征性、界限清楚的肿物;B,大体标本中,一个有弹性、界限清楚的肿物与周围脂肪组织分界清楚;C,这张显微镜下照片中,小叶内间质增生挤压其包绕的腺体,产生一种“推挤性”边界,与周围正常组织界限清楚。
2、叶状肿瘤(Phyllodes Tumor)
与纤维腺瘤一样,乳腺叶状肿瘤也是一种由肿瘤性间质细胞和被覆上皮的腺体组成的双相性肿瘤。然而,这些肿瘤的间质成分更加丰富且富于细胞,通常形成衬覆上皮的叶状突出物。这些肿瘤较纤维腺瘤少见,是一种原发性肿瘤,并不是起源于先前所存在的纤维腺瘤。叶状肿瘤过去口头上均称之为“叶状囊肉瘤”,但这一名称并不恰当,因为这些肿瘤一般为良性。提示为恶性肿瘤的一些不祥征兆包括间质细胞数量增加、间变、高分裂活性、生长迅速以及浸润性边界。幸运的是,大多数叶状肿瘤仍然局限于局部并且可以通过手术切除治愈;恶性病变可以复发,但其亦倾向于局限于局部。仅有15%的病例为恶性,可以发生远处部位转移。
3、导管内乳头状瘤(Intraductal Papilloma)
导管内乳头状瘤是一种良性的肿瘤性乳头状增生。最常见于绝经前女性。该病变通常为实性,发生于主要的输乳管或输乳窦。临床表现可以为:
浆液性或血性乳头溢液
乳晕下小肿瘤(直径几个毫米)
乳头内陷(罕见)
| 形态学特征 |
| 该肿瘤通常为实性且直径不足1cm,在扩张的导管内呈易碎性、分支状生长。组织学检查,由众多的乳头构成,每一个乳头均含有纤维组织轴心以及衬覆其上的上皮细胞,上皮细胞为双层(腺上皮外为肌上皮层)。双层上皮的存在可以帮助将其与导管内乳头状癌鉴别,后者所表现出的临床特征与良性乳头状瘤相似。 |
4、癌(Carcinoma)
2010年,美国诊断为浸润性乳腺癌的病例有200000多例,并且约有40000例女性患者死于该病,在女性癌症相关性死亡原因中仅次于肺癌。在美国,女性一生中发生乳腺癌的风险为1:8。在过去三十年间,那些诊断为乳腺癌患者的死亡率由30%降为20%,主要是由于筛查和治疗的改进。
流行病学及风险因素
已经明确了很大一部分乳腺癌风险因素。表1将这些因素分为明确组和不明确组,并且在可能情况下提示每一因素的相对风险。一些更为重要的风险因素总结如下:
年龄:女性一生中,随着年龄的增长,其发生乳腺癌的风险逐步增加,特别是绝经后,发病年龄高峰大约为80岁;75%女性乳腺癌患者年龄大于50岁,且仅有5%患者年龄小于40岁。
地理区域差异:不同国家之间乳腺癌的发病率和死亡率差异令人吃惊。北美和欧洲北部女性发生乳腺癌的风险显著高于亚洲和非洲。例如,美国女性乳腺癌的发病率和死亡率与日本相比要高出5倍。这些差异似乎为环境因素所致(而非遗传),因为从低发病率地区迁移到高发病率地区后,其发病率就与她们所迁入国家的发病率相同,反之亦然。这些环境因素包括饮食、生殖方式以及护理习惯等。
种族差异:乳腺癌发病率最高的是非西班牙白色人种。然而,西班牙和非洲裔美国女性发生乳腺癌的年龄趋于年轻化,并且更可能发生表现为晚期的浸润性肿瘤。种族之间的这些差异是一个热门的研究领域,目前认为是由遗传差异和社会因素结合所致,例如所选择的生活方式和获得的医疗保健。
外源性雌激素的持续暴露:发生于绝经后雌激素替代治疗,已证实其对预防骨质疏松症有所帮助。然而,最近研究显示,雌激素和孕激素联合治疗的短期应用与乳腺癌的发生风险增加、诊断时即为乳腺癌晚期以及乳腺X线摄影较高的发病率相关。由于2002年女性健康倡议报告提示雌激素和孕激素联合应用弊大于利,所以雌孕激素的联合应用急剧下降,同时需要对围绝经期女性激素治疗进行仔细再次评估。
口服避孕药:研究显示其不影响乳腺癌的发病风险,即使是长期服用的女性或有乳腺癌家族史的女性。
电离辐射:胸部电离辐射使乳腺癌的发病风险增加。该因素风险的大小与放射剂量、暴露时间以及年龄有关。只有30岁之前处于乳腺发育过程中的女性才会受到辐射的影响。例如,10几岁和20几岁接受放射治疗的霍奇金淋巴瘤女性患者中,20%-30%会发生乳腺癌,但是30岁之后接受放射治疗的女性患者一生中发生乳腺癌的风险并没有增加。重要的是,乳腺筛查所使用的低剂量辐射对于乳腺癌的发病率并无显著影响。
人口研究分析显示,许多其他、不明确的风险因素(例如,肥胖、饮酒以及高脂饮食)在乳腺癌的发生发展过程中也发挥一定作用。与肥胖症相关的风险可能是由于乳腺暴露于脂肪组织所产生的雌激素环境中。
表1 乳腺癌风险因素
| 风险因素 |
| 明确风险因素 | 相对风险 |
| 地理区域 | 不同区域有所不同 |
| 年龄 | 30岁后增加 |
| 家族史 |
| 一级亲属患有乳腺癌 | 1.2-3.0 |
| 绝经前 | 3.1 |
| 绝经前且为双侧 | 8.5-9.0 |
| 绝经后 | 1.5 |
| 绝经后且为双侧 | 4.0-5.4 |
| 月经史 |
|
| 月经初潮年龄<12岁 | 1.3 |
| 绝经年龄>55岁 | 1.5-2.0 |
| 妊娠 |
| 第一胎生育年龄25-29岁 | 1.5 |
| 第一胎生育年龄30-34岁 | 1.9 |
| 第一胎生育年龄大于35岁 | 2.0-3.0 |
| 未产女性 | 3.0 |
| 良性乳腺疾病 |
| 无非典型性增生性疾病 | 1.6 |
| 伴非典型性增生性疾病 | >2.0 |
| 小叶原位癌 | 6.9-12.0 |
| 其他可能风险因素 |
| 外源性雌激素的使用 |
| 口服避孕药 |
| 肥胖 |
| 高脂肪饮食 |
| 饮酒 |
| 吸烟 |
注:Data from Bilimoria MM, Morrow M: The women at increased risk for breast cancer:evaluation and management strategies. CA Cancer J Clin 46:263, 1995.
| 发病机制 |
乳腺癌的病因仍然不完全清楚。然而,以下三种因素似乎非常重要:(1)遗传学改变;(2)激素影响;(3)环境改变。 (1)遗传学改变 所有类型乳腺癌中,乳腺上皮细胞的原癌基因和肿瘤抑制基因发生基因突变是肿瘤发生的基础。最具特征性的就是HER2/NEU原癌基因的过度表达,其在高达30%的浸润性乳腺癌发生扩增。该基因是上皮生长因子受体家族成员,并且其过度表达与不良预后相关。在一些人类乳腺癌中,RAS基因和MYC基因的扩增也有所报道。众所周知的肿瘤抑制基因Rb和TP53也可能存在基因突变。大量基因的失活(包括雌激素受体基因)可能是由启动子区甲基化所致。毋庸置疑,转录过程涉及多种所获得的遗传学改变,其可以各种各样的组合方式发生,因此也就产生了乳腺癌的不同亚型。基因表达谱可以将乳腺癌分为以下四种分子亚型:(1)管腔A型(雌激素受体阳性,HER2阴性);(2)管腔B型(雌激素受体阳性,HER2过度表达);(3)HER2阳性型(HER2过度表达,雌激素受体阴性);(4)基底细胞样型(雌激素受体阴性,HER2阴性)。这些分子分型与不同预后及一些情况下不同治疗相关。 大约10%的乳腺癌与一些特定的遗传性突变相关。携带乳腺癌易感基因的女性更可能发生双侧乳腺癌、其他一些类型的家族遗传性癌(例如:卵巢癌)、具有阳性家族史(即:多为一级亲属在绝经前受累及)、绝经前发生乳腺癌并且属于明确的种族群体(例如:德系犹太人后裔人群)。大约1/3伴有遗传性乳腺癌女性发生了BRCA1(位于17染色体q21.3)和BRCA2(位于13染色体q12-13)基因的突变。这些基因编码较大的、复杂性蛋白,两种蛋白之间或与其他种类蛋白未显示有紧密的同源性。虽然它们与乳腺癌风险具有较强相关性的分子基础仍然还处于研究阶段,但是认为BRCA1和BRCA2两者都是在常规DNA修复过程中发挥作用。 一般来讲,BRCA1和BRCA2是典型的肿瘤抑制基因,只有当等位基因均发生失活或存在缺陷时才会发生癌变,第一次遗传性损伤是由种系突变所致,第二次则由随后的体细胞突变所致。可以进行遗传学检测,但是这种检测的结果会非常复杂,因为存在数以百计的不同的突变性等位基因,而其中仅有一部分存在肿瘤易感性。特定的突变之间,其外显的程度、癌症的发病年龄以及其他类型癌症的易感性也有所不同。然而,大多数发生突变女性发生乳腺癌的年龄为70岁,而仅有7%未发生突变的乳腺癌患者发生于这一年龄。这些基因在非遗传性、散发性乳腺癌中所起的作用尚不清楚,因为在散发性乳腺癌中罕见BRCA1和BRCA2发生基因突变。一些罕见的与乳腺癌相关的遗传性疾病包括Li-Fraumeni综合症(由TP53种系突变所致)、Cowden综合症(由PTEN种系突变所致,先前子宫内膜癌一部分提及)以及共济失调-毛细血管扩张症。 (2)激素影响 内源性雌激素过多(或更准确的说是激素失衡)明显具有重要作用。许多所述的风险因素(例如:生育期持续时间较长、未产妇以及生育第一胎时的年龄较大)均涉及无孕激素对抗性的雌激素暴露增加(表1)。能够产生雌激素的功能性卵巢肿瘤与绝经后女性所发生的乳腺癌相关。雌激素可以刺激产生生长因子,例如:转化生长因子-α、血小板衍生生长因子、纤维母细胞生长因子及其他,它们可以通过旁分泌和自分泌机制促进肿瘤的发生发展。 (3)环境改变 遗传学同质人群以及不同地理区域乳腺癌的发病率不同提示存在环境因素的影响,正如前所述。 |
| 形态学特征 |
乳腺癌最常见的发生部位为乳腺外上象限1/4区域(50%),中心部位次之(20%)。约4%的女性乳腺癌患者可以发生双侧原发性肿瘤或同一侧乳腺的连续性病变。 根据是否存在限制性基底膜的浸润,乳腺癌可以分为:(1)那些仍然位于基底膜之内的肿瘤称之为原位癌;(2)那些超出基底膜的肿瘤称之为浸润性癌。在这一分类中,乳腺癌的主要类型如下: A、非浸润性:1、导管内癌(DCIS) 2、小叶内癌(LCIS) B、浸润性:1、浸润性导管癌(非特殊类型),浸润性癌最常见的亚型 2、浸润性小叶癌 3、髓样癌 4、胶样癌(黏液性癌) 5、小管癌 6、其他类型 ■ 1、非浸润性(原位)癌 非浸润性癌有两种类型:DCIS和LCIS。形态学研究发现,这两种类型的非浸润性癌通常都是起源于终末导管小叶单位。DCIS往往为肿瘤细胞充满导管样腔隙并且使其发生扭曲。与之相比,LCIS通常呈膨胀性生长,但其不会使小叶腺泡发生改变。两者均局限于基底膜之内并且不会发生间质或淋巴管血管的浸润。 DCIS具有各种各样的组织学表现。结构类型通常为混合性,包括实性、粉刺型、筛状型、乳头型、微乳头型以及“贴壁”型。这些类型中,任何一种都可以出现坏死。所给的同一病例中细胞核趋于一致,形态表现从温和、单一(低级别细胞核)至多形性(高级别细胞核)变化不等。粉刺型具有独特的形态学特点,表现为高级别细胞核和广泛的中心性坏死(图7)。在导管横切面使用轻微压力就可以挤出牙膏样坏死物。DCIS经常伴有钙化,可能是钙化性坏死碎屑或钙化性分泌物质。未进行乳腺癌筛查人群中,诊断处于DCIS阶段的乳腺癌仅占5%,而进行乳腺癌筛查人群可高达40%,这主要是因为在乳腺X线影像学检查中能够检测到钙化。DCIS罕见表现为可触及的肿物或影像学检查发现的肿物。DCIS预后极好,超过97%的单纯乳腺切除术后患者可以长期无病生存。在一些女性中,发生了远处转移但并无局部复发;这些患者通常具有广泛高级别DCIS,可能伴有小的、未检测到的浸润性区域。至少1/3伴有小范围低级别DCIS且未经治疗的女性最终会发展为浸润性癌。当浸润性癌发生后,一般与早期的DCIS位于同侧乳腺的同一象限。当前的治疗方法就是通过外科手术和放疗将DCIS清除干净。抗雌激素治疗(例如:他莫西芬和芳香化酶)也可以降低复发风险。 乳头Paget病是DCIS沿着输乳管向上延伸并且进入邻近的乳头皮肤所致,表现为单侧乳头及乳晕皮肤表面出现结痂性渗出。几乎所有的病例都存在位于下方的癌,并且这些癌中大约50%为浸润性。预后根据位于其下方的癌而定,并且不受所存在Paget病的影响。 LCIS具有一致的表现。细胞呈单型性,细胞核温和、圆形,在小叶内呈松散黏附的簇状(图8)。常见细胞内黏液空泡(有时候形成印戒样细胞)。LCIS几乎总是偶然发现,因为其与DCIS不同,罕见有相关性钙化。因此,LCIS的发病率在乳腺X线影像学筛查人群中仍然没有改变。大约1/3的LCIS女性最终将发展为浸润性癌。与DCIS不同,随后所发生的浸润性癌可以发生于任何一侧乳腺。这些癌中,绝大多数为浸润性小叶癌;然而,浸润性导管癌也可以发生于LCIS中。因此,LCIS既是两侧乳腺癌变风险增加的标志,也是一些癌症的直接先兆。当前的治疗方法包括:(1)化学预防(他莫西芬),同时进行密切的临床和影像学随访评估;(2)双侧乳腺预防性切除(少见)。 ■ 2、浸润性癌 首先描述浸润性癌亚型中特殊的组织学特征,其次为所有亚型共同的大体特征。 浸润性导管癌(IDC)这一名称用来描述所有的、不能归为下述任何特殊类型的乳腺癌。一大部分乳腺癌(70%-80%)可以归为这一组。这种类型的乳腺癌通常与DCIS相关,罕见与LCIS相关。大多数浸润性导管癌会产生促结缔组织增生性反应,其可以取代正常乳腺脂肪组织(导致乳腺X线影像学密度增加)并且形成较硬、可触及的肿物(图9)。显微镜下观察,肿瘤异质性明显,从管状结构形成良好、细胞核呈低级别的肿瘤至含有片状间变性细胞的肿瘤(图10)。肿瘤边缘通常不规则。可见淋巴管血管浸润。约2/3病例表达雌激素受体(ER)和孕激素受体(PR),约1/3病例过表达HER2/NEU。 浸润性小叶癌(ILC)中的细胞形态与LCIS完全相同。2/3的病例与其邻近的LCIS相关。肿瘤细胞单个浸润间质,并且经常排列成“单行”绳索状或链条样。这种生长方式与E-cadherin突变后功能丧失相关(E-cadherin是一种有助于乳腺上皮细胞黏附的表面蛋白)。虽然大多数表现为可触及的肿物或X线影像学密度增加,但是这组重要的肿瘤可以表现为弥漫性浸润而无促结缔组织增生性反应且在临床上比较隐蔽。小叶癌在乳腺癌中具有独特的转移方式,它们比较常见的转移部位有脑脊液、浆膜表面、胃肠道、卵巢、子宫以及骨髓。多中心性和双侧性小叶癌也较常见(10%-20%)。几乎所有小叶癌都表达激素受体,而HER2/NEU过表达罕见。这些肿瘤占乳腺所有肿瘤不足20%、 炎性癌临床表现为乳腺增大、肿胀且带有红斑,一般无可触及的肿物。该肿瘤通常为低分化且呈弥漫性浸润。特征性表现为肿瘤可以侵及真皮下淋巴管。结果导致这些管道堵塞而引起水肿,产生特征性的“炎症性”临床表现,而真正的炎症很轻或无。许多这种肿瘤发生了远处转移,整体5年生存率不足50%,如果诊断时已经发生了远处转移的那些病例生存率甚至可能更低。 髓样癌是一种罕见的乳腺癌亚型,占所有乳腺癌不足1%。这类肿瘤由成片、较大的间变性细胞组成,边界清楚、呈“推挤”状(图11A)。临床上,该肿瘤可以被误认为是纤维腺瘤。常常有明显的淋巴浆细胞浸润。通常无或很少有DCIS成分。虽然大多数髓样癌女性患者并未携带BRCA1基因突变,但是女性BRCA1基因突变频率的增加可以导致髓样癌的发生。这类肿瘤均缺乏雌激素和孕激素受体的表达,且无HER2/NEU过表达(联合起来通常称之为“三阴”)。 胶样(黏液性)癌也是一种罕见亚型。肿瘤细胞产生大量的细胞外黏液并伸入周围间质(图11B)。与髓样癌一样,它们通常表现为界限清楚的肿物,而且也可能被误认为是纤维腺瘤。大体检查,肿瘤一般呈柔软、胶冻样。大多数表达激素受体,但无HER2/NEU过表达。 小管癌很少表现为可触及的肿物,但是10%的浸润性癌小于1cm(乳腺X线影像学筛查时发现肿物大小)。它们通常是在乳腺X线影像学检查表现为密度不规则时被发现。显微镜下观察,肿瘤由结构良好的小管组成,小管上皮细胞核呈低级别。罕见淋巴结转移,预后良好。几乎所有的小管癌都表达激素受体且无HER2/NEU过表达。 浸润性癌的共同特征:所有类型乳腺癌局部病变进展后可以导致相似临床表现。浸润性癌往往会黏附和固定于胸部肌肉或胸壁及表面皮肤的深筋膜,导致皮肤和乳头的回缩或凹陷。这是一种非常重要的表现,因为其可能为恶性肿瘤所出现的第一体征。肿瘤累及淋巴通路可以引起局部慢性淋巴水肿。在这些病例中,扩张毛囊周围的皮肤增厚,使其呈橘皮样外观。 |
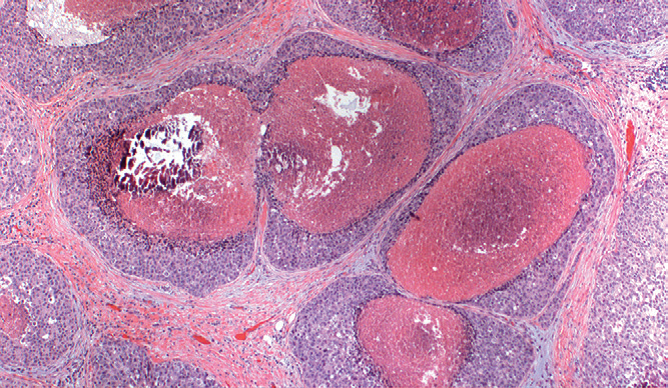
图7 粉刺型导管原位癌(DCIS)。
许多相邻导管内充满肿瘤细胞,伴有大面积中心区域坏死以及钙化性碎屑。影像学检查所出现的钙化最常见于这种类型DCIS。
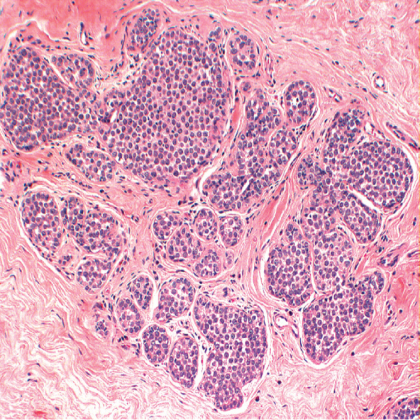
图8 小叶原位癌。
小、圆、松散黏附的单型性细胞充满小叶腺泡并使其扩张。下方的小叶结构完整。
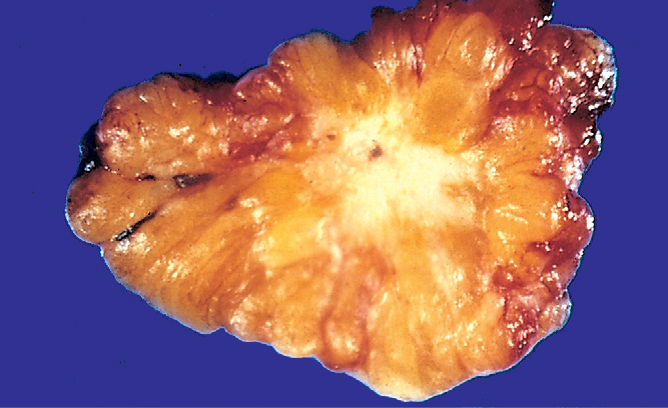
图9 乳腺活检标本中明显的浸润性导管癌。
硬化性纤维性病变浸润周围组织导致组织回缩。
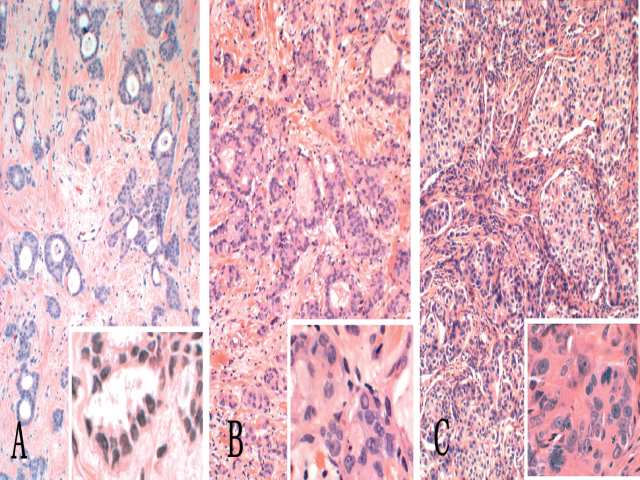
图10 非特殊类型浸润性乳腺癌(插图显示每一肿瘤的高倍图像)。
A、高分化癌,由管状或筛状腺体组成,肿瘤细胞具有较小的、单型性细胞核,间质呈促结缔组织增生性反应;B、中分化癌,显示较少管状结构形成以及更多的实性细胞巢,肿瘤细胞具有多形性;C、低分化癌,由多形性细胞组成的破碎片状结构呈浸润性生长,具有较多的核分裂象和肿瘤坏死区域。
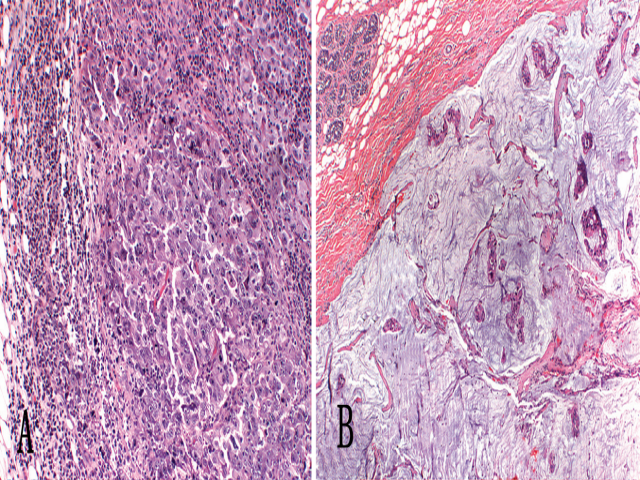
图11 特殊类型乳腺癌。
A、髓样癌,呈高度多形性的肿瘤细胞黏附成片生长,伴有显著的反应性淋巴细胞和浆细胞浸润;B,黏液性(胶样)癌。肿瘤细胞在大的黏液湖中呈小簇状生长。注意特征性界限清楚的边界,与良性肿瘤的表现相似。
临床过程
乳腺癌是由患者或内科医师所发现的看似离散、孤立、无痛以及可移动的肿块。临床检查时,肿瘤常常为2-3cm大小,并且50%的患者已经出现区域淋巴结(腋下最常见)转移。乳腺X线影像学筛查通常可以检测到肿瘤的存在,甚至是可触及之前。乳腺X线影像学筛查所能检测到浸润性癌的平均大小为1cm左右,并且这些肿瘤中仅有15%发生了淋巴结转移。此外,通过筛查,DCIS通常在发展为浸润性癌之前就可以被检测到。随着女性年龄的增长,纤维性乳腺组织被脂肪所取代,这就使得筛查变的更加敏感,这是因为乳腺X射线的透过性增加以及恶性肿瘤的发病率增加。当前存在争议的就是乳腺X线影像学筛查开始的最佳时间,其需要平衡这些女性进行早期癌检测所伴有的射线暴露风险和良性乳腺病变(假阳性)检查相关的发病率及支出之间的利益关系。核磁共振成像(MRI)可以作为乳腺筛查的一种辅助性手段,适用于那些高危型、年轻女性患者乳腺密度增高而乳腺X线摄影又不能发现的病变,但其正处于研究阶段。
乳腺癌可以通过淋巴管和血管转移。外侧四分之一象限和中心部位病变常常首先转移至腋窝淋巴结。那些位于内侧四分之一象限的肿瘤通常首先转移至内侧乳腺动脉沿线淋巴结。更加远处的播散实际上会接踵而来,并且可以累及几乎人体的任何器官和组织。常见的部位包括肺、骨、肝、肾上腺、以及脑(罕见),但是不能除外任何一个部位。原发性病变经过明显治疗控制许多年之后临床上可能会发现转移性病变,有时候可能会长达15年。然而,患者治疗后每过一年且无疾病复发,那么治愈的可能性就会增加。
乳腺癌预后受下列因素影响,其中前三种因素为肿瘤-淋巴结-转移(TNM)分期分类的组成部分:
肿瘤浸润以及大小:原位癌具有较好的预后,5年生存率超过90%;浸润性癌大小<2cm患者5年生存率为87%。
淋巴结转移范围:无腋下淋巴结转移患者5年生存率接近80%;生存率与淋巴结转移数量呈负相关,16个或更多淋巴结转移患者生存率不足50%。前哨淋巴结活检是当前腋下淋巴结分期的主要因素。使用染料或放射性跟踪剂(或有时候两者兼有)标记乳腺组织,然后通过淋巴液回流情况识别初级淋巴结。一旦鉴定存在前哨淋巴结,就应予以切除并进行显微镜下观察。前哨淋巴结无肿瘤转移(阴性淋巴结)则高度提示剩余淋巴结无转移性肿瘤。换句话说,如果前哨淋巴结为“阳性”,则提示进行完整腋窝淋巴结清扫,其也用于患者疾病分期。
远处转移:发生血源性转移患者很难治愈,即使化疗可以延长其生存率(5年生存率大约为15%)。
组织学级别:乳腺癌最常见的分级系统对肿瘤的小管形成、细胞核级别以及核分裂象进行评估。高分化癌较低分化癌具有明显较好的预后。中分化癌最初具有很好的预后,但是20年生存率接近低分化癌。
乳腺癌组织学类型:所有特殊类型乳腺癌(小管癌、髓样癌以及黏液性癌)的预后多少都较非特殊类型乳腺癌(导管癌)要好。炎性癌这种特殊类型除外,因为其预后很差。
雌激素或孕激素受体存在与否:患者存在激素受体预后稍微好些。然而,确定它们存在与否的实际原因是预测患者对治疗的反应。肿瘤细胞均表达雌激素受体(ER)和孕激素受体(PR)患者对抗雌激素治疗(卵巢切除术或他莫西芬)的反应率最高(约80%)。如果仅有雌激素受体阳性,那么患者对抗雌激素治疗的反应率就较低(25%-45%)。如果两者均为阴性,患者对抗雌激素治疗罕见有反应(10%)。
HER2/NEU过表达:这种细胞膜蛋白的过表达几乎都是由基因扩增引起,可以通过免疫组织化学(蛋白水平评估)或荧光原位杂交(基因拷贝数评估)确定。HER2/NEU过表达与不良预后相关。然而,临床检测HER2/NEU的重要性在于预测肿瘤对曲妥珠单抗(赫赛汀,一种单克隆抗体,能够结合并且抑制HER2/NEU的功能)的治疗反应。在针对肿瘤特异性分子病变的有效治疗中,这仍然是最具有特点的例子。
“为什么一些乳腺癌患者在手术治疗后复发而其他一些患者没有”仍然还是一个迷。如前所述,微阵列(基因芯片)乳腺癌基因表达谱确定了乳腺癌的一些分子类别并且也用于了商业化检测,这可以预测每个患者的肿瘤对化疗的反应。当前的这些检测对于预后价值的评估数据尚不充分。
| 乳腺癌 |
美国女性一生发生乳腺癌的风险为1:8。 大多数(75%)乳腺癌发生于50岁之后。 发生乳腺癌的风险包括雌激素暴露、遗传因素、月经初潮至绝经年限延长、非典型增生性病变以及一级亲属的乳腺癌家族史(特别是多发性病变或发生于绝经前女性)。 约10%的乳腺癌由遗传性突变导致,BRCA1和BRCA2基因占单基因突变病例的1/3。 导管原位癌(DCIS)是浸润性导管癌的前驱性病变,常常因乳腺X线影像学检查出现钙化而发现。当女性乳腺癌患者先前有DCIS病史,如果发生癌变则通常为位于同侧乳腺的浸润性导管癌。 小叶原位癌(LCIS)往往为偶然发现并且一般无钙化。当女性乳腺癌患者先前有LCIS病史,如果发生癌变则一般为同侧或另一侧乳腺的浸润性小叶癌,但也可能是浸润性导管癌。 乳腺癌自然病史很长,有时候出现转移可能是最初确诊后十年。 预后主要决定于肿瘤大小、淋巴结转移、远处转移、肿瘤级别以及组织学类型。 雌激素和孕激素受体状态以及HER2/NEU的表达情况主要用来确定对治疗的反应。表达雌激素受体的肿瘤更倾向于 他莫西芬治疗有反应。HER2/NEU过表达肿瘤患者通常采用曲妥珠单抗治疗。
|
5、男性乳腺病变(LESIONS OF THE MALE BREAST)
原始男性乳腺相对很少有病理性改变。在这里仅有两种病变的发生情况较多:男性乳腺发育症和癌。
(1)男性乳腺发育症
与女性一样,男性乳腺也受激素影响,但是较女性乳腺而言,其对激素的敏感性大大下降。然而,可能出现男性乳腺增大(或男性乳腺发育),其是对绝对或相对雌激素增加的一种反应。男性雌激素过多最重要的原因就是肝硬化以及肝脏不能代谢雌激素的结果。其他原因包括Klinefelter综合症、类固醇合成以及一些药物。生理性男性乳腺发育通常发生于青春期和高龄男性。
男性乳腺发育症的形态学特征包括结缔组织的增加以及导管上皮的增生,罕见小叶形成。临床上发生纽扣样乳晕下肿胀,一般为双侧乳腺,但偶尔也可以仅为单侧。
(2)癌
男性乳腺癌罕见,发病率不足所报道女性发病率的1%。常发生于年龄较大的男性。由于男性乳腺组织较少,肿瘤很快就会浸润表面被覆的皮肤以及下方的胸壁。形态学和生物学上,这些肿瘤与发生于女性的浸润性癌相似。不幸的是,当发现这些肿瘤的时候,几乎一半的病例会发生区域淋巴结转移或远处转移。
参考文献:
Vinay Kumar, Abul K. Abbas, Jon C. Aster. Robbins Basic Pathology(第9版),704-714.
至此,《Robbins Basic Pathology》第9版“女性生殖系统”的部分内容编译已经更新完结。感谢这段时间王巍伟老师的辛勤翻译和整理!感谢喜欢这个连载系列的所有读者!华夏病理网会继续为大家提供更多优质文章。
推荐阅读:
连载 | (一)外阴和阴道肿瘤及非肿瘤性病变
连载 | (二)子宫颈肿瘤及非肿瘤性病变
连载 | (三)子宫体肿瘤及非肿瘤性病变
连载 | (四)输卵管和卵巢肿瘤及非肿瘤性病变
连载 | (五)妊娠相关性疾病
连载 | (六)乳腺肿瘤及非肿瘤性病变(1)



















共0条评论