[导读] 编译整理:强子
免疫组化特征
肌上皮肿瘤一般同时表达上皮标记和S-100,但很多病例在免疫组化方面会有变化。具体来说,大部分病例(93%-100%)都会表达广谱CK,但部分病例需加做多种CK检测,如CK-pan、AE1/AE3、CAM5.2。EMA阳性的情况变化更大,表达几率19%-79%不等,但在软组织混合瘤中可以可靠的显示导管上皮。S-100多为阳性,阳性比例72%至100%不等;GFAP阳性仅见于27%-54%的病例。肌上皮肿瘤中,SOX10阳性几率高达80%,但肌上皮癌中阳性较少见(30%)。P63在肌上皮瘤中的阳性率23%-70%,在肌上皮癌中的阳性率7%-40%。肌源性标记的表达情况变化更大,且总体诊断意义不大:最常见阳性的为calponin(90%),其次为SMA(34%-64%)、HHG-35(20%-60%)、desmin(0-20%)。
肌上皮肿瘤中,部分免疫表型与某些形态学或分子特征有相关性。混合瘤中常见PLAG1阳性(58%-100%),与PLAG1基因重排有关;但软组织肌上皮瘤中这一指标为阴性。对于皮肤混合瘤来说,PALG1的表达似乎是大汗腺型肿瘤的特征,但在小汗腺型混合瘤中均为阴性。皮肤合体型肌上皮亚型免疫组化EMA和S-100同时阳性,但CK总体来说是阴性,仅12%的病例会罕见着色。部分肌上皮癌中可见SMARCB1的表达缺失,对应遗传学方面的SMARCB1失活,部分病例可能是EWSR1基因重排所致的功能性缺失。
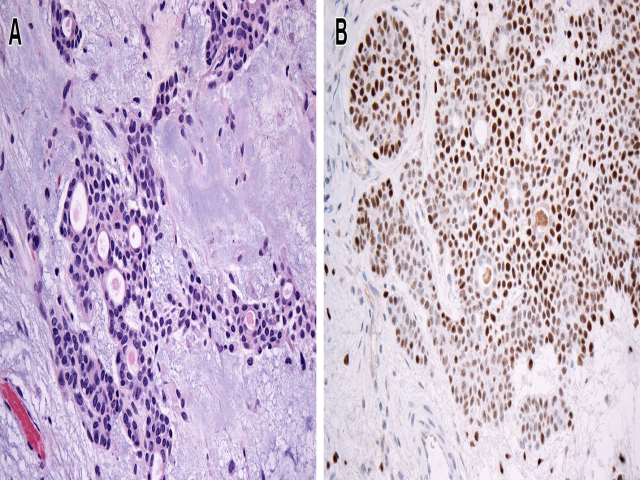
图1. 软组织混合瘤,是指有导管或腺管分化的肌上皮肿瘤(A);常因PLAG1重排而见细胞核表达PLAG1(B),与涎腺多形性腺瘤相似。
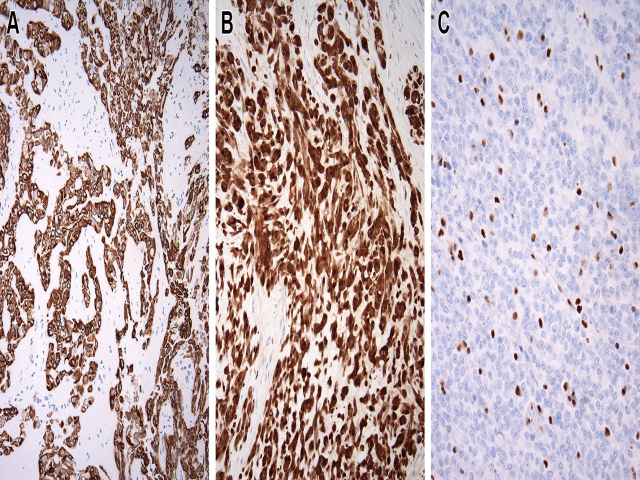
图2. 软组织肌上皮肿瘤大部分会同时表达CK(A)和S-100(B);部分病例会有SMARCB1的表达缺失(C)。
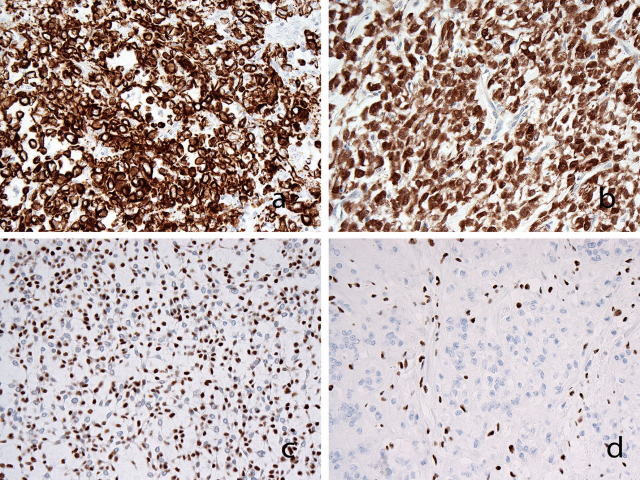
图3. 软组织肌上皮肿瘤免疫组化常见上皮标记CK的阳性(CK-pan,A);S-100常为阳性(B)。GFAP和p63(C)阳性情况相对少见。部分肿瘤中,SMARCB1/INI1表达缺失(D)。
分子特征
以往分子研究表明,部分软组织和涎腺的肌上皮肿瘤在遗传学方面是有相关性的。软组织混合瘤(即前述伴导管上皮分化者)及皮肤软骨样汗管瘤(尤其大汗腺型)均有PLAG1重排,这是涎腺多形性腺瘤和癌在多形性腺瘤中的特征。软组织和涎腺肿瘤中,PLAG1偶见与LIFR融合;涎腺多形性腺瘤和癌在多形性腺瘤中部分病例可见的HMGA2重排,迄今为止尚未见于软组织混合瘤中。不过,有一例大汗腺型软骨样汗管瘤免疫组化HMGA2过表达的报道。
EWSR1基因重排可见于近半数的软组织、皮肤及骨的肌上皮肿瘤;小部分病例为FUS重排而非EWSR1重排。目前为止的最大规模研究中,最常见融合配体为POU5F1、PBX1,各自见于16%的病例;其他已证实的融合配体还有ZNF444、KLF17、ATF1、PBX2。
涎腺原发、具有透明细胞形态的肌上皮癌中,高达39%可见EWSR1重排,但其融合配体尚不明确。PLAG1重排总体来说最常见于涎腺肌上皮癌(至少50%),包括新生的及癌在多形性腺瘤中均是如此;HMGA2融合较为罕见。最常见融合配体为FGFR1(18%)、TGFBR3(15%)。无腺管导管分化的软组织肌上皮瘤和肌上皮癌中,尚未见PLAG1重排。尽管软组织肌上皮肿瘤和部分涎腺肌上皮癌均存在EWSR1的重排,但后者存在PLAG1重排表明它们的起始致病事件可能是不同的。
分子研究已表明,软组织肌上皮肿瘤中有些可能存在基因型和表型之间的相关性,但相关数据还较为有限。伴EWSR1-POU5F1融合的肿瘤多见于年轻患者四肢的深部软组织,组织学为伴透明胞质的上皮样细胞呈巢状生长。伴EWSR1-PBX1融合的肌上皮肿瘤则呈貌似温和的梭形细胞表现,背景为显著硬化性间质。伴EWSR1-PBX3融合的少数肿瘤为梭形或上皮样细胞、在胶原性或黏液样间质中呈束状或巢状排列,常见于骨。此外,皮肤合体样肌上皮瘤总是有EWSR1-PBX3融合。
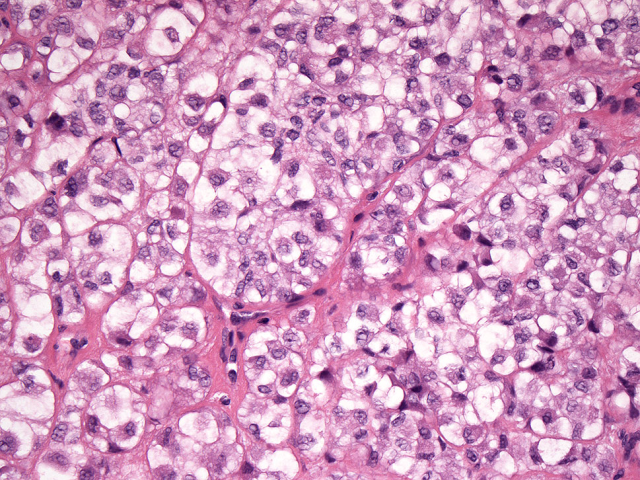
图4. 某些形态学特征似乎与独特的基因融合有关;伴EWSR1-POU5F1融合的肌上皮肿瘤形态学表现为胞质透明的上皮样细胞呈巢状生长。
无EWSR1重排的肌上皮癌中,部分(60%)肿瘤免疫组化会有SMARCB1的表达缺失,这是SMARCB1基因纯合型缺失所致。
——未完待续——
往期回顾:
读文献,学病理-软组织肌上皮肿瘤(一)
读文献,学病理-软组织肌上皮肿瘤(二)

















共0条评论