[导读] 本文作者:李明
一、病史摘要
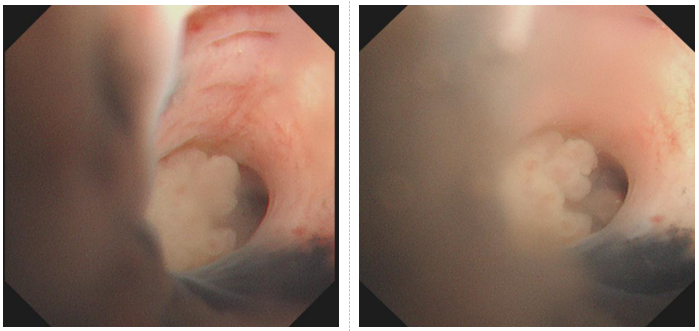
患者,女,69岁,左侧肾上腺结核病史,胸部CT检查所见:右肺上叶前段和左下舌段见散在片状磨玻璃样及斑条带状混杂密度阴影、病灶边界模糊,诊断:右肺上叶前段和左下舌段感染,需要排除肺结核。支气管镜检查所见:右上前段支气管管腔中度狭窄,远端可见不规则新生物,黏膜呈粗糙、桑葚样改变(如图1)。诊断意见:右主支、右上中下支气管结核?右上支气管肿瘤(待病理)?病程中未出现咳嗽、咳痰、咳血等呼吸道症状,无吸烟史。
| 
|
图1.支气管镜下右上支气管内新生物。 |
二、病理检查
1.大体:灰白色针尖大组织4枚。
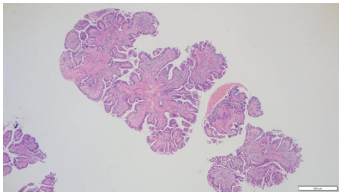
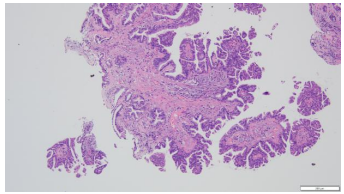
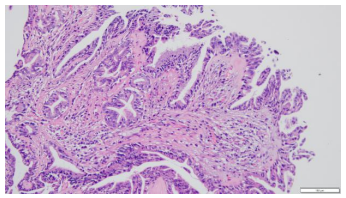
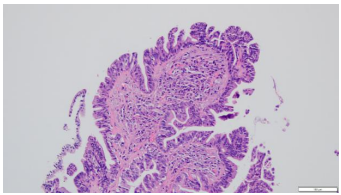
2.镜下表现:宽大的乳头状结构,表面被覆假复层柱状上皮细胞,间质含有纤维血管轴心,乳头下方间质可见玻璃样变,间质内可见腺体,另见淋巴细胞及少许嗜酸性粒细胞浸润。宽大的乳头状结构表面还可见细小乳头状及微乳头状结构形成。高倍镜下柱状上皮细胞核小,圆形,多位于基底,无明显异型性,未见核分裂象。(图2-5)
| 
|
图2.宽大的乳头状结构,含纤维血管轴心(HE4×10) | 图3.乳头表面可见细长乳头状结构及微乳头形成(HE10×10) |
| 
|
图4.间质可有玻璃样变,另可见黏膜下腺体(HE20×10) | 图5.表面被覆柱状上皮细胞,无明显异型性,未见核分裂像(HE20×10) |
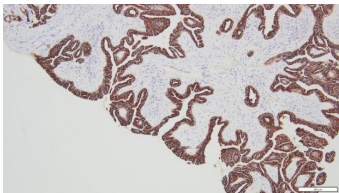
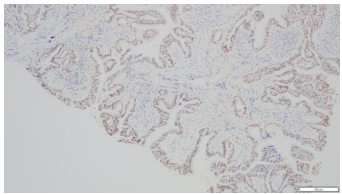
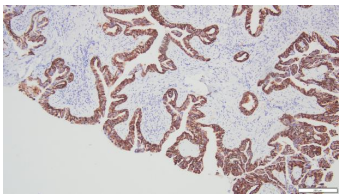
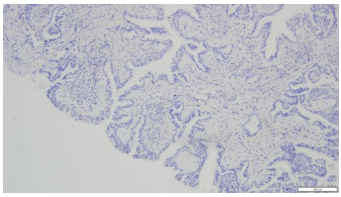
3.病理诊断:(右上支气管)腺性乳头状瘤。免疫组化染色:CK20(-),CK5/6(+),CK7(+),Ki67(LI约5%),Napsin A(-),P40(基底层+),TTF-1(+)。(图6-11)
| 
|
图6.CK7(10×10) | 图7.TTF-1(10×10) |
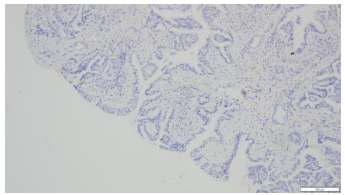
| 
|
图8.NapsinA(10×10) | 图9.CK5/6(10×10) |
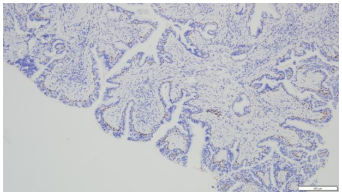 | 
|
图10.P40(10×10) | 图11.CK20(10×10) |
三、讨论
1.病例总结:该病例在初诊过程中发现肿瘤镜下呈乳头状结构,乳头表面衬覆柱状上皮细胞,间质具有纤维血管轴心,初步考虑乳头状瘤,进而进行相关免疫组化染色,结果显示肿瘤表面被覆上皮细胞CK7、CK5/6、TTF-1阳性,NapsinA、P40、CK20阴性;P40非常明显的标记出被覆上皮下方连续的基底层细胞。结合形态学及免疫组化结果,诊断为腺性乳头状瘤。但CK5/6在肿瘤表面被覆上皮阳性表达,并且同一切片中的对照组织的CK5/6表达良好,证实并非是假阳性,有点出乎意料。通常而言CK5/6是鳞状上皮细胞常见标志物,腺上皮几乎不表达,而本例中CK7、CK5/6、TTF-1同时表达了,提示肿瘤上皮并非单纯腺上皮?从形态学上观察,肿瘤被覆上皮为假复层柱状上皮,部分可见纤毛,细胞核多位于基底,倾向为腺上皮形态特征,但在免疫学上却也具有鳞状上皮特征。查阅相关文献,推测可能原因为由基底细胞分化而来的这些柱状上皮细胞保留了一部分干细胞性质[1]。因此最终病理诊断为腺性乳头状瘤,患者预后及随访结果待回报。
2.文献回顾:腺性乳头状瘤(glandular papilloma,GP)是非常罕见的肺上皮性良性肿瘤,它与鳞状细胞乳头状瘤、混合性鳞状细胞和腺性乳头状瘤(腺鳞混合型乳头状瘤,mixed squamous cell and glandular papilloma,MSGP)同属乳头状瘤,根据文献报道[2]其每年的发病率约十万分之3.95,而这三种乳头状瘤中,腺性乳头状瘤的发病率是最低[3]的、最罕见的,包括发生于支气管内和肺实质内(孤立性周围型纤毛腺性乳头状瘤,solitary peripheral ciliated glandular papilloma,SPCGP)的病变,国内外文献报道的GP/SPCGP可能只有二十多例。
在临床上,该肿瘤多发生于老年人,性别及吸烟史无特殊,临床表现上,若病变位于支气管内时,多表现为持续性的咳嗽、咳痰;若发生于周围肺实质,多数没有明显症状,偶然发现居多。实验室检查无特殊,血清肿瘤标志物处于正常范围。CT下呈实性结节或混杂密度结节。支气管镜下,表现为息肉样的肿物。大部分病例,肿瘤生长缓慢,但也有报道2年内病灶由0.3cm进展到1.7cm[4],但未发生恶变。治疗上多以局部切除为主。无复发及恶性转化病例报道。
在病理上,该肿瘤直径约1-2cm,镜下表现主要为具有纤维血管轴心的乳头状结构,表面被覆有纤毛或无纤毛的柱状上皮,下方可见连续的基底细胞,无细胞和组织异型性。特殊的病理表现主要包括:①肿瘤间质可出现玻璃样变或黏液样变性[5],②肺内病灶肿瘤向细小支气管腔内或肺泡腔内生长,并且腔内可见黏液分泌。免疫组化:肿瘤表面上皮CK7、TTF-1阳性,NapsinA阴性。基底细胞表达P40、TTF-1、CK5/6。分子病理:该肿瘤不伴有HPV感染。可伴有KRAS、BRAF v600E、AKT1基因突变[6]。
在鉴别诊断上,GP除了与原发或转移性腺癌以及其他类型乳头状瘤鉴别外,需要特别注意在周围肺组织内的GP与细支气管腺瘤(bronchiolar adenoma,BA)的鉴别。因为有研究表示GP/MSGP与BA具有相似的组织学及免疫组化特征,且基因突变也具有相似处(均检测出BRAF基因突变),认为GP/MSGP与BA可能是同一谱系的病变[7]。对此观点,也有研究表示两者是不同的[6],在该项研究中的所有的GP/MSGP均表现出AKT1基因突变,而平坦为主型BA(flat-predominant BA)没有AKT1基因突变,并且两者在形态学上也有细微的差别,例如肿瘤上皮的厚度,GP/MSGP往往大于BA,前者是后者的3-5倍。另外伴有乳头、微乳头状结构形成的乳头状结构为主型BA(papillary-predominant BA),同样可以检测出AKT1基因突变,同时还指出AKT1基因突变也见于其他良性肿瘤,例如乳腺导管内乳头状瘤、唾液腺导管内乳头状黏液性肿瘤、乳头状囊腺瘤。该研究团队认为这或许表明AKT1基因突变可能与乳头状结构有相关性。
总结起来,大致可以得出以下几点结论:①GP分为腺性乳头状瘤(支气管内)和周围纤毛型腺性乳头状瘤(周围肺组织内)两种,诊断时根据病变部位进行区分;②GP与MSGP,同属良性的乳头状瘤,在形态学和免疫组化上有相似的特征,并且基因突变类型形似,但从病例报道上看,GP没有恶性转化、复发的情况,而MSGP可能出现恶变,诊断时候需要慎重,应对标本完整取材,仔细观察肿瘤表面上皮中是否夹杂鳞状上皮岛,有无角化现象;③诊断周围纤毛型腺性乳头状瘤时候,需要考虑与BA的鉴别,这两种病变之间的关系仍不完全明确,AKT1基因突变可能是鉴别两者的关键。
参考文献
[1] Lin DL, Xing XM, Ran WW, et al. Pulmonary peripheral glandular papilloma and mixed squamous cell and glandular papilloma frequently harbour the BRAF V600E mutation. Histopathology. 2020 Jun;76(7):997-1004.
[2]Kosmidis M, Rodriguez R, Nierhoff N, et al. A rare cause of chronic cough: solitary glandular papilloma of the lung. Clin Respir J. 2015 Oct;9(4):487-8.
[3]Kaseda K, Horio H, Harada M, et al. Solitary glandular papilloma of the peripheral lung: a report of two cases. World J Surg Oncol. 2014 May 19;12:149.
[4] Suzuki S, Goto T, Emoto K, et al. Rapidly growing glandular papilloma associated with mucus production: a case report. World J Surg Oncol. 2014 May 22;12:160.
[5] Wu CW, Chen A, Huang TW. Diagnosis and management of glandular papilloma of lung: A case report. World J Clin Cases. 2020 Mar 26;8(6):1104-1107.
[6] Sasaki E, Masago K, Fujita S, et al. AKT1 Mutations in Peripheral Bronchiolar Papilloma: Glandular Papilloma and Mixed Squamous Cell and Glandular Papilloma Is Distinct From Bronchiolar Adenoma. Am J Surg Pathol. 2021 Jan;45(1):119-126.
[7]王蓓,杨磊,林洁,等.细支气管腺瘤与混合性鳞状细胞和腺性乳头状瘤临床病理特征比较分析[J].中华病理学杂志,2021,50(5):458-464.

























共0条评论