[导读] 译者:薛德彬
6. 骨髓异常增生性/骨髓增生性肿瘤
骨髓异常增生性/骨髓增生性肿瘤(MDS/MPN)的定义是MDS和MPN的病理特征和分子特征重叠,临床上通常表现为血细胞减少和细胞增多的各种组合。血细胞减少的定义与MDS相同。WHO-HAEM5包括对慢性粒-单核细胞白血病(CMML)诊断标准的重大修订以及其他MDS/MPN类型的术语更改(表5)。
6.1 CMML的诊断标准、亚型和基于原始细胞的亚组标准反映了诊断细化,强调统一特征
MDS/MPN原型和最常见疾病是CMML,其特征是持续的外周血单核细胞增多症和涉及多个基因(表观遗传调节、剪接体和信号转导)的各种体细胞性突变的组合。诊断标准经过修订,包括先决条件和支持标准(表6)。
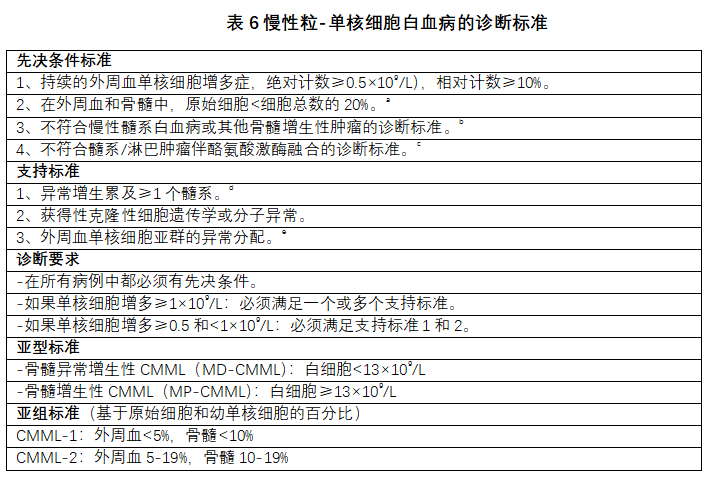
a 原始细胞和等同原始细胞包括原粒细胞、原单核细胞和幼单核细胞。b 骨髓增生性肿瘤(MPN)在发病时或病程中可伴有单核细胞增多症;这种病例可以貌似CMML。在这些情况下,MPN病史可排除CMML。骨髓中存在MPN特征和/或MPN相关突变的高负荷(JAK2、CALR或MPL)倾向于支持MPN伴单核细胞增多症,而不是CMML。c 嗜酸性粒细胞增多患者,特别要排除髓系/淋巴肿瘤伴酪氨酸激酶融合的标准。d 一个骨髓细胞系中,≥10%的细胞应出现形态学异常增生。e 在没有已知活动性自身免疫疾病和/或全身炎症综合征的情况下,检测到增多的经典型单核细胞(>94%)。
第一个先决条件是持续的外周血单核细胞增多症:绝对计数≥0.5×109/L,且相对计数≥10%。也就是说,绝对计数的临界值从1.0×109/L降低到0.5×109/L,以纳入以前称为单核细胞少的CMML病例[45-47]。绝对计数介于≥0.5×109/L和<1.0×109/L之间时,为了提高诊断准确性,需要检测至少一个谱系中的一种或多种克隆的细胞遗传学或分子异常,并记录异常增生。引入了外周血单核细胞亚群的异常分配,并作为新的支持标准[48,49]。需要更多的研究来确定对不符合CMML新诊断标准的原因不明的克隆性单核细胞增多症患者进行分类的最佳方法[50]。
基于白细胞,目前已正式认可两种具有显著临床和遗传特征的疾病亚型:骨髓异常增生性CMML(MD-CMML)(白细胞<13×109/L)和骨髓增生性CMML(MP-CMML)(WBC)≥13×109/L)。MP-CMML通常伴有激活RAS途径突变和不良临床结果[51]。鉴于有证据表明,第4版中引入的CMML-0(血液中原始细胞<2%和骨髓原始细胞<5%)没有或仅有很少预后意义[52,53],WHO-HAEM5删除了基于原始细胞的CMML-0亚组。
6.2非典型慢性髓系白血病被重新命名为MDS/MPN伴中性粒细胞增多症,以及其他术语更新
其他MDS/MPN类型的诊断标准基本不变。MDS/MPN伴中性粒细胞增多(MDS/MPN-N)一词取代了非典型慢性髓系白血病(aCML)一词。这种变化强调了该疾病为MDS/MPN性质,避免与CML混淆。基于SF3B1突变重新定义了MDS/MPN伴环形铁粒幼细胞和血小板增多(MDS/MPN-RS-T),并将其重新命名为MDS/MPN伴SF3B1突变和血小板增多(MDS/MPN-SF3B1-T)。MDS/MPN-RS-T予以保留,作为一个可接受的术语,用于野生型SF3B1和≥15%环形铁粒幼细胞的病例。MDS/MPN无法分类(MDS/MPN-U)现在称为MDS/MPN非特指(MDS/MPN-NOS);这是为了从整个分类中统一地删除自相矛盾的限定词“无法分类(unclassifiable)”。
小结
• CMML诊断标准经历了重大修订,包括降低单核细胞增多绝对计数的临界值,采用MD-CMML和MP-CMML亚型,以及删除CMML-0。
• 非典型慢性髓系白血病更名为MDS/MPN伴中性粒细胞增多(MDS/MPN-N)。
• 根据SF3B1突变,MDS/MPN伴环形铁粒幼细胞和血小板增多(MDS/MPN-RS-T)被重新定义,并改名为MDS/MPN伴SF3B1突变和血小板增多(MDS/MPN-SF3B1-T)。
7.急性髓系白血病
7.1增强的分组框架形成了可扩展的遗传学分类,并在相关情况下削弱原始细胞计数的重要性
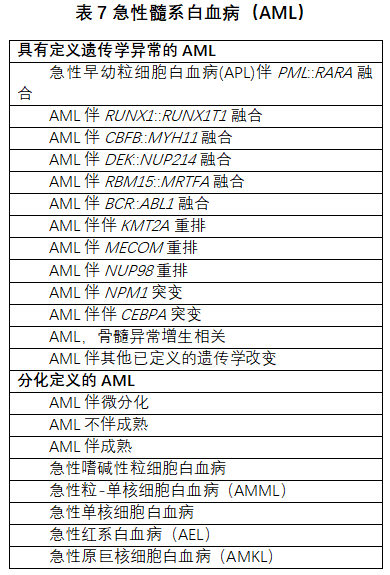
对急性髓系白血病(Acute myeloid leukaemia,AML)的分类进行了重新设想,以强调过去几年在如何理解和管理该疾病方面取得的重大突破。首先,区分具有定义遗传学异常的AML与分化定义的AML(表7)。后者消除了之前造成混淆的术语AML NOS,列出根据分化的类型。如上所述,另一个关键变化:具有定义遗传学异常的AML类型(除外具有BCR::ABL1融合的AML和具有CEBPA突变的AML),删除了20%原始细胞要求。删除原始细胞阈值需要结合形态学和分子遗传学,以确保定义遗传学异常是疾病病理学的驱动因素。现认为这种方法比指定主观的骨髓原始细胞较低的阈值更合适。新分类结构的第三个重点是增加一节,关于AML伴其他已定义的遗传学改变,这样,新的和/或少见的AML亚型在未来的分类版本中可能会(也可能不会)成为定义明确的类型,可以酌情插入分类结构中。因此,整体AML分类结构继续强调临床、分子/遗传学和病理参数的整合,并强调临床病理判断。
7.2具有定义遗传学异常的AML
WHO-HAEM5保留了许多已确立的AML的诊断标准,包括APL伴PML::RARA、AML伴RUNX1::RUNX1T1和AML伴CBF::MYH11,但提高了对高度敏感的可测量残留病(MRD,第4版称为微小残留疾病)评估技术重要性的认识,同时发生的分子改变的影响反映了当前实践中影响患者管理和治疗决定的因素。也就是说,预后因素已从仍然相关的KIT突变扩展到包括其他细胞遗传学特征和诱导后MRD状态。AML伴DEK::NUP214和AML伴RBM15::MRTFA的诊断标准也基本保持不变。
AML伴BCR::ABL1和AML伴CEBPA突变是仅有的需要至少20%原始细胞进行诊断的、具有已定义的遗传学异常的疾病类型。需要原始细胞阈值,以避免与CML重叠。区分AML伴BCR::ABL1与CML最初髓系原始细胞期,可能具有挑战性,仍然需要更多的证据来更好地描述这种AML类型。没有足够的数据支持AML伴CEBPA突变的原始细胞阈值标准需要任何修改[54,55]。
认可了三种具有特征性重排的AML类型,分别涉及KMT2A、MECOM和NUP98。根据研究,原始细胞计数低于20%是可以接受的。研究表明,原始细胞(MDS)<20%和携带任何上述重排的患者,具有与原始细胞计数较高的患者相似的临床特征。值得注意的是,涉及这三个基因的重排,特别是NUP98,在常规核型分析中可能是隐蔽的。
AML伴KMT2A重排是个新术语,代替了“AML伴t(9;11)(p22;q23);KMT2A-MLLT3”。已经描述了80多个KMT2A融合伙伴基因,其中MLLT3、AFDN、ELL和MLLT10最常见。虽然诊断时不需要,但最好能识别融合伙伴基因,因为可以提供预后信息,并可能影响疾病监测。成年患者通常表现为高原始细胞计数,通常为单核细胞分化。特别是在儿童中,AML伴KMT2A::MLLT3和KMT2A::MLLT10在骨髓涂片中显示原巨核细胞分化和/或低原始细胞计数。
突变定义的AML包括AML伴NPM1突变和AML伴CEBPA突变。无论原始细胞计数如何,都可以诊断AML伴NPM1突变,但再次强调临床病理相结合是明智的。这种方法与以下数据一致:先前被归类为MDS或MDS/MPN伴NPM1突变的病例,在短时间内进展为AML。获得NPM1突变的CH患者也有类似的数据。AML伴CEBPA突变的定义已改变为包括双等位基因(biCEBPA)以及位于基因碱性亮氨酸拉链(bZIP)区域的单突变(smbZIP-CEBPA)。在<70岁成人的儿童和研究队列中,已证明smbZIP-CEBPA与良好预后的相关性。AML中的RUNX1突变与非常广泛的定义分子特征重叠,已确定其缺乏足够的特异性来定义独立的AML类型。
以前称为AML伴骨髓异常增生相关改变(AML-MRC)的实体,现在称为“AML,骨髓异常增生相关(AML-MR)”。这种AML类型定义为具有以下特征:≥20%的原始细胞表达髓系免疫表型;含有与MDS相关的特异性细胞遗传学异常和分子异常;从头发生,或在已知MDS或MDS/MPN病史之后发生。主要变化包括:(1)删除了只用形态学作为诊断AML-MR的前提;(2)定义细胞遗传学标准的更新;(3)引入一组包括8个基因的基于突变的定义——SRSF2、SF3B1、U2AF1、ZRSR2、ASXL1、EZH2、BCOR、STAG2,其中95%以上的突变是MDS后或MDS/MPN后AML所特有[56,57]。诊断AML-MR需要存在表8中列出的一种或多种细胞遗传学异常或分子异常,和/或MDS或MDS/MPN病史。 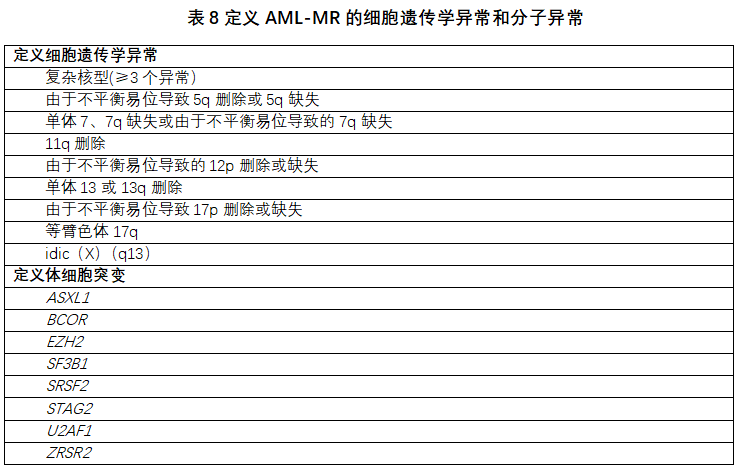
AML伴其他已定义的遗传学改变的代表了新发现的、通常罕见的新实体的着陆点,这些实体的识别有助于确定它们是否可能在未来版本中构成不同的类型。目前,该标题下的亚型包括AML伴罕见的基因融合。
--未完待续--
往期回顾:
血液淋巴肿瘤WHO分类第5版:髓系和组织细胞/树突细胞肿瘤 (1)
血液淋巴肿瘤WHO分类第5版:髓系和组织细胞/树突细胞肿瘤 (2)

















共0条评论