[导读] 译者:薛德彬
《淋巴造血肿瘤WHO分类》第5版(WHO-HAEM5)即将出版,本文对此进行概述,重点是髓系和组织细胞/树突细胞肿瘤的分类方案,并概述了与第4版相比所作更改的原则和基本原因。淋巴肿瘤已单独撰文介绍。WHO分类丛书致力于对各种器官系统发生的人类癌症进行分级分类。疾病类型的定义和诊断仍然基于多种临床病理参数,但也重视诊断标准的完善和对治疗和/或预测有实用价值的生物标记物。在尽可能寻找定义疾病的遗传学基础的同时,WHO分类力求在全球范围内保持实用性。最终形成了组织细胞/树突细胞肿瘤的基于分子生物学的增强、当代、循证分类,并形成了一种开放的组织结构,以便随着新发现不断为未来版本提供信息并扩充内容。
文献来源:The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Myeloid and Histiocytic/ Dendritic Neoplasms. Leukemia;https://doi.org/10.1038/s41375-022-01613-1
1. 引言
WHO肿瘤分类是对各种器官系统内发生的癌症进行循证分类。它是全世界诊断、研究、癌症登记和公共健康监测的标准。自60多年前开始分类以来,WHO分类丛书第5版首次开发了一种统一的关系数据库框架内,以涵盖整个人类癌症。每个器官系统和跨卷(蓝皮书)的肿瘤在这个新的框架内按照分类学原则和一组不可协商的原则进行分层分类,包括过程透明度、书目严谨性和避免偏见[1,2]。第5版的开发由编辑委员会监督,该委员会包括常务成员—来自世界各地主要医疗和科学组织的代表,他们监督整个丛书,此外还任命了专家成员,以发挥其领导作用,并提供与特定分册相关的同期专业知识[3]。反过来,编委会通过知情的文献计量过程确定作者,重点是广泛的地理代表性和多学科专业知识。通过设计,多学科作者/编辑组(共420名贡献者)共享疾病类别的重叠覆盖,以确保概念的连续性和内容的协调。这种方法反映了分类的实施方式,具有多学科输入,强调从诊断到疾病监测的患者管理的整体方法。
本文旨在概述WHO-HAEM5中髓系和组织细胞/树突细胞肿瘤分类。血液淋巴分类的最新版可追溯到2008年,并于2017年修订。淋巴肿瘤的概述见配套文章[4]。
WHO-HAEM5中,分类结构遵循基于谱系(分化细胞系)的框架,包括从良性到恶性的宽泛大类,并向下分支到类别、家族、类型(疾病/肿瘤)和亚型。在可能的情况下,系统地应用三个属性,即,谱系属性+主要临床属性+主要生物属性。谱系属性取决于流式细胞术和/或免疫组织化学的免疫分型。主要临床属性是未经治疗疾病的一般特征,包括一些描述,如:急性、慢性、血细胞减少(骨髓异常增生)和血细胞增多(骨髓增生)。主要生物学属性包括基因融合、重排和突变。当两个相关基因的都需要鉴定,或通常需要理想的诊断标准时,融合就成为类型/亚型命名法的一部分,例如PML::RARA。重排是一个广泛的术语,包括导致基因融合的一系列结构基因组改变,当生物学显性基因(例如KMT2A)有多个可能的融合伙伴基因时,重排是类型/亚型命名法的一部分。值得注意的是,由于重排一词在第4版中广泛使用,因此在分类中保留了重排一词,尽管人们认识到它更适合于由各种片段组成的基因(例如免疫球蛋白基因和T细胞受体基因)中的基因组修饰。在可能的情况下,我们努力根据定义遗传学异常(defining genetic abnormalities)来优先分类肿瘤类型。
根据其他已定义的(defined)遗传学改变的新准则,新出现的实体被列为疾病亚型。随着高通量分子诊断工具越来越广泛使用,这被视为分类中的一个着陆点,以纳入新的/罕见的实体,其识别率正在增加。这种方法取代了对此类实体的临时地位分配。人们认识到,这种亚型的诊断可能并不适用于所有实践环境。通过了一套决策支持指南,以帮助确定在这种情况下哪些亚型符合条件;它们包括:(1)由既定的致癌机制驱动,具有独特的分子或细胞遗传学特征;(2)不符合其他具有定义遗传学异常的肿瘤类型的亚型标准;(3)具有明显的病理和临床特征,包括但不限于对治疗干预的反应;(4)不同研究小组至少发表了两份高质量的同行评审出版物。
WHO-HAEM5的应用是基于形态学(细胞学和组织学)、免疫表型、分子和细胞遗传学数据的综合考虑。这与第4版一致,并且分子定义的疾病类型和亚型数量有所增加。希望WHO-HAEM5的基因基础将促进提供卫生资源,以确保提供必要的基因检测平台,充分挖掘WHO-HAEM5的潜力。尽管如此,全面公布的分类将包括具有最广泛适用性的基本诊断标准清单,特别是在资源有限的环境中。对更广泛适用性的进一步帮助是改进了分类的层次结构,这允许在详细的分子遗传分析可能无法实现时恢复到家族(类)级定义;蓝皮书引言进一步阐述了这种方法。
与WHO第5版丛书的其余分册一致,髓系和组织细胞/树突细胞肿瘤的分类遵循人类基因组器官基因命名委员会的建议,包括使用双冒号(::)表示基因融合[5]。
2. 克隆性造血
克隆性造血(Clonal haematopoiesis,CH)泛指在没有不明原因的血细胞减少、血液肿瘤或其他克隆性疾病的情况下,存在来自突变的多能干/祖细胞的细胞群,这些细胞群具有选择性生长优势。CH的发病率随着年龄的增长而增加[6]。自第4版分类以来,在理解CH的分子遗传学和公共卫生意义方面取得了重大进展,包括认识到其与总死亡率增加、心血管疾病和髓系恶性肿瘤的相关性。更具体的新发现的相关性,例如导致特征性VEXAS(空泡、E1酶、X-连锁、自身炎症、体细胞UBA1突变)综合征[7]的相关性,代表了炎症与CH/髓系肿瘤之间相互作用,正在逐渐被发现。将CH纳入WHO-HAEM5,代表了定义和编码此类髓系前体病变的关键性首次努力。
在WHO-HAEM5中,不确定潜能的克隆性造血(CHIP)被定义为WHO分类中的一个术语,具体指在未诊断过血液病或原因不明的血细胞减少的个体中,CH伴有髓系恶性肿瘤相关基因的体细胞突变,即,血液或骨髓检测到变异等位基因分数(VAF)≥2%(在男性,X连锁基因突变率≥4%)[8]。(补充数据表S1)检测到更低水平VAF有何意义,目前尚不清楚。
意义不明的克隆性血细胞减少(CCUS)是指在具有一种或多种持续性血细胞减少的情况下检测到CHIP,这些持续性血细胞减少不能用血液学或非血液学疾病来解释,并且不符合已定义的髓系肿瘤的诊断标准。CCUS、MDS和MDS/MPN的细胞减少定义是一致的;其中包括贫血(男性Hb<13 g/dL,女性Hb<12 g/dL),白细胞减少(中性粒细胞绝对计数<1.8×109/L)和血小板减少(血小板<150×109/L)[9]。
小结
• CH视为一种前驱髓系疾病状态。
• CHIP和CCUS是正式的定义。
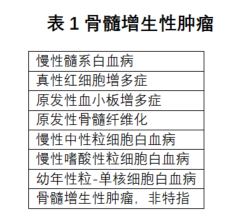
3. 骨髓增生性肿瘤
骨髓增生性肿瘤(Myeloproliferative neoplasm,MPN)见表1。与第4版相比,主要类型基本保持不变。MPN的初始诊断评估仍然取决于临床特征、分子诊断和骨髓环钻活检的形态学评估之间的密切结合。大多数MPN患者被诊断为慢性期(CP),该期可能进展为伴有继发性细胞遗传学和/或分子畸变的累积的急变期(BP)。
3.1慢性髓系白血病的危险因素得到了细化,不再需要加速期
慢性髓系白血病(Chronic myeloid leukaemia,CML)定义为t(9;22)(q34;q11)导致的BCR::ABL1融合。在引入靶向酪氨酸激酶抑制剂(TKI)之前,未经治疗的CML的自然病程是双相或三相的:最初的惰性CP,然后是急变期(BP),有或没有中间的加速期(AP)。通过TKI治疗和仔细的疾病监测,进展为晚期疾病的发病率降低,CML的10年总生存率为80-90%[10,11]。因此,AP的命名变得不太相关,ABL1激酶突变和/或额外的细胞遗传学异常和BP进展引起的耐药性代表了关键的疾病属性[12,13]。因此,WHO-HAEM5中省略了AP,以强调与CP进展和TKI耐药性相关的高危特征。BP的标准包括:(1)血液或骨髓中≥20%的骨髓原始细胞;或(2)出现原始细胞的髓外增生;或(3)外周血或骨髓中出现淋巴母细胞增多。淋巴母细胞的最佳界限值和低水平B淋巴母细胞的意义尚不清楚,需要进一步研究。
3.2 BCR::ABL1阴性骨髓增生性肿瘤的诊断标准有微小变化
WHO-HAEM5仍然强调使用第4版建立的诊断标准来区分真性红细胞增多症(Polycythaemia vera,PV)、原发性血小板增多症(Essential thrombocythaemia,ET)和原发性骨髓纤维化(Primary myelofibrosis,PMF),但略有改进。这些类型之间的区别是基于将外周血结果与分子数据和骨髓形态学评估结果相结合,因为这些参数都不能单独提供足够的诊断特异性。
PV诊断的主要诊断标准包括升高的Hb浓度和/或红细胞压积,伴有三系增生(全髓系增生)、骨髓中有多形性成熟巨核细胞,以及NM_004972:JAK2 p.V617F或JAK2外显子12突变。由于用51Cr标记的红细胞测定红细胞质量增加在常规临床实践中已不常见,因此将其从诊断标准中删除。ET的诊断标准已经很好地确立,没有改变。
PMF的特征是骨髓中存在异常巨核细胞和粒细胞的增殖,在纤维化阶段伴有成纤维细胞的多克隆性增多,而这种成纤维细胞驱动了继发性网状纤维性和/或胶原性骨髓纤维化、骨硬化和髓外造血。识别纤维化发生之前的PMF仍然有必要区分ET和PV以及纤维化期PMF[14]。使用可重复的和标准化的诊断标准对骨髓纤维化和脾脏大小进行连续监测仍然重要,尤其是对于接受JAK1/2抑制剂治疗的患者。在少数病例中,PV和ET进展至AP(10-19%原始细胞)和BP(≥20%原始细胞),但在PMF中白血病转化更为频繁,与纤维化发生之前的PMF相比,纤维化期PMF患者的无白血病生存期较短[15,16]。
JAK2、CALR和MPL突变被认为是驱动事件,但在超过一半的MPN患者中发现了其他基因的突变,特别是TET2、ASXL1和DNMT3A。影响剪接调节因子(SRSF2、SF3B1、U2AF1、ZRSR2)和染色质结构、表观遗传功能和细胞信号传导的其他调节因子(例如EZH2、IDH1、IDH2、CBL、KRAS、NRAS、STAG2、TP53)的突变较少见。与PV和ET相比,这些额外的突变在PMF和晚期疾病中更常见,并且已发现其中一些与较差的预后风险相关(例如,PMF中的EZH2、IDH1、IDH2、SRSF2、U2AF1和ASXL1突变)。
慢性中性粒细胞白血病(Chronic neutrophilic leukaemia,CNL)是一种BCR::ABL1阴性的MPN,其特征是持续的外周血中性粒细胞增多(白细胞计数≥25×109/L,且杆状核和分叶核中性粒细胞≥80%),由于中性粒细胞增殖引起骨髓细胞量增多和肝脾肿大。CNL常见CSF3R突变,见于60%以上的病例[17,18]。
慢性嗜酸性粒细胞白血病(Chronic eosinophilic leukaemia,CEL)是一种多系统疾病,其特征是形态异常的嗜酸性粒细胞和嗜酸性粒细胞前体呈持续的克隆增殖,导致血液和骨髓中持续的嗜酸性粒细胞增多[19-21]。
CEL诊断标准有几个变化:(1)定义持续性嗜酸性粒细胞增多所需的时间间隔从6个月缩短到4周;(2)增加了克隆性和异常骨髓形态的要求(例如巨核细胞性异常增生或红系异常增生);(3)删除了增多的原始细胞(外周血≥2%或骨髓5-19%)作为克隆性的替代品。这些标准改善了CEL与某些实体(例如特发性嗜酸性粒细胞增多综合征和意义不明的嗜酸性粒细胞增多)的区分[22]。由于CEL的标准及其相对于其他嗜酸性粒细胞增多疾病的位置已得到很好的描述,因此不再需要限定词“非特指”,并已从名称中删除。
与第4版一样,MPN非特指(MPN-NOS)的名称应保留用于具有MPN临床、实验室、形态学和分子特征,但缺乏任何特定MPN类型的诊断标准或具有不同MPN类型重叠特征的病例。
3.3 幼年性粒-单核细胞白血病视为幼儿的骨髓增生性肿瘤,常伴有种系致病基因变异
幼年性粒-单核细胞白血病(Juvenile myelomonocytic leukaemia,JMML)是幼儿的造血干细胞起源的骨髓增生性肿瘤。至少90%病例的发病机制涉及未经检查的RAS通路激活。可以通过结合临床、实验室和分子标准来诊断JMML。诊断标准的更新包括:(1)排除KMT2A重排;(2)删除单体7作为细胞遗传学标准;(3)强调诊断性分子研究的重要性,特别是那些旨在证明RAS通路激活的研究。JMML的遗传背景在风险分层和治疗方法中起着重要作用,由涉及PTPN11的体细胞突变和1型神经纤维瘤病相关的种系致病性变异引起的病例是侵袭性最强的类型,而与致病性种系CBL变异相关的一些病例偶尔会自发缓解。将JMML纳入MPN反映了其分子发病机制,并且强调,没有迹象表明JMML是真正的骨髓异常增生性肿瘤。
小结
• CML期合并为慢性期和急变期,重点是慢性期的风险特征。
• 更新了CEL的诊断标准,省略了限定词NOS。
• JMML归入骨髓增生性肿瘤。
——未完待续——














共0条评论