[导读] 译者:薛德彬
4. 肥大细胞增多症
肥大细胞增多症(Mastocytosis)包括一些罕见的异质性肿瘤,其特征是异常肥大细胞在各种器官或组织中积聚,通常由KIT受体的组成性激活所驱动。肥大细胞增多症的病理学复杂,临床特征变化多端,并可能受到合并症的影响。重要的合并症包括IgE依赖性过敏、维生素D缺乏和精神病、心理或精神问题。WHO-HAEM5继续认可三种疾病类型:系统性肥大细胞增多症(Systemic mastocytosis,SM)、皮肤肥大细胞增多症(Cutaneous mastocytosis,CM)和肥大细胞肉瘤(Mast cell sarcoma,MCS)[23](表2)

注:高分化系统性肥大细胞增多症(WDSM)是一种形态学变异,可能发生在任何SM类型/亚型中,包括肥大细胞白血病。
90%以上的SM患者检测到KIT基因第816密码子的体细胞性点突变。其他罕见的激活性KIT改变包括细胞外(例如,外显子8上的密码子419或外显子9中的A502_Y503dup缺失)、跨膜(例如,NM_000222:KITp.F522C)或膜旁(例如,NM_000222:KITp.V560G)结构域的突变,在晚期SM病例中检出率<1%,但在惰性SM病例中更常见。大多数晚期SM和NM_000222:KITp.D816V患者有额外的体细胞突变,最常见的是TET2、SRSF2、ASXL1、RUNX1和JAK2。这些患者可能检测到并发的血液学(通常是髓系)肿瘤[24]。
SM的诊断标准已修改。也就是说,CD30的表达和任何导致配体非依赖性激活的KIT突变的存在已被接受为次要诊断标准。基础血清类胰蛋白酶水平>20 ng/ml,在遗传性α类胰蛋白酶血症的情况下应进行调整,这是一个次要诊断标准[25]。此外,骨髓肥大细胞增多症现在是SM的一个单独亚型,其特征是没有皮肤病变和B发现,基础血清类胰蛋白酶低于125ng/ml。经典的B发现(“疾病负载”)和C发现(“需要血血细胞减少”)已作轻微调整。最值得注意的是,NM_000222:KIT p.D816V突变与骨髓细胞或外周血白细胞中VAF≥10%定义为B发现。
WHO-HAEM5认可高分化系统性肥大细胞增多症(WDSM),是任何SM亚型中都可以发生的一种形态学模式,其特征是圆形和有典型颗粒的肥大细胞通常严重浸润骨髓。在大多数WDSM患者中,未检测到KIT密码子816突变,肿瘤性肥大细胞通常对CD25和CD2呈阴性,但对CD30呈阳性[26]。
小结
• 肥大细胞增多症的诊断标准已经完善:CD30和任何KIT突变都被引入次要诊断标准。
• 骨髓肥大细胞增多症是一种新的SM亚型。
• KIT D816V突变伴VAF≥10%定义为B类发现。
5. 骨髓异常增生性肿瘤
5.1 新术语和分组框架
WHO-HAEM5引入了术语骨髓异常增生性肿瘤(myelodysplastic neoplasm,注意缩写是MDS)来取代骨髓异常增生综合征,强调了其肿瘤性质,并将术语与MPN相协调。这些克隆性造血肿瘤的定义是血细胞减少和形态学异常增生(dysplasia)。如上所述,采用血细胞减少定义以确保CCUS、MDS和MDS/MPN之间的一致性。此外,在所有谱系中,异型增生的推荐阈值设定为10%。MDS实体现在分为2类:具有定义遗传学异常的MDS和形态学定义的MDS(表3)。这种分组改变的预期,是通过强调遗传学定义的疾病类型、不再强调第4版分类中对“基于风险的”分组(基于原始细胞百分比、环形铁粒幼细胞和异常增生谱系的数量),来提高分类的严格性,以便于支持更全面的风险分层方案,如修订的MDS国际预后评分系统(IPSS-R)[27]。另一个修改是澄清了术语,以区分MDS伴低原始细胞(MDS-LB)和MDS伴原始细胞增多(MDS-IB),同时保留长期阈值。
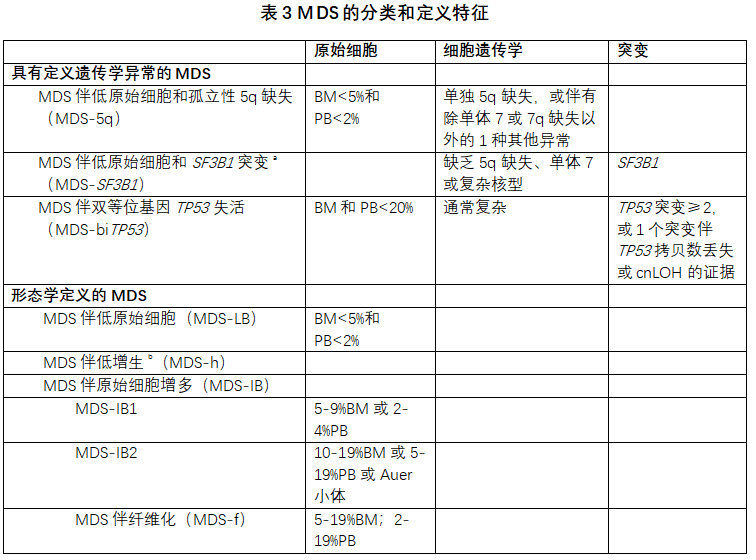
a检测到环形铁粒幼细胞≥15%可替代SF3B1突变。可接受的相关术语:MDS伴低原始细胞和环形铁粒幼细胞。b根据定义,骨髓细胞量≤25%,年龄调整。BM:骨髓,PB:外周血,cnLOH:拷贝中性杂合性丢失
5.2 具有定义遗传学异常的MDS
具有定义遗传学异常的MDS被归入一组,包括:MDS伴低原始细胞和孤立性5q缺失(MDS-5q),MDS伴低原始细胞和SF3B1突变(MDS-SF3B1),以及MDS伴双等位基因TP53失活(MDS-biTP53)。后者取代MDS-5q和MDS-SF3B1。
MDS-5q的诊断标准没有改变。虽然认为SF3B1或TP53突变(非多打击突变)可能改变疾病生物学和/或预后的因素,但SF3B1或TP53突变本身并不能替代MDS-5q的诊断。
最近的研究已经确定MDS-SF3B1是一种独特的疾病类型,包括超过90%的MDS患者的环形铁粒幼细胞≥5%[28]。保留了“MDS伴低原始细胞和环形铁粒幼细胞”术语,作为一种可接受的替代术语,用于野生型SF3B1和环形铁粒幼细胞≥15%。这个术语允许纳入在其他RNA剪接成分中存在驱动突变的罕见MDS病例。
在7-11%的MDS中检测到任何类型的致病性TP53改变(序列变异、片段缺失和拷贝中性杂合性丢失)[29-31]。其中,约2/3患者经受了多次TP53打击(多打击),符合双等位基因TP53改变[29]。双等位基因TP53(biTP53)改变可能包括多个突变或同时缺失其他等位基因的突变。这种“多打击”突变状态导致肿瘤克隆缺乏任何残留的野生型p53蛋白。双等位基因TP53改变的临床检测基于测序分析(至少覆盖外显子4至11)[29,32],通常与检测拷贝数状态的技术相结合,通常是荧光原位杂交,使用17p13.1上TP53位点的特异探针集和/或阵列技术(例如比较基因组杂交或单核苷酸多态性阵列)[33]。下一代测序也可以推断TP53位点的遗传物质丢失[29]。
能够排除组成性TP53变异时,TP53 VAF≥50%可视为反式等位基因拷贝丢失或杂合性拷贝中性丢失的推测(非确定)证据。当检测到两个或多个TP53突变时,两个等位基因通常都受影响[29],并可视为多打击状态。超过90%的MDS-biTP53患者具有复杂的、常为非常复杂(>3)的核型[29,30],因此在IPSS-R中视为非常高的风险[27]。需要更多的研究来确定biTP53状态本身是否定义了AML,这是未来版本中需要考虑的。尽管如此,已发表的数据表明,MDS-biTP53可视为需要等同于AML的治疗[29,30]。
5.3形态学定义的MDS
在WHO-HAEM5中,MDS伴低增生(MDS-h)被列为一种独特的MDS类型。长期以来认识到MDS-h具有独特的特征,它与T细胞介导的对造血干细胞和祖细胞的免疫攻击以及过度产生IFNγ和/或TNFα的CD8+细胞毒性T细胞的寡克隆扩增有关。MDS-h、阵发性夜间血红蛋白尿(PNH)和再生障碍性贫血(AA)三联征的几个特征重叠,包括与CH的相关性[34-36]。许多MDS-h患者对AA患者使用的药物(即抗胸腺细胞球蛋白,ATG)有持续的反应。因此,重点放在仔细的形态学评估上,除了评估骨髓涂片和接触印片之外,通常还需要进行环钻活检评估,以及检测突变和/或克隆细胞遗传学异常。GATA2、DDX41、Fanconi贫血(FA)或端粒酶复合物基因存在种系致病性变异的个体可能存在骨髓低增生(hypoplastic bone marrow),并演变为MDS和/或AML,对免疫抑制治疗无效。
由于异常增生谱系的数量通常是动态的,并且通常代表克隆进化的临床和表型的征象,其本身并不能定义特定的MDS类型,因此单谱系和多谱系异常增生之间的区别现在被认为是可选项。更新的MDS分类方案和将CCUS纳入分类中,不再需要描述词“NOS”或“不可分类”。具体来说,删除了第4版中的MDS-无法分类(MDS-U)。
5.4 MDS和AML之间的界限有所软化,但保留了定义AML的20%原始细胞阈值
出于几个令人信服的原因,并考虑到新的治疗方法对目前分类为骨髓原始细胞占10-30%的MDS或AML患者有效[37-39],主张重新评估定义MDS-IB2和AML界限的骨髓原始细胞百分比。支持这种重新评估的突出的实际挑战包括:(1)任何基于原始细胞的阈值都是主观的,不能反映髓系致病机制固有的生物学连续性;(2)原始细胞计数受采样变化/误差和主观评估的影响;并且,(3)不存在原始细胞计数的金标准,正规测试平台可能经常产生不一致的结果。在编制WHO-HAEM5的过程中,在多学科专家讨论和编委会会议上探讨了将MDS-IB2与AML合并和采用10%的MDS/AML临界值的利弊。降低原始细胞阈值以定义AML会面临上述相同的挑战,只会以一个阈值取代另一个阈值。此外,主观地用10%的原始细胞阈值来定义AML(即使符合MDS/AML或AML/MDS),也存在过度治疗的风险。因此,采用了一种平衡的方法,通过定义遗传学改变来取消大多数AML类型的原始细胞阈值,但保留20%的原始细胞阈值,以便于从AML中区分MDS。尽管如此,人们普遍认为MDS-IB2在治疗方面和临床试验设计方面可能等同于AML。
5.5 儿童MDS:引入疾病术语的特异性增强
儿童MDS是一种克隆性造血干细胞肿瘤,发生于儿童和青少年(<18岁),导致无效造血、血细胞减少和进展为急性髓系白血病的风险。年发病率为1-2/100万儿童,10-25%病例出现原始细胞增多。JMML、髓系增生伴唐氏综合征和细胞毒治疗后MDS均不包括在本组中,属于WHO分类的其他部分。限定术语“儿童”强调了这类髓系肿瘤在生物学上不同于成人[40,41],强调需要进一步阐明其发病机制(目前尚未完全理解)。
儿童MDS伴低原始细胞(cMDS-LB)取代了以前的术语“儿童难治性血细胞减少(RCC)”。它包括两个亚型:cMDS-LB,低细胞;cMDS-LB,非特指(NOS)(表4)。排除血细胞减少的非肿瘤原因,如感染、营养缺乏、代谢性疾病、骨髓衰竭综合征(BMF)和种系致病性变异,仍然是诊断cMDS-LB的重要的先决条件。大约80%的病例表现出骨髓有核细胞减少(hypocellular bone marrow),其特征类似于严重再生障碍性贫血和其他骨髓基质纤维化,需要进行仔细的形态学检查,以评估造血谱系中发育不良的分布、成熟和存在[42]。一些细胞遗传学发现,如单体7、7q缺失或复杂核型,与AML进展风险增加相关,通常采用造血干细胞移植治疗,而核型正常或三体性8的病例可能会呈惰性过程。
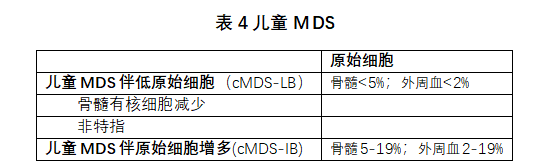
儿童MDS伴原始细胞增多(cMDS IB)定义为骨髓原始细胞≥5%或≥外周血原始细胞≥2%。cMDS IB和cMDS LB的遗传学背景相似,它们都不同于成人MDS。与cMDS LB相比,cMDS IB更常见获得性细胞遗传学异常和RAS途径突变[43,44]。
小结
• 骨髓异常增生综合征更名为骨髓异常增生性肿瘤(简称MDS)。
• MDS遗传学类型更新,包括MDS-5q、MDS-SF3B1和MDS-biTP53。
• MDS伴低增生(MDS-h)被认可为一种独特的疾病类型。
• MDS伴低原始细胞(MDS-LB)是一个新术语,使分类更清晰。
• MDS伴原始细胞增多(MDS-IB)是一个新术语,使分类更清晰。
• 更新了儿童MDS类型的术语。
--未完待续--
往期回顾
血液淋巴肿瘤WHO分类第5版:髓系和组织细胞/树突细胞肿瘤(1)
















共0条评论