[导读] 编译整理:强子
PD-L1评分方案
对于PD-L1免疫组化染色结果的评分,目前有多种方案,具体如针对肿瘤细胞的肿瘤细胞阳性比例分数(tumor proportion scoring,TPS)、针对免疫细胞的免疫细胞阳性评分(immune cell scoring,IC)、联合阳性分数(combined positive scoring,CPS)、肿瘤细胞及免疫细胞的联合评分。具体的“阳性”阈值取决于多个因素,如评分方案、PD-L1免疫组化的表达情况、肿瘤类型。
TPS
TPS评分是最直接、重复性最好的PD-L1评分方案,具体是指全部阳性肿瘤细胞除以全部肿瘤细胞、再乘以100。TPS用于非小细胞肺癌派姆单抗(22C3克隆)、纳武单抗(28-8克隆)、西米普利单抗(22C3克隆)治疗时的评分以及头颈部鳞状细胞癌纳武单抗治疗(28-8克隆)、尿路上皮癌纳武单抗治疗(28-8克隆)时的评分。
22C3克隆PD-L1的TPS评分中,阳性着色是指肿瘤细胞任何程度的细胞膜着色,而不管着色模式(如线状、颗粒状、完全、部分、伴或不伴胞质着色)。需排除仅有胞质着色的肿瘤细胞,并排除炎症细胞、正常上皮细胞及坏死的着色。
图1. 肺腺癌中PD-L1的细胞膜阳性着色表现。
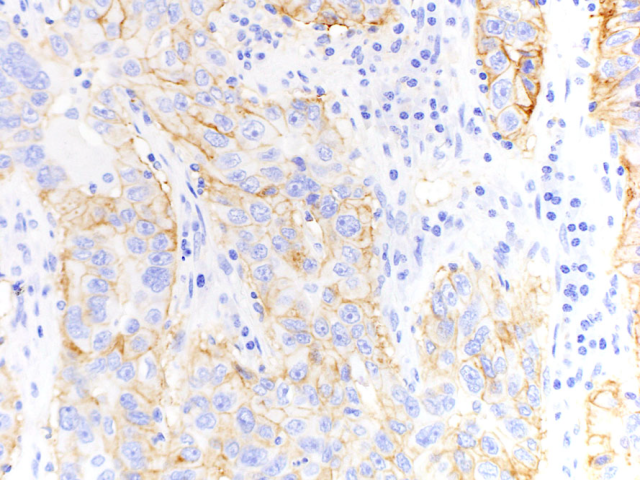
具体评估中,应首先结合HE染色切片、在低倍镜下评估PD-L1着色水平,大致了解有肿瘤区域以及PD-L1阳性区域的情况;然后在高倍镜下确定细胞膜弱阳性或部分着色的区域,因为低倍镜下可能不是很明显。最后评估有PD-L1着色的肿瘤细胞所占比例。如果有多个区域的阳性,则分为多个部分分别进行评分然后计算平均值。
图2. 局灶肿瘤PD-L1阳性TPS评分示例。本例中,仅有约10%的区域PD-L1着色,且该区域中着色肿瘤细胞仅占该区域肿瘤细胞的50%,因此本例最终TPS评分:50%×10%=5%。
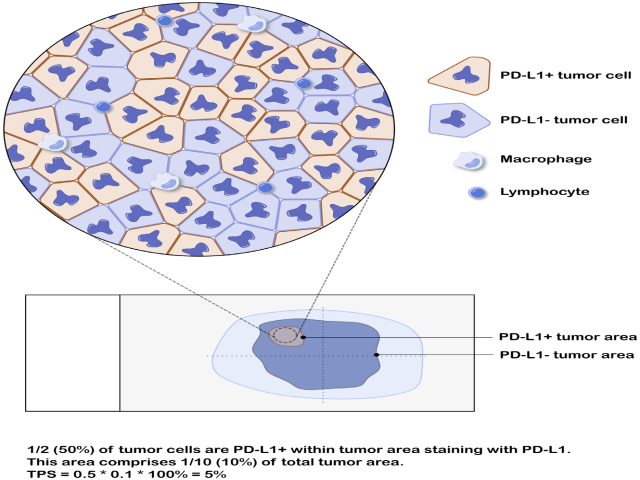
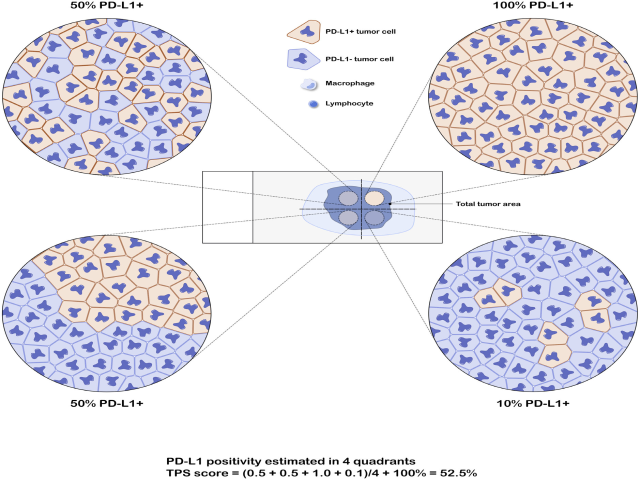
图3. 多灶肿瘤PD-L1阳性TPS评分示例。本例中,肿瘤区域均匀分为四处分别评分,每一处的PD-L1阳性肿瘤占各自区域肿瘤细胞的比例分别为50%、50%、100%、10%,因此本例最终TPS评分:(50%+50%+100%+10%)/4=52.5%。
对于22C3克隆来说,TPS评分结果分为三组:<1%、1-49%、>50%。相应肿瘤是否判定为PD-L1阳性、以及由此确定治疗方案的阈值,一般是1%和50%。因此,相关单位常对结果接近1%或接近50%阈值的病例进行PD-L1阳性肿瘤细胞人工计数、或智能识别辅助下的人工计数,以求精确判定TPS评分。
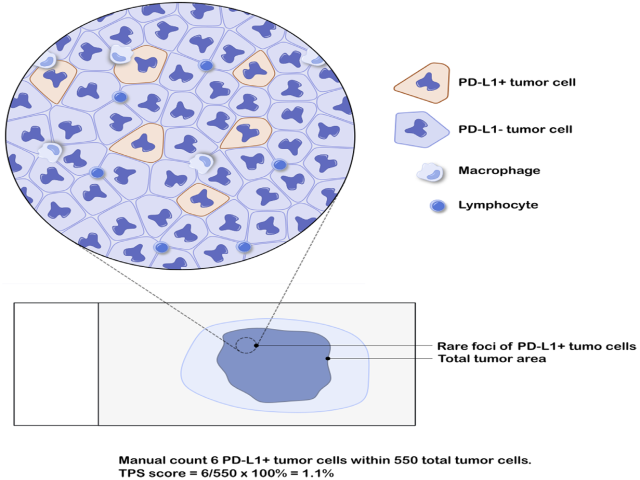
图4. PD-L1阳性肿瘤细胞数量极少、所占比例接近1% 病例TPS评分示例。本例的情况在原作者所在单位,会计数相关细胞:总计550个肿瘤细胞,PD-L1阳性肿瘤细胞为6个,TPS评分为1.1%。
对于22-8克隆来说,TPS评分方法与22C3克隆相同,但报告的阈值建议为<1%、1-5%、5-10%、>10%。与22C3克隆一样,临床治疗决策采取的阈值是1%。需要注意的是尿路上皮癌,原位癌成分不要纳入评分。
IC
IC评分仅限于SP142克隆、阿特珠单抗治疗三阴型乳腺癌和尿路上皮癌时。需要注意的是,Roche已自愿撤回了SP142克隆PD-L1表达的无法切除局部进展期或转移性三阴型乳腺癌相关药物治疗在美国的加速批准。
免疫细胞(淋巴细胞、巨噬细胞、树状突细胞、粒细胞)的着色均视为阳性,不必考虑其着色模式(如点状、线状、膜着色)。肿瘤内或肿瘤旁的免疫细胞纳入评分,其中连续的肿瘤旁间质包括肿瘤前缘直接接触的周围组织。坏死及血管、血液内的中性粒细胞着色不要纳入评分。肿瘤细胞也可有PD-L1阳性着色,但IC评分中也要排除。此外,导管原位癌及小叶原位癌中的免疫细胞也要排除在外。
IC评分是指肿瘤内及与肿瘤相延续的瘤旁间质内(坏死除外)PD-L1任意程度阳性免疫细胞所占肿瘤细胞的比例。SP142克隆的判读中,建议在20-40倍下判定肿瘤区域,在100-200倍下进行IC评分。三阴型乳腺癌报告PD-L1阳性的阈值是IC评分≥1%。淋巴结内转移性三阴型乳腺癌的IC评分时,应先勾画出肿瘤和周围淋巴结之间的分界再进行评分,勾画区域内任意程度的PD-L1阳性免疫细胞均纳入评分。
图5. PD-L1阳性IC评分示例。本例中,PD-L1阳性炎症细胞占所有肿瘤细胞的比例为10%,因此IC评分为10%。
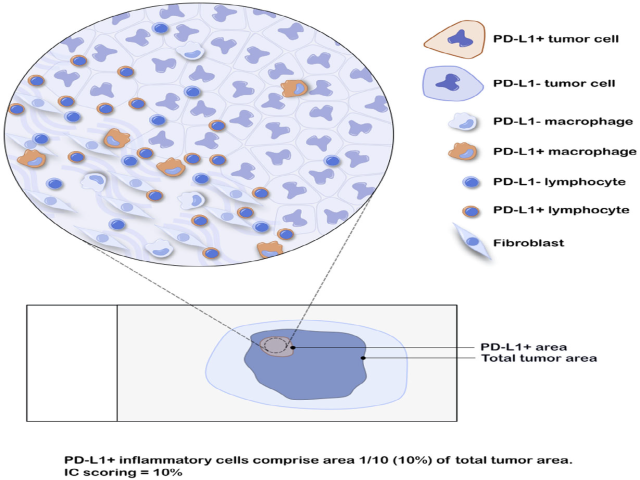
图6. 腺癌转移至淋巴结的PD-L1免疫组化评估。低倍镜下,先勾画出肿瘤和周围淋巴结之间的分界再进行评分,勾画区域内的免疫细胞才纳入评分。
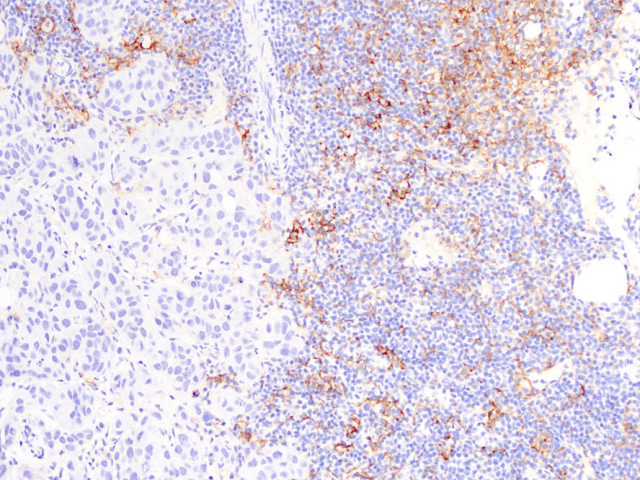
尿路上皮癌的SP142克隆IC评分与此相似。纤维血管轴心及与乳头状结构基底相延续的淋巴细胞簇内炎症细胞也认为是肿瘤内的炎症细胞。坏死、血管内炎症细胞、治疗相关的肉芽肿不纳入IC评分。尿路上皮癌中SP142阳性的判断阈值是≥5%。
CPS
有些癌种的PD-L1评估采用的是CPS方案,具体如22C3克隆在头颈部鳞状细胞癌、胃和胃食管交界处的癌、食管鳞状细胞癌、尿路上皮癌、宫颈癌中的评估。
CPS计算的是肿瘤细胞和肿瘤相关免疫细胞(淋巴细胞、组织细胞)中PD-L1阳性数量、再除以肿瘤细胞总数,计算百分比。阳性肿瘤细胞的判断中,应为部分或完全细胞膜着色(±胞质着色);原位癌及良性上皮不计入。单核细胞(淋巴细胞、组织细胞)的任意着色(细胞膜或胞质)均视为阳性。炎症细胞的评估,限于肿瘤细胞巢内、肿瘤细胞巢周围间质内、肿瘤边缘相邻一个200倍视野(0.5mm)范围相邻间质内者。评估区域内PD-L1阳性肿瘤细胞数和PD-L1阳性炎症细胞数之和作为分子、该范围内所有肿瘤细胞数作为分母,计算CPS。
图7. PD-L1阳性CPS评分示例。本例中,PD-L1阳性肿瘤区域约占所有肿瘤区域的10%;具体计数,合计36个肿瘤细胞,其中PD-L1阳性炎症细胞14个,PD-L1阳性肿瘤细胞21个,最终CPS为(14+21)/36×0.1=9.7%。
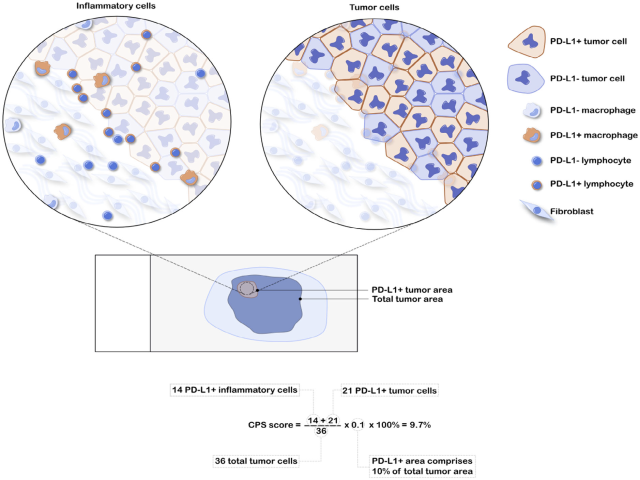
图8. 食管鳞状细胞癌中的PD-L1着色及CPS计算,需注意评估阳性的肿瘤细胞及免疫细胞。
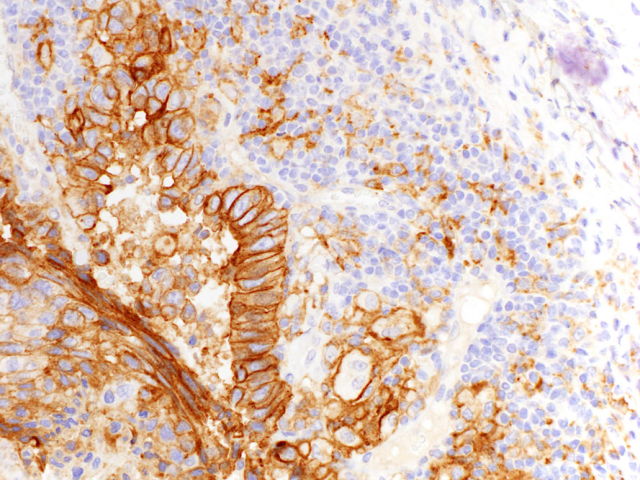
22C3克隆CPS评估方案中,建议不要在高于20倍物镜下评估,目的是确保纳入肿瘤周边的PD-L1阳性免疫细胞。具体操作时,建议在低倍镜下确定肿瘤周围有免疫细胞的区域,然后在200倍下、将肿瘤细胞的边缘置于视野中央,该视野中的所有PD-L1阳性单核细胞均纳入计数。淋巴结转移灶中PD-L1阳性的计数也按此操作:淋巴结内转移性肿瘤边缘200倍视野内的PD-L1阳性单核细胞纳入计数。不过,免疫细胞计数时,中性粒细胞、嗜酸性粒细胞、溃疡或其他炎症相关的炎症细胞均需排除在外。
需要注意的是,胃食管交界处癌的PD-L1着色有两种不同的情况:肿瘤细胞呈花边状着色,或肿瘤结节周边呈交界处着色,这两种情况都要纳入CPS评分。对于食管鳞癌来说,多核巨细胞应纳入炎症细胞评分。
肿瘤细胞评分和免疫细胞评分联合
肿瘤细胞评分和免疫细胞评分的方式,应用于阿特珠单抗治疗非小细胞肺癌时SP142克隆的评估、或应用于德瓦鲁单抗治疗尿路上皮癌时SP263克隆的评估;不过,后者已被AstraZeneca公司自愿撤回了相关审批。
阿特珠单抗治疗小细胞肺癌时SP142克隆评估中,需有下述两点中的任意一点:≥50%的肿瘤细胞具有任意程度膜着色;肿瘤内浸润的免疫细胞阳性占肿瘤区域(包括连续的肿瘤周围间质在内)的比例≥10%。
德瓦鲁单抗治疗尿路上皮癌时SP263评估中,对肿瘤细胞和免疫细胞都有要求;但不同于SP142克隆的是,SP263克隆有确定的阳性阈值,即:肿瘤细胞中PD-L1阳性占比≥25%;肿瘤相关免疫细胞占据的肿瘤区域比例>1%(HE切片中评估)、且这些免疫细胞中PD-L1阳性占比≥25%;肿瘤相关免疫细胞占据的肿瘤区域比例为1%(HE切片中评估)、且这些免疫细胞PD-L1阳性比例为100%。
对于该评估来说,纳入计数的免疫细胞是位于肿瘤区域内的、或直接与肿瘤结节前缘相接触的,细胞类型则包括中性粒细胞、浆细胞、树状突细胞。需要在低倍镜下围绕肿瘤结节画出相应范围;如果肿瘤为多巢,则一个100倍视野可以纳入的瘤巢之间间质也计为肿瘤区域。如果瘤巢之间间质一个100倍视野无法纳入,则按照前述方案分别判读。淋巴结内转移性肿瘤的评估时,肿瘤区域捏的免疫细胞纳入评估;但周围未受累淋巴结中的淋巴细胞不纳入计数。
图9. 免疫细胞评分示例。本例中,肿瘤结节之间、一个100倍视野可以纳入的支持性间质视为肿瘤区域,纳入PD-L1计数。
SP263克隆计数也可应用于非浸润性乳头状尿路上皮癌,纤维血管轴心内及乳头基底相邻处的免疫细胞也纳入评分。SP263克隆PD-L1免疫组化报告方面,阳性比例按照0%、1%、5%、10%、20%、25%、30%报告,超过30%者按照10%递增报告。不过,如免疫细胞占肿瘤区域的比例为1%,则PD-L1阳性免疫细胞比例仅报告为0%、<100%、100%。
全文完
往期回顾
PD-L1免疫组化大揭秘(一)






















共0条评论