[导读] 编译整理:强子
肿瘤免疫治疗,已成为诸多癌种治疗的主要内容。值得病理医师重点关注的,是针对免疫检查点、尤其PD-1和PD-L1的单克隆抗体治疗。因为PD-L1检测已成为相应药物治疗中的预测性标记,其免疫组化检测及结果的报告也成为病理医师的重要工作之一。美国麻省总医院及哈佛大学医学院病理专家在《APMIS》杂志撰文,详尽介绍了PD-L1免疫组化检测方案及病理诊断工作中需注意的相关事项。为帮助大家更好的了解相关问题并指导临床实践,我们将该文要点编译介绍如下。
简介
PD-1是一种跨膜受体蛋白,一般位于B细胞和T细胞及NK细胞中。正常情况下,PD-1与其膜配体蛋白PD-L1(B7)结合,会抑制凋亡、促进T细胞耗竭、促进T效应细胞转化为调节细胞,避免对自身抗原的自身免疫。T细胞中的PD-1与表达自体肽的未受刺激树状突细胞上PD-L1结合,限制该T细胞亚克隆的增殖,即可耐受这些自体抗原。与自体肽持续反应的T细胞进一步受到表达PD-L1的内皮细胞或上皮细胞抑制,进一步起到避免自体免疫的检查点作用。
图1. PD-1-PD-L1信号通路示意图。(上)在结合B7(即PD-L1)的CD28协同刺激下,淋巴细胞(蓝色所示)上的受体(TCR)识别抗原呈递细胞(咖啡色所示)表面MHC分子上的肿瘤抗原。(下)T细胞中的PD-1与表达自体肽的未受刺激树状突细胞上PD-L1结合,限制T细胞亚克隆的增殖以耐受这些自体抗原。

针对PD-1-PD-L1信号通路来说,肿瘤细胞的发生机制即颠覆了这种肿瘤免疫:肿瘤细胞通过表达PD-L1而导致淋巴细胞对肿瘤抗原耐受、T细胞耗竭并凋亡。
图2. 肿瘤细胞发生机制:肿瘤细胞(绿色所示)通过表达PD-L1而导致机体对肿瘤抗原耐受、T细胞耗竭并凋亡。

PD-L1免疫组化解读中的相关注意事项
从理论上来说,肿瘤免疫治疗是为了活化(或再活化)肿瘤细胞凋亡及淋巴细胞针对肿瘤细胞的靶向作用。目前已有多种靶向并抑制PD-1(派姆单抗、纳武单抗、西米普利单抗)或PD-L1(阿特珠单抗、阿维单抗、德瓦鲁单抗)的单克隆抗体治疗方案。
多种类型的肿瘤中需进行PD-L1表达水平的评估,以预测相应药物治疗的效果。不过,目前PD-L1“阳性”标准还有争议,还没有得到完全公认的标准化或可重复的PD-L1“阳性”标准,且不同瘤种之间PD-L1免疫组化评估存在差异。更“不幸”的是,针对PD-L1,已有针对15种癌的4种不同分析方案获批,但各自解读方法不同,评分方案也并无克隆号或检测平台独有的标准方法及用于治疗的共同阈值。这些伴随检测及相应的评分方案也从未进行过等效性的前瞻性评估。病理医师的因素也并未纳入相关检测的标准化及评估中。因此,这样得出的PD-L1免疫组化缺乏标准化及可重复的结果。
尽管存在上述各种问题,PD-L1的免疫组化还是逐渐成为了很多病理实验室的日常工作内容之一。因此病理医师了解PD-L1免疫组化检测中的相关问题并尽量做到准确、合规的判读相关结果,对于临床诊疗具有极为重要的意义。
PD-L1克隆号介绍
目前已有多种克隆号的PD-L1抗体可用,有些是美国食品药品监督管理局批准的免疫组化平台及试剂,适用于特异性治疗方案;还有些则是相关实验室开发的抗体。
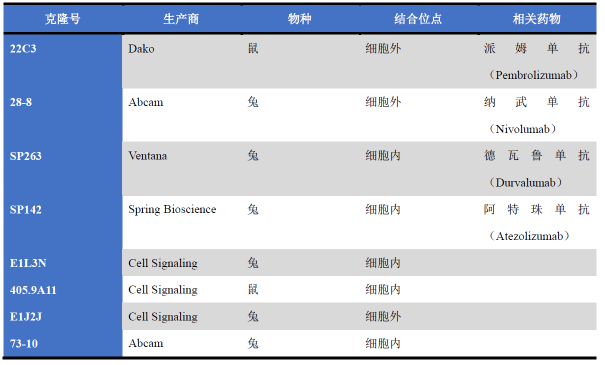
目前,22C3、28-8、SP142、SP263克隆的PD-L1抗体有商用产品,且适用于特定免疫组化染色平台,是适用于特定单克隆抗体治疗的伴随诊断或补充诊断。E1L3N、405.9A11、5H11、E1J2J、73-10克隆的PD-L1抗体尚未被批准为伴随诊断或补充诊断,均归属于实验室开发的抗体。
PD-L1免疫组化组织对照
PD-L1免疫组化检测时,推荐用扁桃体做组织对照,因为该标记在扁桃体隐窝上皮一般呈细胞膜强阳性着色,在生发中心内的巨噬细胞呈弱至中等着色,而表面鳞状上皮、内皮细胞、间质纤维母细胞均为阴性。
图3. 扁桃体用于PD-L1免疫组化的组织对照。(上)低倍镜下可见PD-L1在扁桃体中的着色分布;(中)隐窝上皮细胞处呈细胞膜强阳性着色;(下)生发中心内巨噬细胞呈弱阳性着色。



由于PD-L1阳性阈值低一些可能具有重要临床意义,因此也有人提出扁桃体并不适合作为对照;最好应开发明确有PD-L1表达的标准细胞系制作组织芯片用于对照。
图4. 标准化细胞系质控,图中分别示PD-L1免疫组化阴性(上)、10%阳性(中)、100%阳性(下)。



组织固定
推荐组织固定于10%中性缓冲福尔马林中至少12小时,最高不超过72小时,组织切片厚度4-5μm。
肿瘤数量的要求
根据不同克隆PD-L1免疫组化检测指南,应至少有50-100个固定良好、形态清晰的肿瘤细胞供评估,且有恰当的阳性对照和阴性对照。
未完待续
点击这里下载原文
参考文献
Chebib I, Mino-Kenudson M. PD-L1 immunohistochemistry: Clones, cutoffs, and controversies. APMIS. 2022;130(6):295-313.
doi:10.1111/apm.13223






















共0条评论