[导读] 作者:慧海拾穗
原发性中枢神经系统肿瘤的免疫组化标记物研究进展(一)
【二】胚胎性肿瘤
最近已经取得了巨大的进展,发现了大量的基因组学知识,可以深入研究胚胎性肿瘤的各种类型,识别许多具有独特临床病理特征的新实体,这些特征以前被分类为现在已经过时的名称“原始神经外胚层肿瘤”。与儿童期优先出现的许多肿瘤一样,这些实体大多表现为重现性点突变或结构变异,其中一些可能不存在于大多数目前可用的测序平台上。幸运的是,用于替代诊断突变、融合蛋白和激活下游通路成分的免疫组化标记可帮助诊断这一组具有挑战性的肿瘤。
【1】髓母细胞瘤的遗传学亚群
髓母细胞瘤是迄今为止最常见的中枢神经系统胚胎性肿瘤,占所有儿童颅内肿瘤的25%,广泛的研究已确定4个独特的分子亚群,具有明显的临床特征。明确的亚组分配需要多种先进的分子检测,包括拷贝数、突变、转录和甲基化谱的检测;然而,选择的免疫组化标记可用于识别WNT或SHH途径激活的肿瘤亚组。
(1)髓母细胞瘤,Wnt激活型
该型肿瘤占所有髓母细胞瘤的~10%,主要发生在年龄较大的儿童和年轻成人。在髓母细胞瘤中,这种亚型的肿瘤通常起源于脑干背侧,并延伸至第四脑室。该型肿瘤预后很好,常规的标准治疗可以完全缓解。
它们几乎总是表现出典型的髓母细胞瘤组织学形态,其中未分化的胚胎细胞排列成片状密集的合胞体样,偶尔有Homer Wright菊形团和神经细胞分化及细胞数量减少区域(图3A)。未见结节周围胶原沉积和结缔组织增生。少数肿瘤可能表现出大细胞或间变性特征;然而,这些肿瘤的生物学潜能尚不确定。
在遗传学上,这些肿瘤的特征是CTNNB1的3外显子和6号染色体单体激活突变。免疫组化检测β-catenin呈细胞核阳性是该亚群的可靠标记,显示85%的肿瘤至少有局灶阳性(图3B)。虽然在WNT激活的肿瘤中有TP53重现性突变的报道,但它们似乎没有明显的预后意义。
(2)髓母细胞瘤,SHH激活型
该亚组占所有髓母细胞瘤的~30%,呈双峰年龄分布,在低龄儿童和青年成人达高峰。肿瘤多发生于小脑半球,与WNT激活型髓母细胞瘤不同,TP53突变状态对其临床病理特征有显著影响。
(3)SHH激活型和TP53野生型
这类髓母细胞瘤的特征性组织学表现为双相的促纤维增生性/结节性组织学,低密度肿瘤的无网织蛋白结节表现为神经细胞分化和增生减少,散在高核分裂象、密集排列的未分化细胞区域和富含网织蛋白的基质。偶尔肿瘤可能表现出经典的或大细胞/间变性特征。
SHH通路的激活通常是通过PTCH1或SUFU的功能缺失突变来实现的,而SMO的激活突变或GLI2的扩增则很少发生。在SHH激活型肿瘤中,filamin A、GRB2相关结合蛋白1(GAB1)和转录共激活因子yes相关蛋白1(YAP1)表达上调,均可用免疫组化方法检测到。细胞质GAB1染色是SHH激活型肿瘤的特异性标记,而filamin a(细胞质)和YAP1(细胞核和细胞质)的阳性也存在于WNT激活型髓母细胞瘤中。神经元标记物,如突触素和NeuN,通常在结节区呈阳性,而未见弥漫性p53染色。这些肿瘤的预后是中等的,有1篇文献报道其5年总生存率为76%。
(4)SHH激活型与TP53突变型
与TP53野生型SHH激活型髓母细胞瘤相比,这些肿瘤主要发生于儿童,偶尔发生于Li-Fraumeni综合征者。
显微镜下组织学为侵袭性大细胞/间变性,具有明显的多形性、细胞包裹、显著的核仁和大量的核分裂象和凋亡。
弥漫性p53强阳性通常表明潜在的TP53突变。SHH的活化通过GLI2、MYCN或SHH的扩增而不是PTCH1、SUFU和SMO的突变来实现的。该型预后差,5年总生存率估计为41%。
(5)非Wnt/非SHH型髓母细胞瘤
未显示Wnt或SHH途径激活的基因证据的肿瘤可根据其转录组和甲基化谱进一步分为第3组和第4组。它们共同构成髓母细胞瘤的最大部分,其中第3组约占所有髓母细胞瘤的20%,40%属于第4组。
每一组都有重现性的遗传学改变;然而,在缺乏全面的分子分析的情况下,精确的亚型分类可能是一个挑战。大多数(~80%)非Wnt/非SHH型髓母细胞瘤存在染色体17p缺失和17q获得,或存在等双着丝粒17q。MYC扩增是第3组所独有的;然而,这只在少数病例中观察到。
大多数非Wnt/非SHH型髓母细胞瘤表现出典型的组织学特征,尽管第3组部分肿瘤可能表现出大细胞/间变性特征。两组均不具有特征性免疫表型。突触素呈不同程度的阳性,但GAB1、YAP1、filamin A和核β-catenin普遍呈阴性。
第3组肿瘤的临床转归通常很差,而第4组肿瘤的预后取决于出现转移性疾病。
【2】松果体母细胞瘤
松果体母细胞瘤是一种少见的胚胎性恶性肿瘤,可能发生在任何年龄段,但最常见于20岁之前。它们出现在松果体区域内,可能表现出明显的延伸到邻近结构中,这使得肿瘤原发部位不明确。
组织学上,这些肿瘤表现为典型的小圆形蓝细胞肿瘤,原始细胞呈弥漫片状分布(图3C)。偶尔也可以看到Homer Wright和Flexner-Wintersteiner菊形团。神经元标记物表达不一,而胶质标记物通常为阴性,标记内陷胶质细胞。SMARCB1表达阳性。视网膜光感受器分化主调节因子CRX阳性是松果体分化的一个非常敏感和特异的标志物,100%标记松果体实质肿瘤,包括松果体母细胞瘤(图3D)。CRX也是视网膜母细胞瘤的特异性标记物,极少数髓母细胞瘤也可能显示阳性。
松果体母细胞瘤的预后通常优于其他幕上胚胎性肿瘤,一些最新实验报告其5年总生存率超过80%。
【3】非典型畸胎瘤样/横纹肌样瘤
非典型畸胎瘤样/横纹肌样瘤(AT/RT)是另一种少见的胚胎性恶性肿瘤,主要发生在婴儿期,约占儿童脑肿瘤总数的1~2%,10%以上发生于婴儿。肿瘤可能出现在神经轴的任何部位,幕上室稍微多见。
显微镜下,AT/RTs表现出多种生长模式和多向原始分化;然而,通常出现胚胎样的小细胞成分(图3E)。这些肿瘤的典型组织学表现为横纹肌样细胞的存在,细胞核呈偏心排列,核染色质空泡状,核仁明显,丰富的嗜酸性胞质具有一个致密的核心(包涵体?),细胞边界清晰。然而,这些细胞可能为小灶状,或者在许多病例中完全不存在。AT/RTs可显示表达多种抗体,包括EMA、SMA、GFAP、细胞角蛋白和syn,但生殖细胞标记通常为阴性。
这些肿瘤的定义是SMARCB1基因失活(通过突变或缺失),可以通过SMARCB1的核染色丢失来检测(图3F)。病例报告还描述了保留SMARCB1表达式的AT/RTs实例,这些病例显示SMARCA4丢失。因此,对于显示典型AT/RT形态并表达SMARCB1时,免疫组化检测SMARCA4(BRG1)可能有助于诊断。
AT/RT侵袭性极强,通常是快速致死性的,大多数研究报告总生存率小于12个月;然而,一部分患者用侵袭性多模式治疗可能延长生存期。
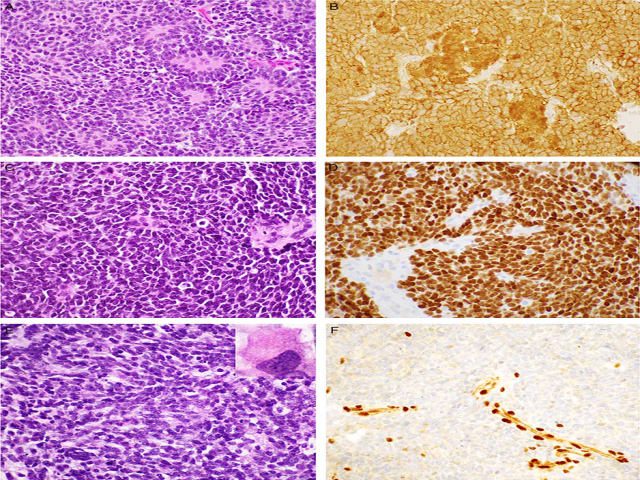
图3 胚胎性肿瘤的诊断性免疫组织化学研究:WNT激活型髓母细胞瘤具有典型的形态学特征,细胞呈低分化片状,偶尔可见Homer Wright菊形团(A);β-catenin通常局灶核染色阳性,但对该型髓母细胞瘤有诊断价值(B);松果体母细胞瘤也含有少量结构的胚胎细胞(C);然而,通常观察到松果体谱系的CRX强核染色(D);E、 非典型畸胎样/横纹肌样瘤具有不同的形态特征,以胚胎性成分为主。散在横纹肌样细胞(插图)并不总是存在,但诊断性标记物SMARCB1(F)是阴性表达的。
【4】胚胎性肿瘤伴多层菊形团
这种独特的侵袭性胚胎性肿瘤发生在4岁以下儿童中,男女发病率相同。肿瘤倾向于幕上室,但有30%的病例累及小脑和脑干。
它们可能表现出几种不同的生长模式,以前认为每一种是不同的实体:富含神经纤维和真菊形团的胚胎性肿瘤(ETANTR)、室管膜母细胞瘤和髓上皮瘤。ETANTR显示了一种双相结构模式,小的原始细胞簇排列在多层菊形团中,中间散布着大量的无细胞的神经纤维区,其中可能含有分化的神经元或神经节细胞成分(图4A)。室管膜母细胞瘤缺乏神经细胞和神经元分化的区域,而是在多层菊形团结构中显示出片状小到中等大小的原始细胞。髓上皮瘤结构模式包含形成乳头状和管状结构的胚胎性细胞,使人想起早期的神经管结构。
免疫组化检测神经元标志物,如syn、NFP、NeuN和GFAP可在神经纤维网和分化成分区域内阳性。差分化区和菊形团不表达这些标记物,而局灶表达上皮标记物(包括细胞角蛋白和EMA)。SMARCB1染色阳性。尽管在AT/RT、生殖细胞肿瘤和一些胶质瘤中可能会遇到非特异性染色,但无论组织学类型如何,这些肿瘤弥漫表达LIN28(图4B)。
根据定义,其遗传学改变是19号染色体上的19q13.42(C19MC)处microRNA簇的一个局灶扩增,它可能伴随着6q缺失和2、7q和11q染色体的获得。无论采用何种治疗方法,总生存率都很低,平均为12个月。
【5】具有重现性基因融合的高级别神经上皮性肿瘤(High-grade Neuroepithelial Tumors
With Recurrent Gene Fusions)
对一个先前被归类为中枢神经系统原始神经外胚层肿瘤的大队列肿瘤的综合遗传学分析显示,有几个不同的分子亚群显示出重现性结构变异。下面描述的每一个实体都表现出相对相似的临床特征,肿瘤最常见于20岁之前(中位年龄,5岁以下),男女比例相当。大多数肿瘤也没有明显的解剖部位倾向。
在显示不同程度神经元分化的肿瘤(CNS NB-FOXR2)中重复检测到涉及FOXR2基因的融合,包括交替分类为CNS神经母细胞瘤或节细胞神经母细胞瘤的肿瘤。这些肿瘤表现出多种结构改变,导致FOXR2的显著上调,包括重现性的JMJD1C-FOXR2融合和多种串联复制,这些串联复制将相邻基因的启动子区域并列以激活FOXR2的表达。有趣的是,这些肿瘤同时显示了OLIG2和syn的强表达,这是这组肿瘤中的一个独特特征。该肿瘤亚组预后中等,5年总生存率为65%。
另一个亚组表现为MN1(CNS HGNET-MN1)重现性重排,最常见的是通过t(22;X)(q12;p22)易位与伙伴BEND2发生易位。该肿瘤好发于年龄稍大的年轻成人女性(女男比例>5:1)。虽然大多数肿瘤发生在大脑半球,但也可能发生在小脑和脊髓。这组肿瘤的生长模式多样,从实性到假乳头状结构,致密间质常玻璃样变性,包括许多根据组织学分类的星形母细胞瘤。病灶通常界限清楚,含有常阴性表达胶质细胞和神经细胞标记物的卵圆形肿瘤细胞。这组患者的总体生存率非常好,随访96个月时100%的患者存活。
“CNS-EFT-CIC”亚组在基因和组织学上与外周CIC重排的圆形细胞肉瘤有明显的重叠。两种肿瘤都表现出重现性的CIC融合事件,导致ETS家族转录因子显著上调。存在CIC-NUTM1融合是这一组的特征,并导致NUTM1的上调表达。因此,NUTM1免疫组化对这些肿瘤的检测具有高度的敏感性和特异性,而很少表达胶质细胞和神经元标记物。这些肿瘤的预后与CNS NB-FOXR2相似,5年总生存率为60%。
最具侵袭性的HGNET亚组(CNS HGNET-BCOR)以BCOR第15外显子内的远端内串联重复为特征。肿瘤好发于1岁以内婴儿,可能发生在中枢神经系统的任何部位。组织学上,肿瘤细胞通常呈胶质形态,细胞核呈卵圆形至锥形,并有纤维突起(图4C)。血管周围的假菊形团也常见。尽管有这些特征,OLIG2和syn染色通常是阴性的。尽管如此,该型肿瘤显示BCOR上调和随后的WNT途径激活,可通过BCOR和β-catenin核染色来检测(图4D)。该型肿瘤预后很差,在诊断后几个月内迅速死亡。
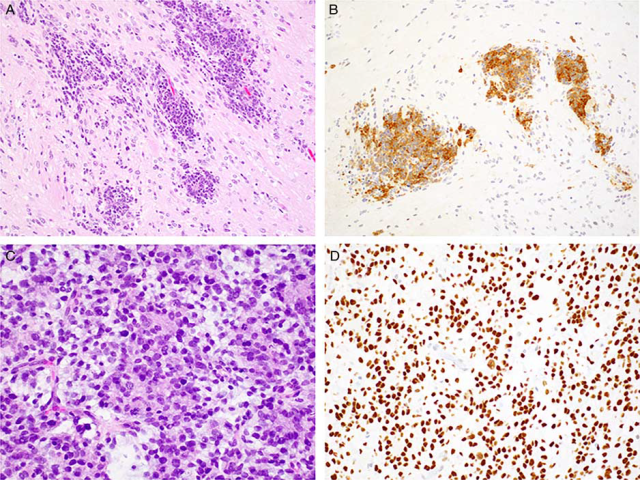
图4 少见的胚胎性肿瘤实体:一个ETMR(Embryonal Tumor With Multilayered Rosettes)病例,具有ETANTR生长模式,可见嵌在较大区域神经纤维网中的胚胎细胞簇(A);在差分化成分中可见LIN28呈细胞质染色(B);CNS-HGNET-BCOR含有胶质细胞形态,常出现血管周围假菊形团,这个例子显示模糊的Homer Wright菊形团结构(C);BCOR弥漫性核阳性提示BCOR基因重排(D)。
【参考文献】
[1] Advances in Diagnostic Immunohistochemistry for Primary Tumors of the Central Nervous System.Adv Anat Pathol,2019.















共0条评论