[导读] 作者:慧海拾穗
原发性中枢神经系统肿瘤的免疫组化标记物研究进展(二)
原发性中枢神经系统肿瘤的免疫组化标记物研究进展(三)
【摘要】随着基因组特征对中枢神经系统肿瘤的准确诊断变得越来越必要,快速鉴定可评估的生物标记物对于避免治疗费用过高和延迟开始治疗同样重要。本文综述了新的免疫组化标记物,这些标记物可用于确定多种肿瘤类型的突变状态、信号通路激活、药物靶点和细胞谱系。特别是,将讨论2016年世界卫生组织中枢神经系统肿瘤分类中最近增加的实体,包括IDH突变型胶质瘤、弥漫性中线胶质瘤、上皮样胶质母细胞瘤、血管中心胶质瘤、RELA基因重排室管膜瘤、胚胎性肿瘤(髓母细胞瘤、非典型畸胎瘤/横纹肌样瘤、松果体母细胞瘤、伴多层菊形团的胚胎性肿瘤和其他基因定义的高级别神经上皮性肿瘤),以及与胚系改变相关的脑膜瘤。
【概述】分子检测的最新进展揭示了中枢神经系统肿瘤的广泛遗传多样性。这些发现使诊断标准得以完善,为2016年世卫组织中枢神经系统肿瘤分类更新铺平了道路。在许多情况下,H&E表现不再足以进行正确的分类和预后判断。随着先进的分子检测在中枢神经系统肿瘤的诊断中发挥着如此重要的作用,获得正确分类所需的数据可能会导致严重的延误和成本。因此,许多新的免疫组化标记被直接或间接地检测到许多诊断相关的基因组改变。特别是一些突变特异性抗体的发展极大地促进了弥漫性胶质瘤的分类,这可能显示出重叠的组织学特征,但却有着根本不同的临床行为。胚胎性肿瘤亚型分类也得益于检测诊断性细胞遗传学异常或由此产生的上调通路成分的标记物。发育生物学的进展也为室管膜和松果体起源的肿瘤识别了新的谱系标记。最后,在罕见的脑膜瘤亚型中某些标记物的表达缺失不仅是诊断性的,而且与胚系改变有关。本文将着重介绍上述免疫组化标记物及其与临床、形态学和基因组学的结合,以期对新定义的中枢神经系统肿瘤的诊断工作有所帮助。
【一】弥漫性胶质瘤
胶质瘤生物学中最重要的发现之一是发现了异柠檬酸脱氢酶(IDH)获得功能的突变,这些突变驱动了一部分胶质瘤的形成。IDH1密码子132和IDH2密码子172的突变导致肿瘤代谢物2-羟基戊二酸的产生,进而导致全基因组启动子高甲基化和对终末细胞分化至关重要的基因沉默。矛盾的是,IDH1/2突变也减缓了胶质瘤的临床进展,与组织学上等同的IDH野生型胶质瘤相比,可显著提高生存率。因此,在初始检查期间确定IDH1/2状态对于正确的治疗计划和临床试验登记至关重要。
【1】异柠檬酸脱氢酶(IDH)-突变型胶质瘤
(1)少突胶质细胞瘤
截至2016年世卫组织更新,少突胶质细胞瘤在遗传学上被严格定义为具有1p和19q染色体全臂缺失和IDH1或IDH2突变。广泛浸润,生长缓慢,占胶质瘤的6%。肿瘤好发于年轻成人,发病高峰年龄为40~50岁;儿童少见。男性稍微多见(男:女比例为 1.3:1)。该肿瘤大多累及大脑半球的白质,中枢神经系统其他部位少见。
肿瘤细胞形态单一,细胞核圆形,可见特征性核周空晕(图1A)。纤细的毛细血管分支网、微小钙化和微囊改变也是常见的。少突胶质细胞瘤的分级标准仍然有点不明确。低级别肿瘤通常表现出核分裂象低和多形性少见,而间变性少突胶质细胞瘤通常有大量的核分裂象,以及血管增生和坏死。
普遍存在IDH1或IDH2的突变,约90%的肿瘤含有IDH1 R132H变异,可通过突变特异性IDH1 R132H抗体检测到。其余10%包含IDH2 R172K或IDH1中132密码子处的交替错义突变。值得注意的是,已经开发出两种pan- IDH1/2突变特异性抗体,它们能够检测到两种蛋白质中的一些但不是所有致病性亚型。CIC和TERT基因启动子突变是少突胶质细胞瘤的常见事件,而FUBP1基因突变的发生率较低。高级别肿瘤也可能表现出CDKN2A的缺失、NOTCH1和PI3K通路成分的突变。ATRX和TP53的突变是极为少见的,在实际应用中应被视为与1p/19q共缺失相互排斥。目前,1p/19q基因缺失的检测需要进行FISH或染色体微阵列检测;然而,IDH1 R132H、ATRX和p53的免疫组化结合可以大大帮助诊断(图1B-D)。
报道的少突胶质细胞瘤的临床结果不一,但最近的研究纳入了当前的基因定义和辅助放化疗方案,低级别肿瘤的平均总生存期超过15年,间变性少突胶质细胞瘤的平均总生存期超过10年。
(2)星形细胞瘤
无1p/19q共缺失的IDH突变型胶质瘤,不论其组织学表现如何,均为星形细胞瘤,占所有胶质瘤的15%~20%。IDH突变型星形细胞瘤在40~50岁时表现为低级别病变,随着时间的推移可预测进展为高级别病变。与少突胶质细胞瘤相似,IDH突变型星形细胞瘤好发于男性(男:女=1.3:1),并局限于大脑半球的白质。
肿瘤细胞具有非典型的深染细胞核和纤维状染色质,通常缺乏核周空晕(图1E)。肥胖细胞型具有丰富的嗜酸性细胞质和偏心核,类似于正常的反应性丰富程度不一的星形胶质细胞。背景基质通常结构松散,可能显示出广泛的微囊形成。低级别肿瘤(弥漫性星形细胞瘤)表现出轻度的多形性和富于细胞性,如有核分裂象也极其少见。间变性星形细胞瘤通常表现出更大的核异型性和富于细胞性,核分裂象明显增多。除了这些特征外,微血管增生和/或坏死的存在也可以归类为胶质母细胞瘤。IDH突变型胶质母细胞瘤最发生于低级别星形细胞瘤的恶性进展,占所有胶质母细胞瘤总数的10%以下。
与少突胶质细胞瘤一样,绝大多数肿瘤携带IDH1 R132H突变,并可用突变特异性抗体标记(图1F)。IDH突变型星形细胞瘤也被定义为伴随ATRX和TP53功能缺失突变,这些突变存在于90%以上的病例中。ATRX突变通常是无义或截断移码突变,导致免疫组化染色丢失(图1G);然而,在一些ATRX突变中,尤其是远端截断的ATRX突变可能会遇到保留表达。TERT启动子突变与ATRX突变互斥,在1p/19q共缺失的情况下,IDH1/2显示野生型状态。尽管如此,一小部分IDH野生型星形细胞瘤(如巨细胞胶质母细胞瘤和组蛋白突变胶质瘤)显示ATRX和TP53失活(图1I–L),这将促使测序研究排除IDH1/2突变的存在。TP53的错义失活突变是最常见的,要么与17p缺失结合,要么作为杂合性的拷贝中性缺失,并且可以通过细胞核p53弥漫强染色检测到(图1H)。相比之下,纯合性缺失的TP53将显示肿瘤细胞完全失去染色。IDH野生型胶质瘤的典型遗传改变,包括受体酪氨酸激酶(RTK)的扩增和PTEN和CDKN2A的丢失,这些并不常见,但如存在通常见于IDH突变型胶质母细胞瘤。
IDH突变型星形细胞瘤的临床预后优于组织学匹配的IDH野生型肿瘤,Ⅱ级和Ⅲ级肿瘤的估计中位生存期分别为10.9年和9.3年。IDH突变型胶质母细胞瘤的预后明显较差,文献报道,标准治疗后总生存率为27~31个月。
【2】异柠檬酸脱氢酶(IDH)野生型胶质瘤的新亚型
IDH1/2野生型胶质瘤占原发性恶性脑肿瘤的50%以上,其中以胶质母细胞瘤最为常见。大量的基因组研究揭示了这些肿瘤惊人的多样性,尤其是好发于年轻患者的胶质瘤,这导致将几个新实体纳入2016年世界卫生组织中枢神经系统肿瘤分类中。
(1)弥漫性中线胶质瘤,H3 K27M突变型
这种遗传定义的高级别IDH野生型星形细胞瘤主要发生于儿童和年轻成人,包括原发性弥漫性桥脑胶质瘤。肿瘤出现在中线位置,即脑干、脊髓和丘脑,在H3F3A或HIST1H3B/C中具有确定的K27M(或者称为K28M)错义突变。
组织学上,这些肿瘤表现出浸润性生长模式和星形细胞形态(图1M)。高级别的特征通常是存在的,但是,他们不是必要的诊断,一些例子可能缺乏明显的核分裂象。OLIG2染色是一个一致的特征,尽管GFAP阳性不一并可能是有限的。抗H3F3A K27M的突变特异性抗体有助于诊断,显示出强而弥漫的核染色(图1P)。这种抗体也可以在巨噬细胞和其他炎症细胞中显示非特异性染色,需要仔细解释,有时还需要额外的验证性研究。由于赖氨酸27位点的突变也可能影响该残基的甲基化,三甲基组蛋白H3 K27(H3K27me3)的免疫染色丢失可与H3F3A K27M阳性结合使用,尽管仅H3K27me3的丢失对该肿瘤类型并不特异。TP53突变在这些肿瘤中很常见(~50%),约15%的病例与ATRX功能丧失突变同时发生(图1O)。然而,IDH1/2突变和IDH1 R132H阳性并不存在(图1N)。RTKs扩增也很常见,最常见的是PDGFRA、CDK4/6和CCND1-3。这种肿瘤的预后尤其不好,2年生存率<10%。
尽管该实体中需要H3 K27M突变,但必须注意的是,在部分非浸润性胶质瘤和神经胶质瘤中观察到该突变。表现为毛细胞型星形细胞瘤、神经节胶质瘤、甚至室管膜瘤典型组织病理学的肿瘤病例,其临床表现与弥漫性中线胶质瘤不同。许多这样的肿瘤在BRAF或FGFR1中含有额外的驱动突变/融合,并且似乎缺乏RTK扩增和肿瘤抑制因子的丢失。严格来说,具有非浸润性生长模式、WHO为IV级的H3 K27M突变肿瘤不应归类为弥漫性中线胶质瘤。
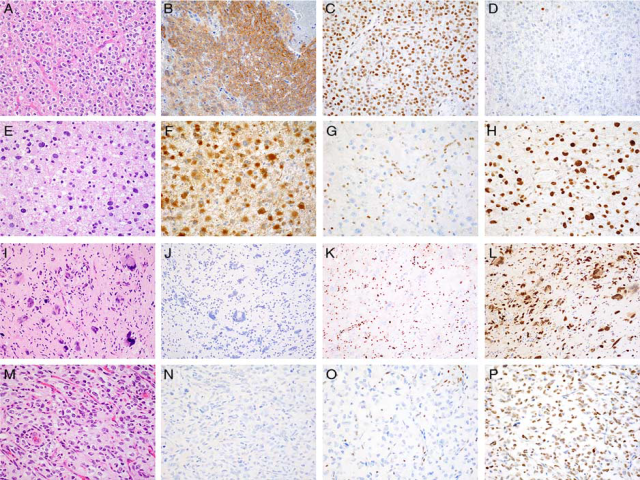
图1:IDH突变型和ATRX突变型胶质瘤的免疫组化研究。少突胶质细胞瘤,单一的肿瘤细胞呈圆形,可见核周空晕和纤细分支血管(A)。在大多数病例中免疫组化检测IDH1 R132H(B)的突变特异性抗体呈阳性。ATRX表达保留(C),p53染色显示散在的弱阳性细胞(D),两者均与各自基因缺乏突变一致。IDH突变型星形细胞瘤表现出更大的多形性和核深染(E),并表现出IDH1 R132H(F)、ATRX(G)和p53(H)的三重突变模式。偶尔IDH野生型胶质瘤,如巨细胞胶质母细胞瘤(I),可能显示ATRX(K)丢失和p53(L)上调,尽管没有IDH1 R132H突变(J)。弥漫性中线胶质瘤(M)可表现为多种形态,但通常表现为高级别的星形细胞形态。IDH1 R132H(N)呈阴性,可能显示ATRX(O)丢失;但突变特异性H3F3A K27M抗体呈细胞核阳性可作为诊断(P)。
(2)上皮样胶质母细胞瘤
作为IDH野生型胶质母细胞瘤的一个少见亚型,可发生于各个年龄段,这些高级别星形细胞瘤表现出以上皮样、横纹肌样或肥胖细胞形态为主的细胞(图2A)。胶质母细胞瘤的典型特征包括核分裂象增多,微血管增生和坏死也是诊断需要的。部分肿瘤在组织学上可能与间变性多形性黄色瘤型星形细胞瘤(即显示黄色瘤样改变和明显的核多形性)有重叠;然而,缺乏低级别多形性黄色瘤型星形细胞瘤或其他神经胶质瘤特征,包括Rosenthal纤维和嗜酸性颗粒小体。
肿瘤主要发生在大脑半球,但也有发生在侧脑室、深核和后颅窝的例子。在影像学上,肿瘤可能境界比较清楚,包括实性和囊性区域。
肿瘤细胞S100和GFAP通常呈阳性,但后者可能仅局限于病灶。细胞角蛋白和上皮膜抗原(EMA)的染色阳性也可见,需要鉴别诊断的疾病包括转移癌、黑色素瘤,甚至室管膜瘤。SMARCB1(INI1)阳性,肌源性和黑色素细胞标记通常为阴性。
大约一半的上皮样胶质母细胞瘤具有BRAF V600E突变,这可以通过VE1突变特异性BRAF V600E抗体检测到(图2B)。通过甲基化分析,伴多形性黄色瘤型星形细胞瘤的上皮样胶质母细胞瘤这一亚型,好发于儿童和年轻成人,且侵袭性稍低(总生存期为~34个月)。
缺乏BRAF突变的肿瘤在临床和遗传学上与普通型IDH野生型胶质母细胞瘤重叠。发生于老年人的肿瘤常表现为7q获得、10q缺失、CDKN2A纯合性缺失和TERT启动子突变,总生存期为11个月。BRAF野生型肿瘤好发生儿童和年轻成人,常表现为PDGFRA和MYCN的扩增,同时伴有10q缺失和染色体碎裂区。在这个亚型中没有观察到BRAF V600E和TERT启动子突变。这个亚型的预后也很差,中位总生存期为18个月。
(3)血管中心性胶质瘤
血管中心性胶质瘤通常发生在儿童和年轻成人的大脑皮质内,并有明显的T2高强度肿块病变,与难治性癫痫密切相关。肿瘤由浸润性单一形态的细长双极细胞群组成,偶尔形成特征性的血管周围假菊形团结构(图2C)。核分裂象通常很少见或无,未见微血管增生和坏死。
在遗传学上,这些肿瘤是由MYB重排定义的,MYB-QKI融合是最常见的,是由6q染色体中间缺失引起的。这些肿瘤的一个敏感标记是免疫组化检测MYB,显示出强而弥漫的表达(图2D);然而,在其他一些低级别胶质瘤中可以检测到局灶MYB的表达,必须谨慎解释。肿瘤细胞呈一致的GFAP和逗点状EMA阳性,提示可能是室管膜来源。
血管中心性胶质瘤被定为WHOⅠ级,手术切除通常可以治愈。
(4)由融合基因定义的室管膜瘤
迄今为止,室管膜瘤的诊断主要依赖于观察肿瘤的特征性形态,即在血管周围的假菊形团中排列有圆形至卵圆形细胞核的胶质细胞。尽管室管膜瘤细胞呈典型的GFAP和EMA逗点状阳性染色,但这种特征并不完全敏感或特异。然而,最近的研究显示,在正常组织、室管膜和脉络丛起源的肿瘤中,纤毛发生的主调节因子FOXJ1过度表达。因此,在所有亚型室管膜瘤和脉络丛肿瘤中,免疫组化检测FOXJ1是高度特异性的,在高级别病变中显示出某种程度的减少表达(图2H)。
室管膜肿瘤的亚分类在很大程度上依赖于典型的组织学特征和广泛的拷贝数改变。然而,皮质室管膜瘤,独特地表现出涉及RELA或YAP1的重现性基因融合事件。伴有RELA重排的室管膜瘤占幕上室病例的~70%,虽然许多病例发生于成人,但在儿童中是最常见的。
C11orf95-RELA转录是目前最常见的,产生C11orf95的外显子1-2与RELA的整个编码区框内融合。C11orf95或RELA可能表现出不同的融合伙伴,涉及11q13的染色体碎裂是一个常见的结果。由此产生的癌蛋白驱动RELA/p65的核移位和NF-κB通路的结构性激活,并上调下游靶基因,如L1CAM和CCND1。免疫组化显示L1CAM呈弥漫膜阳性,RELA/p65和CCND1在该肿瘤中为核染色阳性(图2F,G)。
与其他幕上室管膜瘤相比,5年总生存率为75%,临床表现更具侵袭性,初步报告强调检测RELA基因重排来识别室管膜瘤的重要性。
少数幕上室管膜瘤具有YAP1基因融合,最常见的是YAP1-MAMLD1。这种亚型主要发生于低龄儿童,迄今为止的报道,该肿瘤临床治疗效果好。
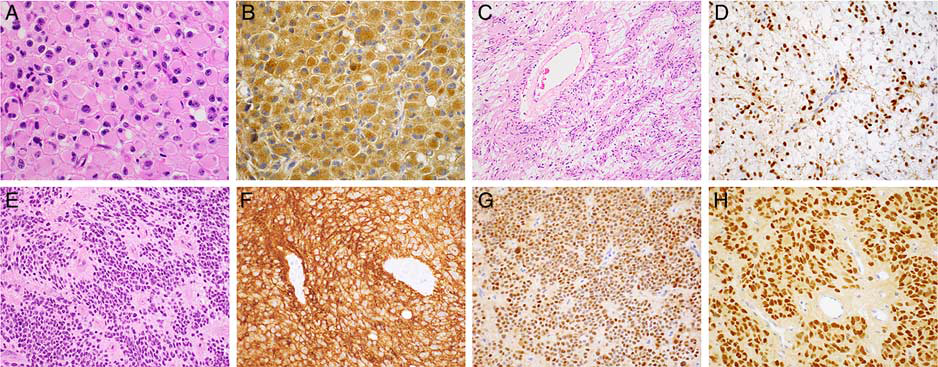
图2:胶质瘤新实体的诊断性免疫组织化学染色,上皮样胶质母细胞瘤含有上皮样、横纹肌样或肥胖星形胶质细胞,具有典型的高级别特征。缺乏低级别胶质瘤或神经胶质瘤特征,如Rosenthal纤维和嗜酸性颗粒小体(A)。免疫组化染色显示超过半数病例BRAF V600E呈阳性,预示着一个惰性过程(B)。血管中心性胶质瘤中细长的细胞呈纤维状,双极突起,偶尔形成血管周围的假菊形团结构(C)。免疫组化检测MYB(D)呈细胞核阳性染色可作为MYB-QKI融合基因的替代标记物。伴有RELA基因重排的室管膜瘤含有特征性的圆形至卵圆形细胞,排列在血管周围的假菊形团结构中(E),瘤细胞L1CAM(F)呈弥漫膜阳性和RELA/p65(G)呈细胞核阳性。FOXJ1细胞核阳性染色证实了该肿瘤为室管膜来源(H)。
【参考文献】
[1] Advances in Diagnostic Immunohistochemistry for Primary Tumors of the Central Nervous System.Adv Anat Pathol,2019.















共0条评论