[导读] 作者:慧海拾穗
间变性大细胞淋巴瘤临床病理和分子遗传学研究进展(一)
间变性大细胞淋巴瘤临床病理和分子遗传学研究进展(三)
【系统性ALK阳性间变性大细胞淋巴瘤(ALK+ALCL)】
三、免疫表型
根据定义,ALK+ALCL显示强而一致的CD30(细胞膜和高尔基区)和ALK阳性(图3)。由于ALK蛋白在包括淋巴结在内的大多数成熟细胞/组织中不正常表达,其免疫组化检测具有特异性,并证实肿瘤细胞存在涉及ALK基因的易位。然而,值得注意的是,其他非淋巴造血系统肿瘤也可发生ALK基因重排并表达ALK,如炎性肌纤维母细胞瘤,需要适当的免疫分型来确认诊断,排除非淋巴造血系统恶性肿瘤。ALK蛋白在淋巴瘤细胞中的定位因ALK重排的伴侣基因不同而不同,这将在随后的遗传学部分中描述(图3)。这种变异的临床意义尚不清楚,也与特定的组织学变异或预后无关。
ALK+ALCL被定义为一种成熟的T细胞淋巴瘤,通常表达一种或多种T细胞抗原,但也可缺乏T细胞表型,称为“裸”表型(“null” phenotype)。TCR基因在大多数情况下是克隆性重排的,即使在出现“裸”表型情况下,也能证实其T细胞起源。CD2、CD5和CD4最常表达(40~70%),而CD3在75%以上的病例中呈阴性。CD45阳性表达不一,而CD43是最常见的造血来源的标志物。肿瘤细胞表达细胞毒性标记物,包括TIA-1、粒酶B(granzyme B)和穿孔素,即使它们缺乏包括CD8在内的T细胞抗原(图4)。EMA表达常见,clusterin和BCL6在ALK+ALCL中也有高表达。极少数病例表达CD15,也有PAX5阳性表达的报道,对这些病例进行ALK蛋白表达的评估是避免误诊为经典型霍奇金淋巴瘤的关键。大约70~80%的ALK+ALCL表达CD99(题外话:CD99阳性肿瘤很多,如淋巴母细胞淋巴瘤、尤文肉瘤、横纹肌肉瘤、髓系肉瘤、卵黄囊瘤、差分化滑膜肉瘤、小细胞骨肉瘤、促结缔组织增生性小圆细胞肿瘤、小细胞癌、朗格汉斯细胞组织细胞增生症等等)。在高达90%~100%的ALK+ALCL表达髓系抗原(CD13和/或CD33)(约33%病例两者均有表达)。罕见情况下,结外ALK+ALCL表达MPO。EBV相关抗原和EBER在ALK+ALCL中始终呈阴性表达。
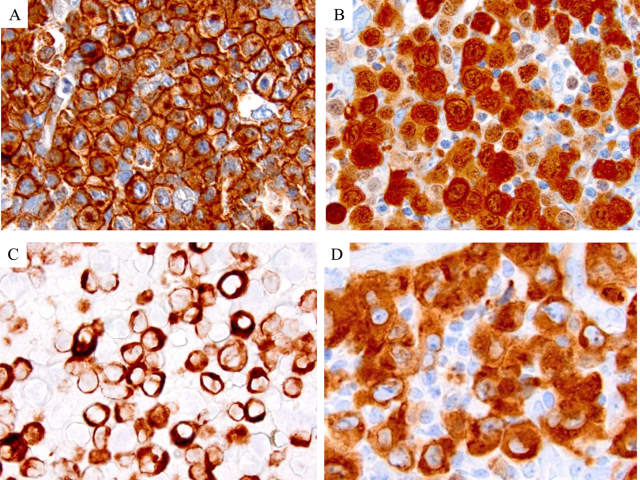
图3 ALK阳性ALCL的免疫组化特征:CD30在细胞膜和高尔基中强表达(A)。ALK在细胞核和细胞质中表达与NPM1-ALK基因融合有关(B)。ALK定位仅在细胞质中表明为NPM1以外的基因伴侣,(C)为PABPC1-ALK基因融合,(D)为EEF1G-ALK基因融合。
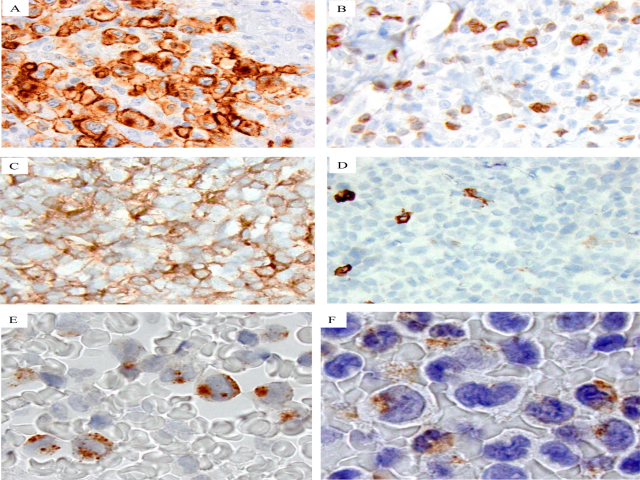
图4 ALK阳性ALCL的免疫组化特征:所有肿瘤细胞均呈EMA阳性(A)。本例(B)CD3阴性(正常小T细胞与肿瘤细胞混合)。本例CD4(C)阳性,CD8(D)阴性。在ALK+ALCL白血病期时,对外周血块切片进行免疫组织化学染色显示粒酶B(E)和TIA-1(F)阳性表达。
四、分子细胞遗传学
ALK位于2p23号染色体上,编码约177kDa的蛋白质,包括N端的两个MAM结构域、低密度脂蛋白a(LDL-a)结构域、跨膜结构域和C端的酪氨酸激酶结构域。全长ALK蛋白属于受体酪氨酸激酶的胰岛素受体亚家族,与白细胞酪氨酸激酶(LTK)同源。全长ALK的表达仅限于神经系统,并在小鼠的神经发育中发挥作用。全长ALK激酶的催化激酶功能的激活是由配体介导的受体二聚作用诱导的,导致激酶结构域的分子内转磷酸化和随后对细胞生长和增殖重要的下游信号的激活。
在ALK+ALCL中,ALK的异常表达是由于染色体2p23上ALK的3′部分与提供启动子的伴侣基因的5′融合,导致嵌合激酶(chimeric kinase)的组成性表达(constitutive expression)。ALK+ALCL的主要伙伴是核磷蛋白(NPM1),导致t(2;5)(p23;q35)易位和80kda融合蛋白NPM1-ALK的异常产生。对于常见的NPM1-ALK融合,由于NPM1-ALK和正常NPM1的异二聚作用,免疫组化检测ALK显示细胞核和细胞质染色,NPM1-ALK是一种广泛表达并在细胞质和细胞核之间穿梭的核仁磷酸蛋白。大约15%的ALK+ALCL病例缺乏核染色模式,表明异常的ALK表达是由于NPM1以外的伙伴基因引起的。例如TMP3(ALK为细胞膜和细胞质强阳性)、ATIC(ALK为细胞质弥漫阳性)、TFG(ALK为细胞质弥漫阳性)、CLTCL(ALK为细胞质颗粒状阳性)、MSN(ALK为细胞膜阳性)、TPM4(ALK为细胞质弥漫阳性)、MYH9(ALK为细胞质弥漫阳性)、ALO17(ALK为细胞质弥漫阳性)和TRAF1(ALK为细胞质弥漫阳性)等。
尽管ALK基因融合是ALK+ALCL发病机制中的一个关键致癌事件,但也有人描述了额外的遗传失衡。经比较基因组杂交(CGH)序列分析,58%的ALK+ALCL表现出染色体不平衡,包括4q13-q28、6q13-q22、11q14-q23和13q的丢失和7p11-pter和17.61号染色体的增加,35%的ALK+ALCL表现出17p13.3-p12和6q21的丢失,15%的病例表现出1q、7q32.3和7p22.3-p21.3的增加。在ALCL模型中,位于6q21的PRDM1基因被证明是一个抑癌基因,但在ALK+ALCL中与ALK-ALCL相比,其失活频率较低。这些额外的改变在疾病的发病机制和预后方面的意义尚不清楚,需要进一步的研究,扩大ALK+ALCL样本量并运用下一代测序方法,以便更好地定义ALK+ALCL的基因组景观。这些研究的发现对于理解ALK+ALCL组织学和临床异质性的生物学机制具有重要意义。
【参考文献】
[1] Pathology and genetics of anaplastic large cell lymphoma[J]. Seminars in Diagnostic Pathology.2019.















共0条评论