编译整理:强子
肺部真菌类病变大盘点-(一)真菌感染诊断概要
肺部真菌类病变大盘点-(二)耶氏肺孢子菌
肺部真菌类病变大盘点-(四) 新型隐球菌、荚膜组织胞浆菌、球孢子菌
肺部真菌类病变大盘点-(五) 皮炎芽生菌、念珠菌、毛霉菌、申克孢子丝菌复合体
曲霉菌
(Aspergillus)
免疫抑制患者另一类最重要的感染即曲霉菌感染。曲霉菌广泛分布于土壤中,可通过吸入而感染。肺移植患者感染曲霉菌后最常见的特征为支气管吻合处发生坏死性炎症,一般发生于移植后4个月内。
一般说来肺部曲霉菌感染有三种类型,(1)定植(形成曲霉菌球);(2)超敏反应(如前述过敏(变应)性支气管肺曲霉菌病(allergic bronchopulmonaryaspergillosis,ABPA),嗜酸细胞性肺炎,黏液嵌塞,过敏性肺炎);(3)侵袭性肺曲霉菌病(invasive pulmonary aspergillosis,IPA)。
曲霉菌定植于肺内原有空腔时则形成曲霉菌球,此空腔可以是已愈合的结核,也可是肺气肿、结节病、支气管扩张、梗死,甚至是空腔样改变的肿瘤(如鳞状细胞癌)。这种情况下的曲霉菌球一般无侵袭性,其内为菌丝、纤维组织、黏液及碎屑等。临床上患者可无症状,可能仅为偶见;也可表现为咳血、发热、体重减轻。临床有时会诊断为肿瘤性病变。影像学表现为伴空腔的球形结构,但患者体位改变时球形病变的位置可能会发生变动。
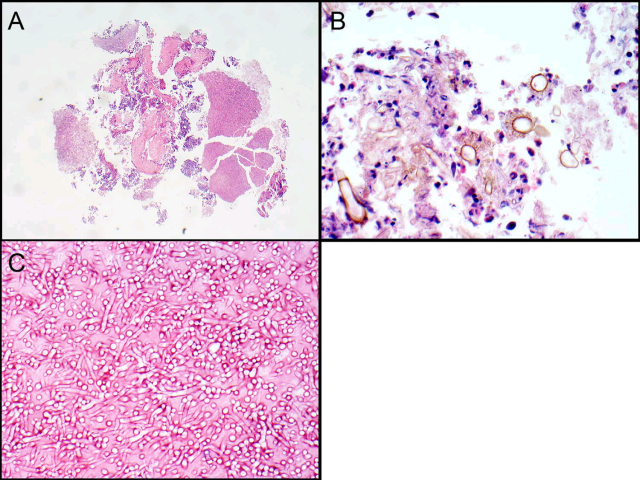
图5. 曲霉菌球。支气管镜活检,见碎屑状组织,高倍观可见具有黄色分支状孢子头的真菌,形态学符合黑曲霉(Aspergillusniger)。淡染组织处可见大量呈锐角分支的菌丝,菌丝一端可见孢子。
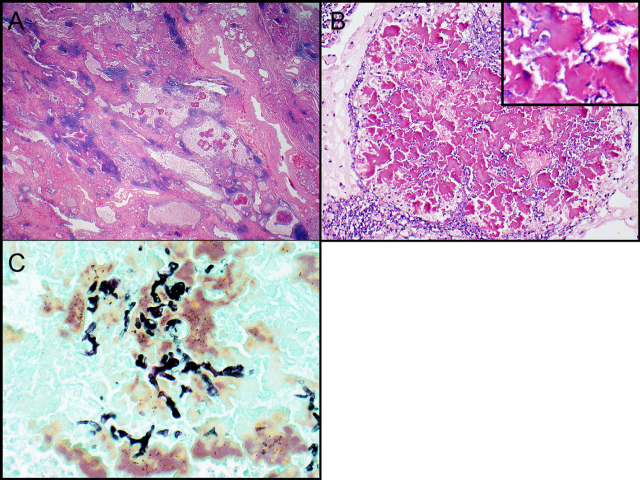
图6. 曲霉菌球。支气管扩张,肺实质纤维化。扩张的气道内可见结晶状物质,其内为退变的真菌类物质。六铵银染色可见菌丝呈锐角分支,符合曲霉菌。该例本次活检组织进行培养,结果阴性;但此前曾有培养结果,证实为烟曲霉(Aspergillusfumigatus)。
过敏(变应)性支气管肺曲霉菌病是机体对真菌类抗原的超敏反应,烟曲霉类更加明显。也正是因为这仅仅是一种超敏反应,因此可能很难见到病原体,甚至六铵银染色也为阴性。该病的诊断包括诸多指标,如哮喘病史、肺部浸润性病变、中央型支气管扩张、嗜酸性粒细胞增多、血清IgE升高、特异性IgE及IgG升高、病原体培养结果为阳性、速发性皮肤试验阳性等;还有相关诊断标准将这些指标分为了主要指标、次要指标,具体可参阅相关著作。
大体检查扩张的支气管内常见黏液嵌塞。显微镜下支气管及细支气管内黏液显著。这些黏液一般为分层状,且有嗜酸性粒细胞碎屑,并可见嗜酸性Charcot-Leyden结晶。也可发生嗜酸细胞性肺炎。气道周围可见肉芽肿。
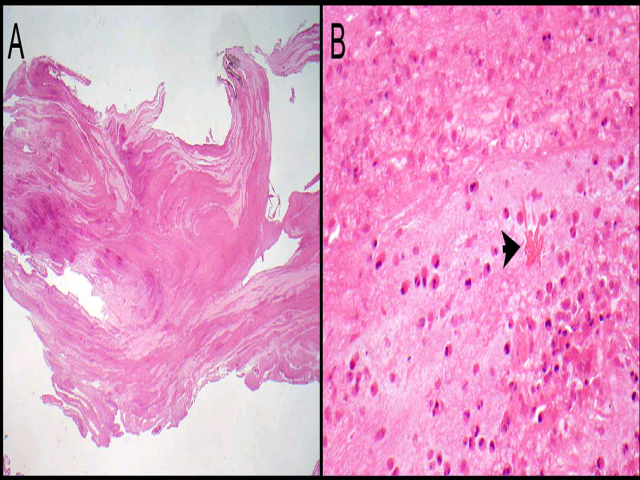
图7. 超敏反应中的黏液,呈分层状粉染物,其中含有嗜酸性粒细胞、细胞碎屑及Charcot-Leyden结晶(右图箭头)。
侵袭性肺曲霉菌病常危及生命,因此病理准确诊断非常关键。该病主要发生于免疫抑制患者,可导致肺梗死及出血。如其名字所示,特点即侵袭组织和/或血管。急性侵袭性病变可表现为“靶环样”:大体病变一般表现为中央灰白色坏死区,周围为一圈出血灶;显微镜下表现为伴血管受累的结节状梗死灶,可见真菌菌丝。真菌菌丝充满肺动脉的管腔内,因此形成梗死灶。少数病例也可发生粟粒状微脓肿。曲霉菌还可导致慢性坏死性肉芽肿性炎,此时在坏死灶及受累的肺实质内一般可检出病原体,但这种情况下血管受侵并非其显著特点。
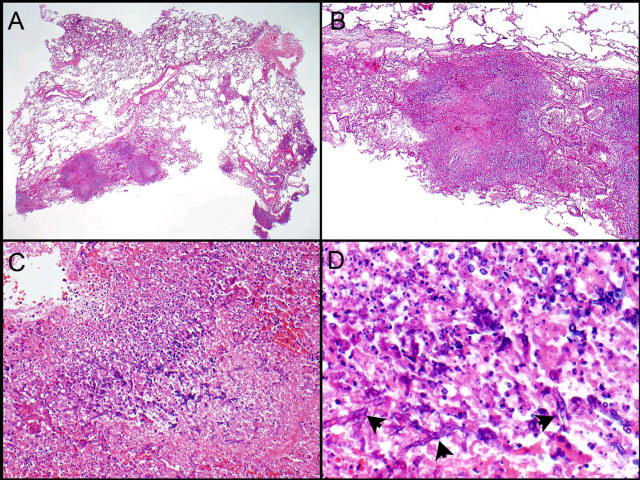
图8. 侵袭性肺曲霉菌病。肺活检可见结节状病变,高倍观结节主要为坏死组织碎屑;但坏死碎屑内可见呈锐角分支的菌丝。
曲霉菌的特点是菌丝均匀分隔,呈45°分支。曲霉菌、尤其黑曲霉感染时也可伴折光的草酸钙结晶。病灶中的曲霉菌与空气接触时,可形成分支状孢子头(如图5)。慢性坏死性曲霉病(肉芽肿性病变)时,菌丝周边可出现放射状排列的嗜酸性物质,即Splendore-Hoeppli现象。
除非形态学极为典型,否则仅凭组织学检查可能无法可靠鉴别曲霉菌与其他形态类似的真菌,必要时应进行微生物培养。某些形态类似的病原体可能会多药耐药,而抗真菌治疗后的曲霉菌也会出现一系列形态学改变,因此这一鉴别意义重大。本文作者提出如下报告模板:“查见无色素的细长、分支状菌丝。需鉴别曲霉菌、镰刀菌(fusarium)、假阿什利菌(pseudoallescheria);请结合临床表现及微生物培养结果”;或“查见含色素的菌丝,建议微生物培养明确具体种属类别”。
点击下载英文文献
参考文献
Roden AC.Histopathology of fungal diseases of the lung[J].Seminars in diagnostic pathology,2017,34(6):530-549.
DOI:10.1053/j.semdp.2017.06.002

















共0条评论