成人囊性肾肿瘤的诊断和鉴别诊断
来源:《中华病理学杂志》 , 2015 , 44 (11) :815-820
作者:赵明,何向蕾,滕晓东(浙江大学医学院附属第一医院病理科)
成人肾肿瘤的组织学和遗传学分类经历了多次演进,最新的分类共识是2012年国际泌尿病理协会(ISUP)提出的温哥华肾肿瘤分类[1,2]。在病理医师的日常实践诊断过程中,根据主要的组织结构和细胞形态的不同,成人肾肿瘤一般可归类为透明细胞为主、嗜酸细胞为主、乳头状结构为主和囊性结构为主的几种类型。从理论上来讲,各种肾肿瘤都可在大体上和光镜下出现不同程度的囊性变,其中一方面可能是分子事件参与的结果,比如说VHL基因突变促成囊性透明细胞肾细胞癌的形成;另一方面,肾肿瘤特别是肾细胞癌是一个高度富于血管间质的肿瘤,在肿瘤的生长和演化的过程中,瘤细胞破坏血管间质导致出血、缺血/组织坏死、退变进而出现囊性变。最后,某些肾肿瘤中内陷的非肿瘤性肾小管在局部因子的作用下可发生囊性扩张。单纯从组织结构来讲,常见的成人囊性肾肿瘤一般可有两种构型,一种是由上皮和间质混合构成,如混合性上皮间质肿瘤(包括囊性肾瘤)、血管平滑肌脂肪瘤伴上皮囊肿、滑膜肉瘤、血管平滑肌腺瘤样肿瘤(又称为肾细胞癌伴有血管平滑肌瘤样间质);另一种是各种不同类型的囊性肾细胞癌,如多房囊性肾细胞癌(又称为低度恶性潜能的多房囊性肾细胞肿瘤)、囊性部分退变的透明细胞肾细胞癌、管状囊状肾细胞癌、获得性囊性肾疾病相关的肾细胞癌、透明细胞(管状)乳头状肾细胞癌等。由此可见,成人囊性肾肿瘤在组织形态上存在明显的异质性,包括了各种良恶性肾细胞肿瘤以及非肾细胞来源的肿瘤,准确的诊断和区分具有重要的临床病理意义。因此,我们主要介绍这一类囊性肾肿瘤的诊断和鉴别诊断方法,以提高病理医师对该类肿瘤的认识。
一、由上皮和间质混合构成的成人囊性肾肿瘤的分类和诊断
1.混合性上皮间质肿瘤(mixed epithelial and stromal tumor, MEST)/囊性肾瘤(cystic nephroma,CN)
在2012年ISUP温哥华肾肿瘤分类中,MEST与CN被认为是同一病变的两种不同的组织学变异型[1,2]。原因在于MEST与CN在临床表现、组织形态学特点、免疫表型和遗传学特征方面存在明显的相似性。两者均明显好发于围绝经期中年女性,组织学上均由囊性扩张的上皮和致密的梭形或卵巢样间质组成,免疫组织化学染色间质细胞均不同程度表达雌、孕激素受体(ER和PR),基因表达谱系分析揭示MEST与CN具有明显的遗传学聚类性[3]。临床上较小的MEST/CN通常无症状,常为偶然发现,较大的肿瘤可表现为腹痛、血尿以及季肋部肿块。绝大多数患者为女性或常有外源性女性激素使用史提示女性激素在肿瘤发生过程中的关键作用。大体上,MEST/CN通常位于肾中央,肿瘤界限清楚,但无包膜,瘤体直径2~24 cm不等(平均8 cm),切面上CN几乎完全由薄壁囊肿构成,而MEST则为囊实性。组织学上,CN几乎均由大小不等的薄壁囊肿构成,缺乏实性成分,囊壁衬覆单层扁平/立方细胞或鞋钉样细胞,间质为少细胞的纤维性间质或致密的类似于卵巢皮质的短梭形间质。而MEST的上皮和间质则可表现出明显的组织学异质性,囊肿可呈腺管/小囊、微囊到巨囊不等。内衬上皮可从扁平/立方状细胞、鞋钉样细胞到柱状上皮或尿路上皮,罕见情况下为类似于呼吸道的纤毛柱状上皮,囊肿上皮胞质稀少或嗜酸性,偶尔可为透明细胞。MEST的上皮增生有时可形成实性细胞巢或为突向囊腔的具有复杂分支的管状或乳头状结构,后一特征性的组织学表现对于MEST具有诊断意义(图1)[3]。MEST的间质可表现为少细胞的玻璃样间质、致密的卵巢样间质、平滑肌瘤样间质或为非特异性的梭形细胞间质,罕见情况下可出现小梁和条索状细胞巢类似于卵巢的性索样间质[4]。间质其他的伴随特征包括脂肪化生、黏液变性、钙化和骨化等。新近,Kum等[5]应用显微切割激光捕获技术对MEST的上皮和间质成分的X染色体进行分析发现,两者具有相似的X染色体失活模式(包括随机的和非随机的),这一研究结果提示MEST的上皮和间质具有共同的组织起源,均为肿瘤的组成成分。免疫表型特征,MEST/CN的上皮细胞表达PAX8、PAX2以及CK7;间质细胞表达ER、PR和平滑肌肌动蛋白(SMA)。一般来说PR表达比ER更弥漫,在非卵巢样间质中ER和PR表达减少。MEST与CN相比,ER和PR表达更弥漫和广泛。平滑肌样间质除了表达SMA之外还表达结蛋白,性索样间质表达抑制素和钙网蛋白(calretinin)。MEST/CN绝大多数为良性肿瘤,非常罕见的情况下可发生恶性转化,恶性变常发生于间质成分,组织学上一般表现为非特异性的间叶性肉瘤。到目前为止,文献上仅报道1例上皮成分恶变的MEST,恶变为乳头状肾细胞癌[6]。
2.血管平滑肌脂肪瘤伴上皮性囊肿形成(angiomyolipoma with epithelial cysts, AMLEC)
AMLEC又称为囊性血管平滑肌脂肪瘤(cystic AML),是AML的一种罕见的组织学变异型。由Fine等[7]和Davis等[8]两个独立的研究小组于2006年首先报道,在美国陆军病理研究所(AFIP)30余年(1970–2004年)内诊断的1 064例肾脏AML中仅发现11例AMLEC,仅约1%[8]。到目前为止,文献中仅有不超过20例的报道。临床表现与普通的AML相似,发病年龄20~76岁,平均45岁;与MEST明显好发于女性不同,AMLEC仅有轻度的女性好发倾向,男女比约为2∶3。患者通常无外源性女性激素使用史。目前所报道的肾脏AMLEC均为单侧单发病变,肿瘤直径1.3~6.0 cm(平均约4.0 cm)。大体切面以实性为主伴有散在的囊性变。2012年ISUP温哥华肾肿瘤分类也正式讨论了AMLEC独特的组织形态学和免疫表型特征[1]。组织学上AMLEC的囊肿壁由截然分层的3种成分构成(图2):
(1)最里层为被覆单层扁平/立方,偶尔为鞋钉样上皮的囊肿;
(2)紧邻囊肿的是上皮下的薄层“生发层样”间质,由致密的富于细胞的苗勒样短梭形细胞组成,其内可见散在的慢性炎性细胞浸润;
(3)上皮下间质之外是厚的长梭形或上皮样肌样间质,胞质嗜酸性或浅染,呈不规则或模糊束状排列,常见围绕畸形的厚壁血管生长;此外,肌束之间可见丰富的裂隙状的淋巴管分割,组织学上类似于淋巴管平滑肌瘤病[8]。肌样间质内常见内陷的肾小管结构但一般无脂肪成分。免疫表型特征,AMLEC囊肿衬里上皮表达PAX8、PAX2以及CK7[9];上皮下“生发层样”间质弥漫强表达HMB45(图3),Melan A、CD10、ER、PR,不表达SMA和结蛋白;外层肌样间质则相反,弥漫表达SMA和结蛋白,仅偶尔或散在表达HMB45、MelanA、ER和PR。AMLEC组织发生机制还不明确,与MEST中上皮成分表现出明显的细胞和结构的异质性不同,AMLEC的上皮成分通常仅为单纯的囊肿,被覆单层扁平/立方或鞋钉样细胞,免疫组织化学表达远端肾单位标志物荆豆凝集素(soy bean agglutinin),提示这些囊肿可能是肿瘤内陷的集合管发生囊性扩张所致[7]。上皮下的“生发层”样间质具有子宫内膜间质的形态学和免疫表型特征(CD10/ER/PR弥漫阳性),弥漫表达黑色素标志物(HMB45/Melan A弥漫阳性),常见明显的炎性细胞浸润。外层肌样间质的形态学和免疫表型特征(上皮样或透明细胞,畸形血管,SMA/结蛋白弥漫阳性,HMB45/Melan A局灶阳性)符合典型的平滑肌样间质为主的AML。从这些证据Fine等[7]推测AMLEC的可能形成机制,平滑肌瘤样间质为主的AML中内陷的远端肾小管因肿瘤梗阻而发生囊性变,囊内内容物溢出从而引起炎症反应。上皮性囊肿的形成诱导其下的AML间质出现苗勒间质的分化而逐渐失去肌样分化的特点和表型。关于AMLEC的确切形成机制还需要进一步的研究来予以阐明。生物学行为上目前所报道的所有病例均表现为良性进程。
3.滑膜肉瘤(synovial sarcoma)
肾脏原发性滑膜肉瘤由Argani等[10]在2000年首次报道,之前的病例曾被冠以“成人胚胎性肉瘤”的名称予以报道。肾脏滑膜肉瘤在发病年龄、性别等流行病学方面与发生于躯体其他部位的滑膜肉瘤相似。好发于男性,发病年龄17~78岁(平均约46岁),肿瘤体积通常比较大,呈破坏性生长,大体上将近70%的病例可呈现不同程度的囊性变。组织学上,几乎所有报道的病例均为单相型梭形细胞滑膜肉瘤,致密的未分化短梭形肿瘤细胞呈交错束状排列,常见血管外皮瘤样生长方式,核分裂象活跃,坏死常见。多数肿瘤内可见散在分布的小管或大小不等的囊肿,被覆为单层低柱状或鞋钉样形态温和的上皮[11]。免疫表型特征,肾脏滑膜肉瘤一致性的弥漫表达bcl–2和TLE1(滑膜肉瘤一种敏感性强而特异性稍差的诊断标志物),局灶性表达广谱CK和上皮细胞膜抗原(EMA)[10,11]。肿瘤内的小管和囊肿的被覆上皮表达PAX8和PAX2而不表达TLE1证实这些囊肿为内陷的肾小管扩张所致而非滑膜肉瘤腺样分化的证据[9,11]。因此,2012年的ISUP温哥华肾肿瘤分类将滑膜肉瘤从混合性上皮间质肿瘤的范畴中划出,归入间叶性肿瘤范畴内[1,2]。遗传学上,大多数肾脏的滑膜肉瘤存在SYT–SSX2基因的融合,这与其单相型梭形细胞的组织学形态相匹配[11]。生物学行为高度恶性,常见远处转移或因疾病死亡。
4.肾脏血管平滑肌腺瘤样肿瘤(renal angiomyoadenomatous tumor,RAT)
RAT是由上皮性小管和成熟的血管平滑肌瘤样间质构成的一种具有独特组织形态学特征的肾肿瘤,由Michal等[12]于2000年首次报道。此后,类似的病变在文献报道中曾被冠以各种名称,如“肾细胞癌伴有显著的血管平滑肌样增生”、“肾细胞癌伴有血管平滑肌瘤样间质”、“肾细胞癌伴有区域类似于RAT”以及“透明细胞乳头状肾细胞癌伴有血管平滑肌瘤样间质”。因此,关于RAT是否是一种疾病实体及其与透明细胞肾细胞癌和透明细胞(管状)乳头状肾细胞癌之间的关系一直争议不断。新近,两个独立小组的大宗病例研究结论表明,RAT与透明细胞(管状)乳头状肾细胞癌在临床表现、组织形态学、免疫表型以及分子遗传学特征上存在明显的相似和重叠,支持两者为同一肿瘤的不同形态学亚型[13,14]。RAT好发于中老年男性,中位年龄约60岁,临床上肿瘤多为偶然发现,少数表现为腹痛或血尿,偶尔发生于终末期肾疾病(ESRD)。大体上,RAT直径较小,从1.0~3.5 cm不等,切面实性为主,可见不同程度的囊性变,常见厚的纤维性假包膜。RAT的镜下表现取决于上皮与间质的比例,后者的比例有时可达95%。肿瘤周边一般为厚的致密的平滑肌束,平滑肌细胞分化成熟,具有明显的嗜酸性胞质,常见厚薄不等的血管性间质。肿瘤的中央为上皮成分,具有透明或弱嗜酸性胞质,排列成致密的腺泡/小管或大小不等的囊肿包被于致密的血管平滑肌瘤样间质之中,囊肿内可见突向囊腔的分支乳头状结构(图4)。上皮细胞的核级别低,一般为Fuhrman 1级或2级,偶尔可见细胞核远离小管的基底部朝向腔面分布,形成类似于分泌期子宫内膜的核下空泡。免疫表型特征,上皮细胞弥漫表达PAX8、CK7、碳酸酐酶Ⅳ(CAⅣ)、波形蛋白以及高相对分子质量角蛋白(34βE12),局灶或弱表达CD10,不表达肾细胞癌抗原(RCCm)和α–甲酰基辅酶A消旋酶(AMACR);血管平滑肌样间质弥漫表达SMA和结蛋白,不表达HMB45、Melan A以及ER和PR。分子遗传学研究表明RAT无透明细胞肾细胞癌常见的第3号染色体短臂缺失和乳头状肾细胞癌常见的第7号和第17号染色体的三体性以及Y染色体的丢失。RAT在生物学行为上是一种惰性肿瘤,目前所报道的病例在随访中均未见肿瘤复发或转移的证据[13,14]。
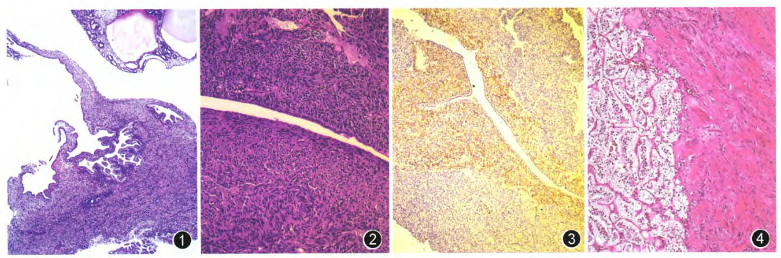
图1 混合性上皮间质肿瘤,囊肿被覆上皮呈分支乳头状增生凸向囊腔 HE 低倍放大
图2 血管平滑肌脂肪瘤伴上皮性囊肿形成(AMLEC),囊肿壁三层结构:最里层为被覆单纯立方/柱状上皮的囊肿;邻近上皮下为一薄层“生发层样”间质;最外层为致密的束状平滑肌样间质,肌束之间可见丰富的淋巴管裂隙 HE 高倍放大
图3 AMLEC上皮下“生发层样”间质弥漫表达HMB45,而外层平滑肌样间质仅散在表达 EnVison法 中倍放大
图4 肾脏血管平滑肌腺瘤样肿瘤,肿瘤由致密的透明小管和成熟的血管平滑肌样间质构成 HE 中倍放大
二、由上皮和间质混合构成的成人囊性肾肿瘤的鉴别诊断
如前所述,由上皮和间质混合构成的成人囊性肾肿瘤的组织形态学谱系宽广,可存在不同程度的重叠,生物学行为可从良性、低度恶性到高度恶性不等。诊断和鉴别诊断时需综合考虑临床表现、形态学和免疫表型以及分子遗传学特点。组织学鉴别诊断时需同时考虑到上皮和间质的特征及其之间的相互关系。图5简要的概述了这一类囊性肾肿瘤的鉴别诊断思路和方法。

图5 由上皮和间质混合构成的成人囊性肾肿瘤的鉴别诊断思路和方法
三、成人囊性肾细胞肿瘤的分类和诊断
1.多房囊性肾细胞癌(multilocular cystic renal cell carcinoma, MCRCC)/低度恶性潜能的多房囊性肾细胞肿瘤(multilocular cystic renal cell neoplasm of low malignant potential)
MCRCC是一种完全由囊肿和透明细胞构成的罕见类型的肾细胞肿瘤,占所有肾细胞癌的比例不超过5%[15]。发病年龄20~76岁(中位年龄约60岁),男女发病率之比约为2.5∶1.0。临床上多数患者无症状常为偶然发现。影像学上常表现为复杂的囊性肿块伴局灶钙化。大体上直径0.5~13.0 cm不等,切面肿瘤界限清楚,几乎完全为囊性,囊肿直径大小不等互不交通,囊壁平滑,内容清亮或血性液体。囊壁间隔薄,无实性膨胀性结节。组织学上,囊肿被覆单层透明或弱嗜酸性的上皮,少数可为复层,偶尔可见上皮呈低乳头状增生突向囊腔,有些囊壁无上皮衬覆(图6)。上皮细胞核级别低,通常为Fuhrman1级,偶尔可为2级。囊肿间隔为少细胞的富于血管的纤维性间质,常见水肿及慢性炎性细胞浸润,偶见钙化或骨化。间隔内可见小簇状的肿瘤细胞灶,但不形成膨胀性的实性细胞巢。免疫表型特征,MCRCC一致性的表达PAX8、EMA、CAⅨ,大多数表达CK7,半数左右表达CD10和波形蛋白[16]。分子遗传学研究表明MCRCC存在VHL基因突变以及第3号染色体短臂的缺失,支持其为透明细胞RCC的一种囊性组织学亚型[17]。MCRCC在生物学上表现为惰性进程,文献中报道的有随访资料的所有病例在肿瘤完整切除的情况下均未见肿瘤复发或转移的证据,因此2012年ISUP肾肿瘤共识分类推荐将MCRCC更名为“低度恶性潜能的多房囊性肾细胞肿瘤”,并且要求诊断这一肿瘤需要广泛的取材并遵循上述严格的组织学标准[1,2]。
2.囊性部分退变的透明细胞肾细胞癌(cystic partially regressed clear cell RCC)
透明细胞肾细胞癌常见出血、坏死以及囊性变,罕见的情况下广泛的出血坏死可导致肿瘤出现广泛的退变或囊性变[18]。囊性部分退变的透明细胞肾细胞癌大体上表现为多房性囊肿,与MCRCC不同的是,囊肿间隔的厚薄不均匀,较厚的区域仔细检查常可发现小灶的灰黄实性结节。组织学上,囊壁衬覆与MCRCC一样多数为低核级透明细胞,间隔内的肿瘤细胞呈小灶状至实性结节状分布不等,间质通常为厚的少细胞的玻璃样或瘢痕样间质,偶尔可为富于细胞的肌纤维母细胞性间质,常见含铁血黄素沉积、Gamna–Gandy样小体以及营养不良性钙化,这些组织学特征均为普通型透明细胞肾细胞癌退行性变的证据。因此,即使在一个广泛囊性退变的透明细胞肾细胞癌的玻璃样间质中未能找到膨胀的实性透明细胞巢也不应将其误诊为MCRCC[18],因为按照严格的诊断标准MCRCC的囊肿间隔为薄壁的少细胞性纤维性间质,其囊肿的形成为肿瘤固有的生长方式而非肿瘤发生退行性变的结果。尽管目前有限的随访证据表明囊性部分退变的透明细胞肾细胞癌具有较好的预后,但其确切的生物学行为尚需要进一步的研究阐明。
3.管状囊状肾细胞癌(tubulocystic RCC, TCRCC)
TCRCC是新近认识的一种少见类型的肾细胞癌[19],过去类似的病例曾在文献中被报道为“低级别集合管癌”或“集合管上皮瘤”,但现在认识到该肿瘤与集合管癌并无关联,因此在2012年ISUP肾肿瘤分类中,TCRCC被正式认定为肾细胞癌的一种独立的组织学亚型[1]。TCRCC明显好发于男性,男女发病率之比在7∶1以上;发病年龄18~94岁(平均年龄约60岁)。大体上表现为位于肾皮质的界限清楚的灰白囊性肿块,常见包膜。切面几乎完全由薄壁的半透明囊肿组成,状似“泡沫塑料纸”。组织学上,TCRCC由比例及大小不等的小管及囊肿构成,部分病例中的囊肿内可见瘤细胞呈分支乳头状增生突向囊腔,类似于乳头状肾细胞癌(图7)[20]。囊壁衬覆单层立方、鞋钉样至柱状的嗜酸性肿瘤细胞,核级别高,核仁明显,通常为Fuhrman 3级。囊肿间隔为薄的少细胞纤维性间质,偶尔可见慢性炎细胞浸润。免疫表型特征,TCRCC弥漫表达PAX8、CK19、CD10、AMACR(图8)以及波形蛋白,半数表达PAX2、CAIX,少数表达CK7和34βE12。荧光原位杂交(FISH)分析表明TCRCC存在第7号和第17号染色体的获得以及Y染色体的丢失,提示其与乳头状肾细胞癌存在密切的关系[20]。如前所述,在组织形态学上TCRCC可与乳头状肾细胞癌共存,两者具有相似的免疫表型和遗传学特征,这些证据均表明TCRCC与乳头状肾细胞癌可能是同一肿瘤的不同表现形式,TCRCC有可能是乳头状肾细胞癌的一种多囊性变异型,正如多房囊性肾细胞癌是透明细胞肾细胞癌的一种多囊性变异型一样[19]。2012年ISUP肾肿瘤分类中指出,由于多种肾细胞癌中可局灶性存在TCRCC样生长方式,因此诊断TCRCC需要遵循上述严格的标准,包括其大体和镜下的特征[1]。生物学行为上,大多数TCRCC表现为惰性的临床进程,少数病例(<10%)可出现局部复发或远处转移。罕见的情况下可出现肉瘤样分化灶或差分化灶并表现出侵袭性的临床进程[21]。
4.获得性囊性肾病相关的肾细胞癌(acquired cystic disease–associated RCC,ACD–RCC)
终末期肾病患者容易罹患肾肿瘤,特别是在接受长期透析而伴有获得性囊性肾病时肾肿瘤的发病率明显上升,其中最常见的组织学类型为ACD–RCC(约占46%)[22]。ACD–RCC大多数为在透析随访过程中由影像学检查偶然发现,将近半数为多灶发生,1/5为双侧发生[23]。大体上常表现为起源于囊肿的实性结节或表现为囊肿附近的实性肿块,界限相对清楚,常见纤维性包膜;切面质地软,常见出血和坏死。组织学上,ACD–RCC显示多种结构和生长方式,可见腺泡/小管、微囊、巨囊、乳头状以及实性片状的组织构型。瘤细胞大多数具有丰富的嗜酸性胞质,偶尔可为透明胞质,核级别高可见明显的核仁。ACD–RCC的一个特征性的组织学表现为瘤细胞内和细胞之间可见大量小的圆形或不规则空腔,使肿瘤呈现一种筛状或裂隙样的低倍观(图9)[19]。另外一个特征性的表现为肿瘤内可见不规则的草酸钙结晶物沉积(图10)[19,22,23]。ACD–RCC的诊断和鉴别诊断主要依靠其特征性的组织形态学表现,免疫组织化学染色作用有限,大多数肿瘤弥漫表达AMACR,不表达或仅局灶表达CK7,其他报道的可表达的标志物包括CD10、RCC、CD57等。由于大多数ACD–RCC是在慢性肾病患者长期随访过程中偶然发现而早期诊断的,因此预后相对较好,罕见的情况下可出现肉瘤样或横纹肌分化而发生转移[1]。
5.透明细胞(管状)乳头状肾细胞癌[clear cell (tubulo)papillary RCC, CCPRCC]
CCPRCC最初在与ESRD相关的肾细胞癌中被描述,但后来的研究发现大多数的CCPRCC为散发性的[14]。尽管CCPRCC相对罕见,占所有肾细胞癌的比例不超过5%,但新近的证据表明其为继透明细胞肾细胞癌、乳头状肾细胞癌、嫌色细胞肾细胞癌之后第四常见的肾细胞癌类型[24],是2012年ISUP肾肿瘤分类正式承认的另一肾细胞癌亚型[1]。CCPRCC好发于成年人(18~93岁,平均约60岁),无男女好发倾向。大体上通常界限清楚,可见包膜,肿瘤直径0.5~8.2 cm(平均2.6 cm),切面囊实性,半数左右的病例可见不同程度的囊性变(从10%至95%不等)。绝大多数为单侧单发,偶见多发或双侧发生。组织学上,CCPRCC常见四种结构和生长方式,按照其出现的频率依次为小管状、乳头状、管囊状以及实性巢状,大多数病例为4种组织学类型的混合,其中最常见为小管状和管囊状结构伴有起源于囊肿的乳头状结构的组合(图11)。瘤细胞以透明细胞为主,偶尔可为嗜酸性细胞,核级别绝大多数为Fuhrman1级或2级,偶尔可为3级[14]。CCPRCC的小管常为伸展或狭长的,平行排列或弯曲成角镜下观状似“鲨鱼的微笑(smile of a shark)”(图12)。乳头具有纤维血管轴心,短而纤细,分支不复杂。乳头或单独存在,或起源于不同大小的囊肿。实性区肿瘤细胞巢排列致密,胞质稀少而弱嗜碱性。70%左右的CCPRCC中可见到小管被覆瘤细胞的细胞核远离基底部朝向腔面呈线状分布,产生类似于分泌期子宫内膜腺体中见到的核下空泡,但这一形态学特征并非CCPRCC所特有,在某些透明细胞肾细胞癌亦可见到[1,14]。CCPRCC的间质比例多少不等,可为水肿状,纤维性伴玻璃样变或明显的血管平滑肌样间质,当以后者为主时,如前所述,CCPRCC与RAT构成同一肿瘤的组织学表现谱。免疫表型特征,CCPRCC一致性的表达PAX2、PAX8、CK7、波形蛋白、CAⅨ、34βE12,少数局灶性表达CD10,不表达AMACR、TFE3和RCCm。CAⅨ在CCPRCC中特征性的表现为瘤细胞两侧和基底部胞膜着色而腔面不着色的“杯口”状表达模式[25]。分子遗传学发现少数CCPRCC可出现VHL基因突变或发生于VHL综合征中,但无第3号染色体短臂的缺失,也无第7号和第17号染色体的三体性和Y染色体的缺失。CCPRCC绝大多数在诊断时为低分期(pT1或pT2期),非常罕见的情况下可出现肾周脂肪的浸润(pT3期)[14],但目前文献报道的有长期随访资料表明CCPRCC为一种惰性的肾细胞肿瘤,在肿瘤完整切除的情况下均无复发、恶性变或转移。如果CCPRCC的惰性临床进程能被进一步证实,将来这一肿瘤的生物学行为有可能被界定为“低度恶性潜能”而不是癌[1]。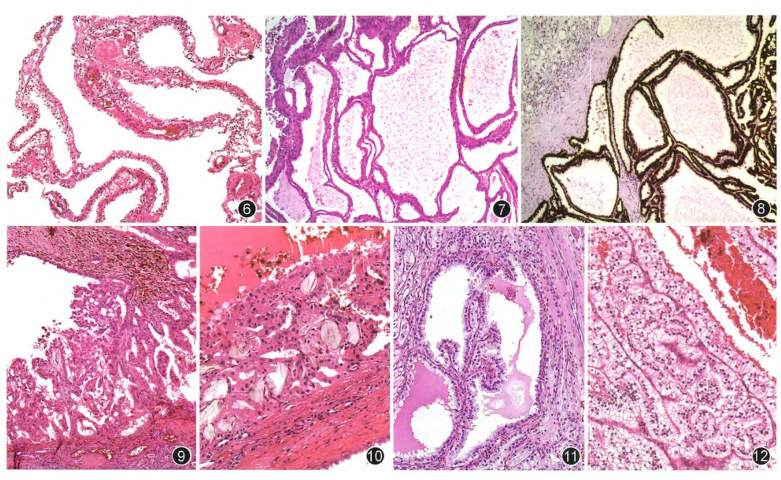
图6 多房囊性肾细胞癌,肿瘤完全由大小不等的薄壁囊肿构成,囊肿被覆为单层或数层低核级透明细胞 HE 低倍放大
图7 管状囊状肾细胞癌,由大小不等的小管和薄壁囊肿构成,囊壁被覆为高核级嗜酸性鞋钉样细胞,偶见上皮细胞呈乳头状增生突入囊腔 HE 低倍放大
图8 管状囊状肾细胞癌,肿瘤细胞弥漫表达AMACR EnVison法 低倍放大
图9 获得性囊性肾病相关的肾细胞癌(ACD-RCC),嗜酸性肿瘤细胞呈管乳头状增生突向囊腔,瘤细胞内外可见不规则透明空腔状似筛状结构 HE 低倍放大
图10 ACD-RCC肿瘤组织内沉积的不规则草酸钙结晶 HE 高倍放大
图11 透明细胞管状乳头状肾细胞癌(CCPRCC),起源于小至大的囊肿的纤细乳头状结构,被覆低核级透明细胞 HE 中倍放大
图12 CCPRCC致密的平行排列或弯曲成角的透明细胞小管,核远离基底部朝向腔面分布产生类似于分泌期子宫内膜可见的核下空泡 HE 高倍放大
四、成人囊性肾细胞肿瘤的鉴别诊断
如前所述,许多类型的肾细胞肿瘤都可在大体上或显微镜下表现出不同程度的囊性变,除了上述提及的几种类型之外,嗜酸细胞腺瘤、嫌色细胞性肾细胞癌以及MiTF家族易位性肾细胞癌等也可以在组织学上表现出明显的囊性。准确地将这些生物学行为各不相同的肿瘤区分开来具有重要的临床病理意义,除了仔细的组织学观察寻找典型的肿瘤区域外,必要时需要借助免疫组织化学染色或分子遗传学技术来辅助诊断。图13简要的概述了成人常见的囊性肾细胞肿瘤之间的鉴别诊断思路和方法。
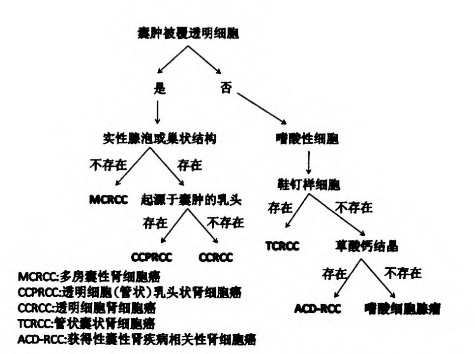
图13 成人常见的囊性肾细胞肿瘤之间的鉴别诊断思路和方法
参考文献:
[1]SrigleyJR, DelahuntB, EbleJN, et al. The International Society of Urological Pathology (ISUP) vancouver classification of renal neoplasia [J]. Am J Surg Pathol, 2013, 37(10): 1469–1489.
[2]赵明,李昌水,滕晓东。介绍国际泌尿病理协会2012肾肿瘤的专家共识[J].中华病理学杂志,2014, 43(3): 207–211.
[3]ZhouM, KortE, HoekstraP, et al. Adult cystic nephroma and mixed epithelial and stromal tumor of the kidney are the same disease entity: molecular and histologic evidence [J]. Am J Surg Pathol, 2009, 33(1): 72–80.
[4]TurbinerJ, AminMB, HumphreyPA, et al. Cystic nephroma and mixed epithelial and stromal tumor of kidney: a detailed clinicopathologic analysis of 34 cases and proposal for renal epithelial and stromal tumor (REST) as a unifying term [J]. Am J Surg Pathol, 2007, 31(4): 489–500.
[5]KumJB, GrignonDJ, WangM, et al. Mixed epithelial and stromal tumors of the kidney: evidence for a single cell of origin with capacity for epithelial and stromal differentiation [J]. Am J Surg Pathol, 2011, 35(8): 1114–1122.
[6]MudaliarKM, MehtaV, GuptaGN, et al. Expanding the morphologic spectrum of adult biphasic renal tumors––mixed epithelial and stromal tumor of the kidney with focal papillary renal cell carcinoma: case report and review of the literature [J]. Int J Surg Pathol, 2014, 22(3): 266–271.
[7]FineSW, ReuterVE, EpsteinJI, et al. Angiomyolipoma with epithelial cysts (AMLEC): a distinct cystic variant of angiomyolipoma [J]. Am J Surg Pathol, 2006, 30(5): 593–599.
[8]DavisCJ, BartonJH, SesterhennIA. Cystic angiomyolipoma of the kidney: a clinicopathologic description of 11 cases [J]. Mod Pathol, 2006, 19(5): 669–674.
[9]KarafinM, ParwaniAV, NettoGJ, et al. Diffuse expression of PAX2 and PAX8 in the cystic epithelium of mixed epithelial stromal tumor, angiomyolipoma with epithelial cysts, and primary renal synovial sarcoma: evidence supporting renal tubular differentiation [J]. Am J Surg Pathol, 2011, 35(9): 1264–1273.
[10]ArganiP, FariaPA, EpsteinJI, et al. Primary renal synovial sarcoma: molecular and morphologic delineation of an entity previously included among embryonal sarcomas of the kidney [J]. Am J Surg Pathol, 2000, 24(8): 1087–1096.
[11]SchoolmeesterJK, ChevilleJC, FolpeAL. Synovial sarcoma of the kidney: a clinicopathologic, immunohistochemical, and molecular genetic study of 16 cases [J]. Am J Surg Pathol, 2014, 38(1): 60–65.
[12]MichalM, HesO, HavlicekF. Benign renal angiomyoadenomatous tumor: a previously unreported renal tumor [J]. Ann Diagn Pathol, 2000, 4(5): 311–315.
[13]DemlKF, SchildhausHU, CompératE, et al. Clear cell papillary renal cell carcinoma and renal angiomyoadenomatous tumor: two variants of a morphologic, immunohistochemical, and genetic distinct entity of renal cell carcinoma [J]. Am J Surg Pathol, 2015, 39(7): 889–901.
[14]AronM, ChangE, HerreraL, et al. Clear cell–papillary renal cell carcinoma of the kidney not associated with end–stage renal disease: clinicopathologic correlation with expanded immunophenotypic and molecular characterization of a large cohort with emphasis on relationship with renal angiomyoadenomatous tumor [J]. Am J Surg Pathol, 2015, 39(7): 873–888.
[15]MontironiR, MazzucchelliR, ScarpelliM, et al. Update on selected renal cell tumors with clear cell features. With emphasis on multilocular cystic clear cell renal cell carcinoma [J]. Histol Histopathol, 2013, 28(12): 1555–1566.
[16]WilliamsonSR, HalatS, EbleJN, et al. Multilocular cystic renal cell carcinoma: similarities and differences in immunoprofile compared with clear cell renal cell carcinoma [J]. Am J Surg Pathol, 2012, 36(10): 1425–1433.
[17]HalatS, EbleJN, GrignonDJ, et al. Multilocular cystic renal cell carcinoma is a subtype of clear cell renal cell carcinoma [J]. Mod Pathol, 2010, 23(7): 931–936.
[18]WilliamsonSR, MaclennanGT, Lopez–BeltranA, et al. Cystic partially regressed clear cell renal cell carcinoma: a potential mimic of multilocular cystic renal cell carcinoma [J]. Histopathology, 2013, 63(6): 767–779.
[19]赵明,滕晓东,孙柯,等。新近认识的肾细胞癌[J].中华病理学杂志,2013, 42(7): 478–482.
[20]ZhouM, YangXJ, LopezJI, et al. Renal tubulocystic carcinoma is closely related to papillary renal cell carcinoma: implications for pathologic classification[J]. Am J Surg Pathol, 2009, 33(12): 1840–1849.
[21]Al–HussainTO, ChengL, ZhangS, et al. Tubulocystic carcinoma of the kidney with poorly differentiated foci: a series of 3 cases with fluorescence in situ hybridization analysis [J]. Hum Pathol, 2013, 44(7): 1406–1411.
[22]TickooSK, deperalta–VenturinaMN, HarikLR, et al. Spectrum of epithelial neoplasms in end–stage renal disease: an experience from 66 tumor–bearing kidneys with emphasis on histologic patterns distinct from those in sporadic adult renal neoplasia [J]. Am J Surg Pathol, 2006, 30(2): 141–153.
[23]KurodaN, OheC, MikamiS, et al. Review of acquired cystic disease–associated renal cell carcinoma with focus on pathobiological aspects [J]. Histol Histopathol, 2011, 26(9): 1215–1218.
[24]ZhouH, ZhengS, TruongLD, et al. Clear cell papillary renal cell carcinoma is the fourth most common histologic type of renal cell carcinoma in 290 consecutive nephrectomies for renal cell carcinoma [J]. Hum Pathol, 2014, 45(1): 59–64.
[25]WilliamsonSR, EbleJN, ChengL, et al. Clear cell papillary renal cell carcinoma: differential diagnosis and extended immunohistochemical profile [J]. Mod Pathol, 2013, 26(5): 697–708.
本站欢迎原创文章投稿,来稿一经采用稿酬从优,投稿邮箱tougao@ipathology.com.cn
相关阅读
 数据加载中
数据加载中
我要评论

热点导读
-

淋巴瘤诊断中CD30检测那些事(五)
强子 华夏病理2022-06-02 -

【以例学病】肺结节状淋巴组织增生
华夏病理 华夏病理2022-05-31 -

这不是演习-一例穿刺活检的艰难诊断路
强子 华夏病理2022-05-26 -

黏液性血性胸水一例技术处理及诊断经验分享
华夏病理 华夏病理2022-05-25 -

中老年女性,怎么突发喘气困难?低度恶性纤维/肌纤维母细胞性肉瘤一例
华夏病理 华夏病理2022-05-07







共0条评论