[导读] 编译整理:强子
无肌上皮或肌上皮部分缺失的良性及原位病变
包裹性乳头状癌
包裹性乳头状癌为界清的圆形肿物,一般见于绝经后女性,此前曾被称为囊内或包裹型乳头状癌。其上皮细胞呈乳头状生长,伴纤细纤维血管轴心,细胞核为低至中等级别非典型,且病变周围有纤维包膜。典型情况下,乳头的纤维血管轴心内并无肌上皮细胞,且大部分病例中病变周边的肌上皮细胞也是完全缺失的;但部分病例中可能会有表达减弱的肌上皮细胞。包裹性乳头状癌中的细胞一般ER阳性、CK5/6阴性。
图6为包裹性乳头状癌。HE切片中为界清、伴纤维包膜包裹的肿瘤,可见乳头状结构,瘤细胞的细胞核具有中等程度非典型;免疫组化p63/AE1/AE3双染,病变周边及纤维周围内未见肌上皮细胞。
虽然文献中有腋窝淋巴结转移的罕见报道,但目前对于包裹性乳头状癌还是归为原位癌(分期为pTis)并以此进行治疗,因为其临床行为惰性、预后类似导管原位癌。也正是因为目前将其归为原位癌,因此本文原作者表示,粗针穿刺活检中无肌上皮细胞、无显著间质浸润的包裹性乳头状癌他们还是多诊断为“乳头状癌、至少原位”;然后在鉴别诊断中列出包裹性乳头状癌以及其他相关病种,如乳头状导管原位癌、导管原位癌累及乳头状瘤,备注最终分类待切除标本。
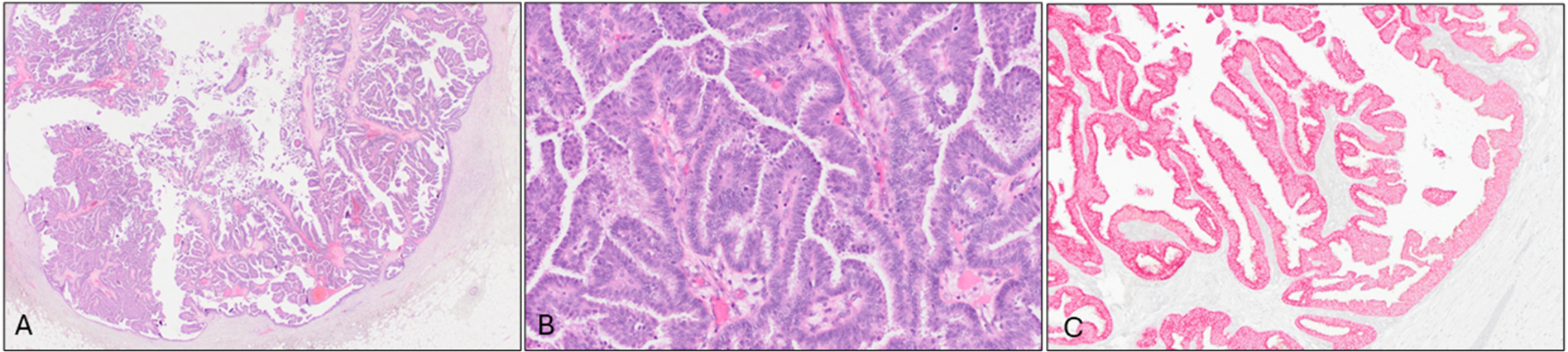 图6.包裹性乳头状癌。粗针穿刺活检标本,可见游离碎片状非典型上皮,伴乳头状结构,免疫组化p63/AE1/AE3检测肌上皮均为阴性。本例原作者会诊断为“检出碎片状乳头状癌,至少原位”。
图6.包裹性乳头状癌。粗针穿刺活检标本,可见游离碎片状非典型上皮,伴乳头状结构,免疫组化p63/AE1/AE3检测肌上皮均为阴性。本例原作者会诊断为“检出碎片状乳头状癌,至少原位”。
由于大多数都做过粗针穿刺活检,常导致组织碎片化及上皮位移,而这些改变极易被误判为浸润癌,因此切除标本中在包裹性乳头状癌背景下诊断浸润癌颇具挑战性。根据本文原作者的会诊经验,转诊至该处请求判断是否存在浸润的病例几乎都是既往活检导致的上皮易位而非“真正”浸润。只有癌组织明确位于包裹性乳头状癌的包膜外、且超出既往活检针道范围外时,才可以诊断为浸润性癌。最终病理T分期中所依据的浸润性癌大小也应仅限于明确的浸润性成分、而不包括包裹性乳头状癌成分。
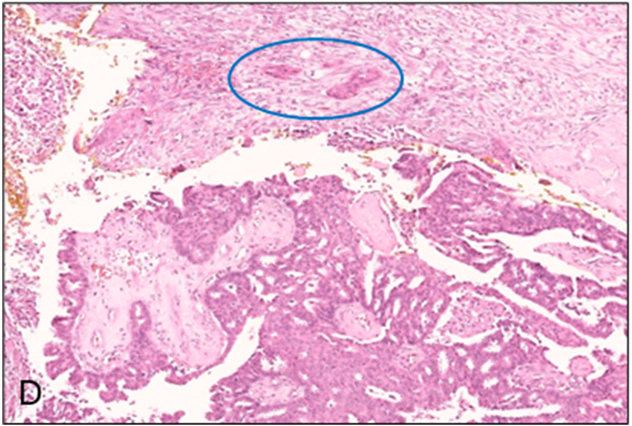
图7.包裹性乳头状癌伴活检部位改变,且纤维包膜内有小灶的易位上皮(蓝圈所示)。不要将其视为浸润性成分。
实性乳头状原位癌
(原位及浸润)的实性乳头状癌为伴有纤细的纤维血管轴心、具有实性生长模式的肿瘤。与包裹性乳头状癌相似,实性乳头状癌最常见于绝经后女性,一般至少为六七十岁后发病。
实性乳头状癌为伴实性生长及纤维血管轴心的结节状,结节内的上皮细胞为低至中度细胞核非典型。大部分实性乳头状癌具有内分泌特征,且阳性表达神经内分泌标记,如CgA、Syn、INSM1;此外,常见细胞内及细胞外黏液产生。实性乳头状癌的癌巢周边一般无肌上皮着色、或着色显著减弱,且纤维血管轴心内一般也无肌上皮细胞。
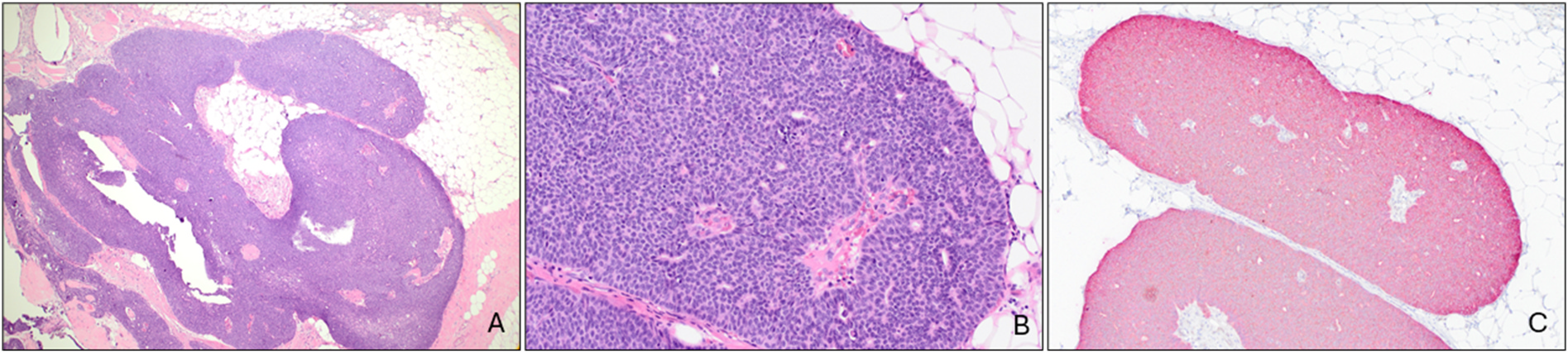 图8.实性乳头状癌。形态学为界清的巢状表现,细胞巢轮廓为圆形;瘤细胞具有中等程度非典型,围绕中央的纤维血管轴心排列;免疫组化p63/AE1/AE3双染,瘤巢周边及纤维血管轴心内均无肌上皮着色。
图8.实性乳头状癌。形态学为界清的巢状表现,细胞巢轮廓为圆形;瘤细胞具有中等程度非典型,围绕中央的纤维血管轴心排列;免疫组化p63/AE1/AE3双染,瘤巢周边及纤维血管轴心内均无肌上皮着色。
虽然瘤巢周围的肌上皮着色可完全缺失或减弱,但实性乳头状癌的浸润性和原位诊断还是取决于瘤巢形态,也就是是否规则。世界卫生组织已经提出,结节轮廓呈光滑、圆形的实性乳头状病变应按照原位癌进行分期和处理,而不必考虑周围是否有肌上皮层,因为其预后极好。如果瘤巢轮廓不规则、锯齿状参差不齐,则诊断浸润性实性乳头状癌,且一般伴有促纤维增生性间质。实际工作中,可能很难确定实性乳头状癌是完全原位、还是浸润、或者是二者兼有。此时免疫组化肌上皮检测可能会有帮助:如果周边至少部分有肌上皮着色,则病变可被视为原位。不过,如前所述,即使肌上皮标记完全缺失,也无助于浸润性的判断。
导管原位癌
临床病理诊断工作中,肌上皮标记常用于可疑病例中协助区分导管原位癌和浸润性癌。导管原位癌病灶周围一般有连续、或者部分肌上皮细胞围绕,而浸润性癌巢周围无肌上皮细胞。不过,文献中早有至少一项肌上皮标记完全缺失、或表达降低的导管原位癌报道。导管原位癌中肌上皮标记表达降低的临床意义还不明确;尤其不明确的是,肌上皮标记表达异常的导管原位癌是否更有可能进展为浸润性癌。
导管原位癌中肌上皮标记表达降低最常见的是SMMHC,有报道称其几率可高达76.5%;而calponin和p63的这一几率分别为17.4%、12.6%。病理医师必须了解这一现象,因为SMMHC是临床实践中最常用的肌上皮标记之一。还要注意的是,导管原位癌相关的肌上皮细胞标记中,SMA是最不易出现表达降低的指标。
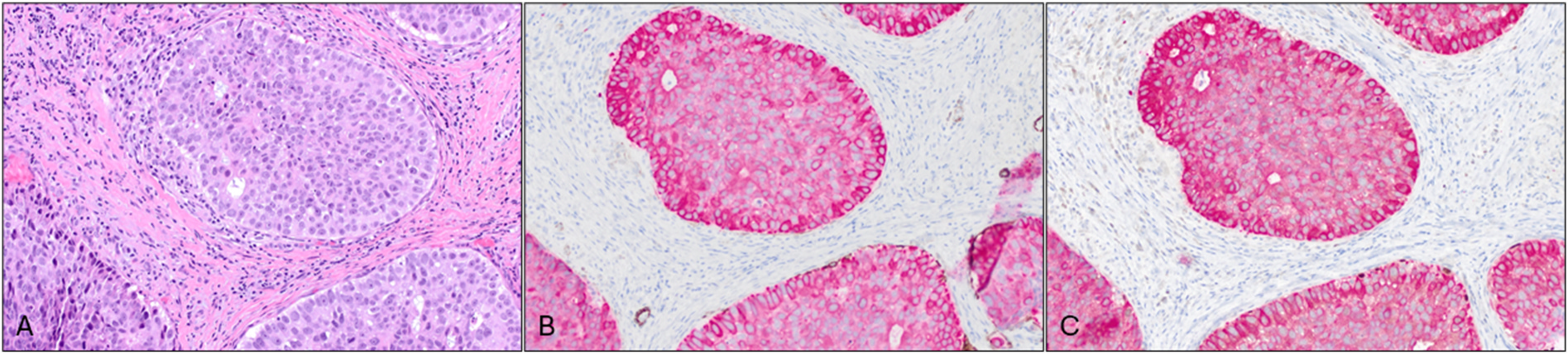 图9.导管原位癌。(A)本例HE为伴实性生长、细胞核高级别的导管原位癌;免疫组化SMMHC/AE1/AE3双染(B)和p63/AE1/AE3双染(C)在图中下方的瘤巢周边可见部分肌上皮细胞着色,中央部分的瘤巢则未见肌上皮细胞着色。鉴于中央处瘤巢和周围的导管原位癌形态相似,因此本例尽管肌上皮细胞着色缺失,但最好还是归为导管原位癌。
图9.导管原位癌。(A)本例HE为伴实性生长、细胞核高级别的导管原位癌;免疫组化SMMHC/AE1/AE3双染(B)和p63/AE1/AE3双染(C)在图中下方的瘤巢周边可见部分肌上皮细胞着色,中央部分的瘤巢则未见肌上皮细胞着色。鉴于中央处瘤巢和周围的导管原位癌形态相似,因此本例尽管肌上皮细胞着色缺失,但最好还是归为导管原位癌。
上述结果都说明,对于诊断不确定的病例来说,在确定将肿瘤细胞巢周围肌上皮标记缺失作为浸润性癌诊断依据之前,应使用一组肌上皮细胞标记进行检测。本文原作者表示他们一般会初步采用SMMHC、calponin、p63;如果诊断仍不确定,则会加用其他标记,如SMA、CD10、CK5/6。
未完待续
往期回顾:
常学常新-乳腺病理中的肌上皮标记(一)
常学常新-乳腺病理中的肌上皮标记(二)

















共0条评论