[导读] 编译整理:强子
简介
女性生殖道的卵黄囊瘤(yolk sac tumors,YSTs)多见于年轻女性(年龄中位数17-22岁)的卵巢,具体表现为单纯型、或混合型生殖细胞肿瘤。不过,该肿瘤也可见于多个其他部位,如子宫体、子宫颈、阴道、外阴。年龄较大女性中,伴卵黄囊瘤分化的恶性肿瘤罕见发生于40岁以上女性。
不过,40岁以上女性中具有卵黄囊瘤分化的恶性肿瘤特殊之处在于:既可表现为(明确的)单纯型肿瘤,也可作为混合型生殖细胞肿瘤的一部分而存在,或与恶性非生殖细胞肿瘤成分(一般为苗勒管型癌成分)共存;这提示该年龄组的卵黄囊瘤可能包括了不同起源的亚型。伴其他生殖细胞肿瘤成分者几乎可以肯定是生殖细胞来源;伴苗勒型癌成分者可能是体细胞来源的肿瘤;单纯型肿瘤则可能是生殖细胞型、但其中部分病例可能实际属于体细胞型但未取样到恶性非生殖细胞成分。
对于伴恶性非生殖细胞成分的卵黄囊瘤来说,曾被称为“体细胞来源的卵黄囊瘤”。一般来说,体细胞来源的卵黄囊瘤多见于年龄较大女性,极少数例外;文献中关于其分子特征的报道也很少。美国约翰霍普金斯医疗集团病理专家Numan等人在《Am J Surg Pathol》杂志报道了一组发生于40岁以上女性伴卵黄囊瘤分化的单纯型、混合型肿瘤临床病理特征,希望可以梳理不同亚型间的差异、以及混合型肿瘤中各组分之间的关系。为帮助大家更好的了解相关知识点,我们将该文要点编译介绍如下。
研究内容及结果
该组病例来自作者所在单位就诊及会诊患者,共计32例符合纳入标准,患者年龄40-86岁不等,平均年龄61岁,年龄中位数63岁。术前血清AFP水平309-555130ng/mL不等。单纯型卵黄囊瘤11例,部位分别涉及卵巢(10例)和子宫内膜(1例),年龄47岁-86岁,平均年龄64岁,年龄中位数63岁。7例混合型生殖细胞肿瘤伴卵黄囊瘤成分,其中4例为卵巢成熟型畸胎瘤,3例为不成熟型畸胎瘤;患者年龄40-79岁,平均年龄52岁,年龄中位数43岁。本研究中未见伴非畸胎瘤成分的恶性混合型生殖细胞肿瘤患者(如卵黄囊瘤及精原细胞瘤、和/或胚胎性癌的混合)。体细胞来源卵黄囊瘤14例,患者年龄45-76岁,平均年龄63岁,年龄中位数64岁。
单纯型卵黄囊瘤及其他肿瘤中卵黄囊瘤成分的形态结构模式涵盖了该类型肿瘤特有的宽泛谱系,具体如伴Schiller-Duval小体的网状或微囊状、实性、腺样、迷路样、腺泡状、多泡卵黄囊状(polyvesicular vitelline)、花边状、黏液样、肝样。单纯型卵黄囊瘤中,最常见(且主要的)模式为子宫内膜样亚型(8/11,73%)。很多病例中,不同的形态学模式存在重叠。
14例体细胞来源卵黄囊瘤中,13例具有苗勒型癌成分,具体如:子宫内膜样癌(n=5)、透明细胞癌(n=5)、子宫浆液性癌或卵巢高级别浆液性癌(n=2)、伴高级别特征的非特殊类型腺癌(n=4),有2例为伴浆液性癌成分的癌肉瘤。剩余1例为卵巢卵黄囊瘤、伴胚胎性肿瘤,后者具有中枢神经系统样髓上皮瘤样特征。
免疫组化方面,单纯型卵黄囊瘤和混合型肿瘤中卵黄囊瘤组分的结果相似:弥漫阳性表达glypican-3(13/13,100%)、SALL4(17/17,100%);大部分病例至少局灶表达AFP(23/29,65%);CK7(13/24,54%)、EMA(13/20,65%)阳性也不少见,但一般为散在/局灶着色。部分病例表达p16(4/6,67%)和HNF-1β(7/9,78%),但无一表达WT-1(n-11)或ER(n=16);PR罕见表达且为局灶性(1/16,6%)。P53最常见为野生型表达(6/10,60%),偶见异常/突变型表达(细胞核弥漫强阳性,3/10,30%)。
对于体细胞来源卵黄囊瘤来说,苗勒型癌成分一般CK7和EMA表达的几率和范围要高于卵黄囊瘤成分(检测病例中阳性率>80%),且常见激素受体表达(检测病例中阳性率>60%)。这些成分中有部分也表达卵黄囊瘤标记物:大部分表达glypican-3(5/6,83%),部分表达SALL4(4/11,36%),AFP仅罕见表达(1/10,10%)。WT1、HNF-1β、p53(异常)、p16(弥漫)表达的情况符合相应癌成分分化的预期结果。
部分病例做了靶向二代测序,相应结果详见图1。对于单纯型卵黄囊瘤来说,检测到的基因改变包括:DICER1(1/4)、PIK3R1与PTPRT(1/4)、PMS1(1/4)以及TP53(2/4)。另有一例单纯型卵黄囊瘤检出PTEN、ARID1A、ARID1B、FGFR2及CTNNB1的改变(这些改变常见于子宫内膜样癌)。在伴有体细胞型成分的卵黄囊瘤中,两种肿瘤成分均有TP53、KRAS、FBXW7和KMT2C等基因改变,提示它们具有共同的起源。
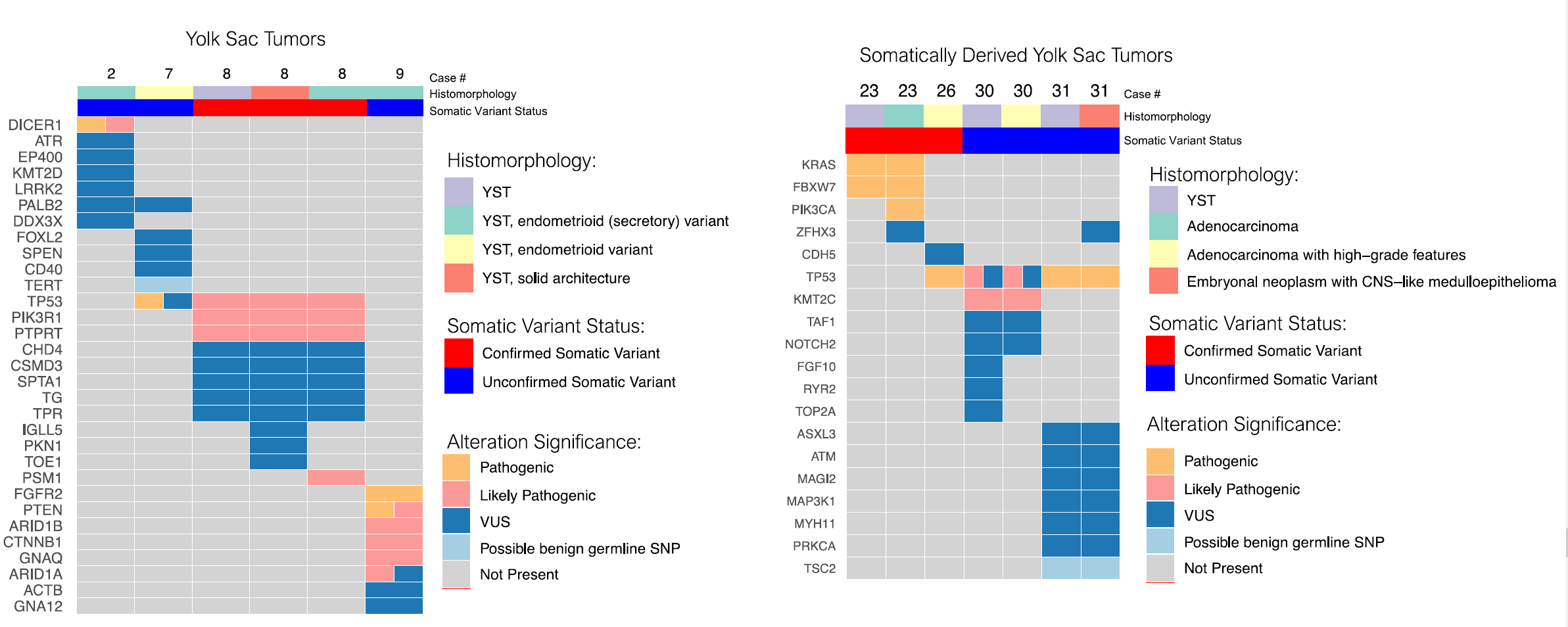 图1.卵黄囊瘤(左)及体细胞来源卵黄囊瘤(右)中检出的遗传学异常。
图1.卵黄囊瘤(左)及体细胞来源卵黄囊瘤(右)中检出的遗传学异常。
A:图中第一行为相应病例组织学,在右侧图例中从上至下依次为:卵黄囊瘤、腺癌、伴高级别特征的腺癌、胚胎性肿瘤伴中枢神经系统样髓上皮瘤。
B:第二行以不同颜色示诸多基因遗传学改变中的体细胞突变状态,红色为证实有体细胞突变,蓝色为未能证实体细胞突变;
C:下方以不同颜色示诸多基因遗传学改变的意义,在右侧图例中从上至下依次为:致病性,可能致病性,意义未明,可能为良性种系性单核苷酸多态性,未见改变。
图例赏析
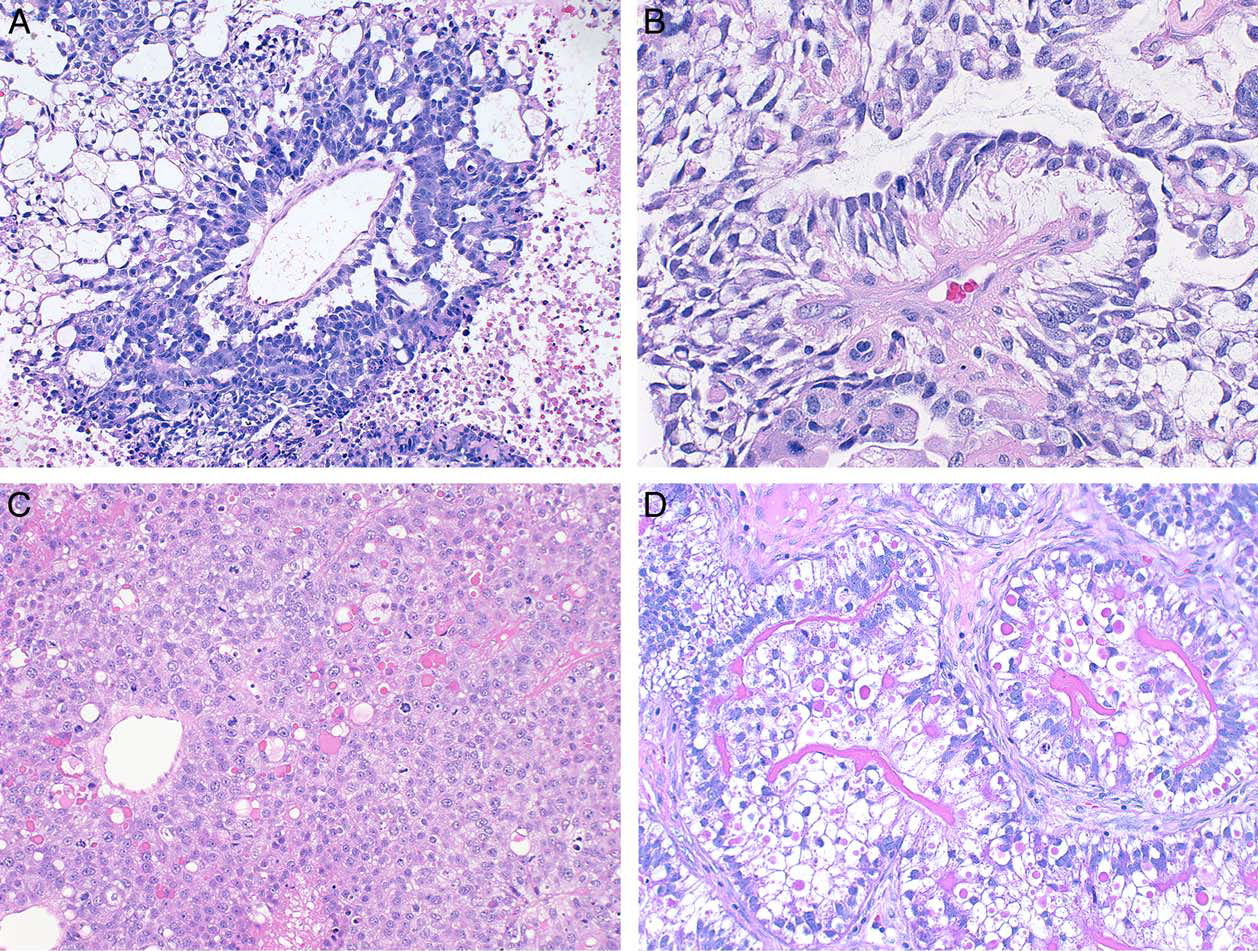 图2.卵黄囊瘤的不同模式:(A)网状/微囊性模式,伴大量大小不等的空泡,衬覆形态均一、体积小的肿瘤细胞。此外,中央有Schiller-Duval小体,肿瘤细胞从纤维血管轴心向外放射状排列;(B)Schiller-Duval小体;栅栏状排列的原始立方状、稍呈柱状细胞,从纤维血管轴心放射状排列;(C)实性模式,肿瘤细胞呈片状,胞质透明、稍呈空泡状,嗜酸性,细胞核小而均一;可见嗜酸性透明小体和核分裂。(D)腺样结构,上皮为柱状,且有核上、核下空泡;可见大量嗜酸性透明小体及成片分布(湖状)的嗜酸性物质。
图2.卵黄囊瘤的不同模式:(A)网状/微囊性模式,伴大量大小不等的空泡,衬覆形态均一、体积小的肿瘤细胞。此外,中央有Schiller-Duval小体,肿瘤细胞从纤维血管轴心向外放射状排列;(B)Schiller-Duval小体;栅栏状排列的原始立方状、稍呈柱状细胞,从纤维血管轴心放射状排列;(C)实性模式,肿瘤细胞呈片状,胞质透明、稍呈空泡状,嗜酸性,细胞核小而均一;可见嗜酸性透明小体和核分裂。(D)腺样结构,上皮为柱状,且有核上、核下空泡;可见大量嗜酸性透明小体及成片分布(湖状)的嗜酸性物质。
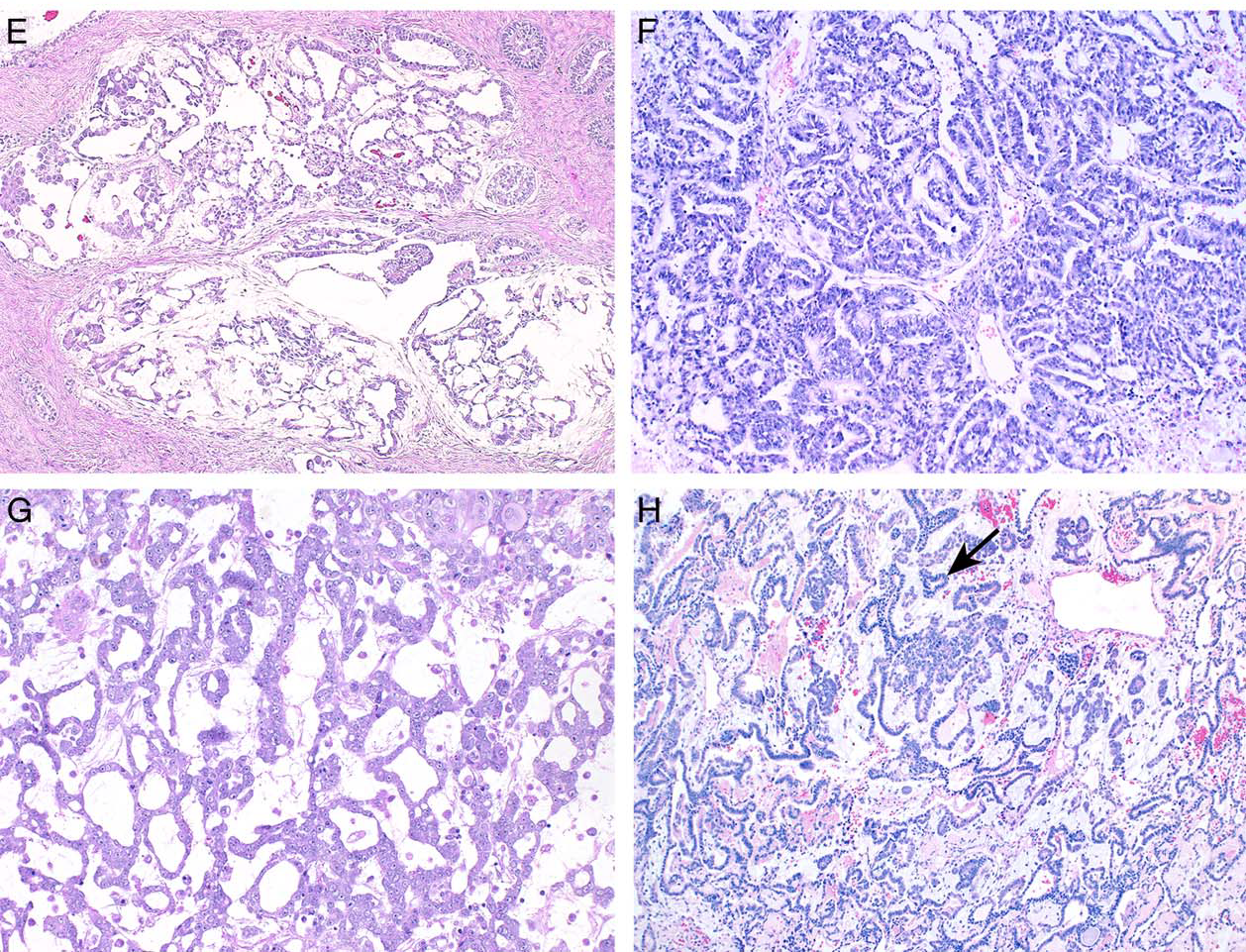 图3.卵黄囊瘤的不同模式:(左上)重叠模式,图中可见结节状区域及网状区域、腺样结构;(右上)柱状上皮排列呈管腔样,部分呈腺样,总体构成迷宫样结构;(左下)类似肺泡结构的腺泡样排列模式,其腔隙内衬立方样上皮细胞;(右下)混合型生殖细胞肿瘤,卵黄囊瘤成分呈花边状,肿瘤细胞呈迂曲缎带样及条索样、交织成复杂网状。
图3.卵黄囊瘤的不同模式:(左上)重叠模式,图中可见结节状区域及网状区域、腺样结构;(右上)柱状上皮排列呈管腔样,部分呈腺样,总体构成迷宫样结构;(左下)类似肺泡结构的腺泡样排列模式,其腔隙内衬立方样上皮细胞;(右下)混合型生殖细胞肿瘤,卵黄囊瘤成分呈花边状,肿瘤细胞呈迂曲缎带样及条索样、交织成复杂网状。
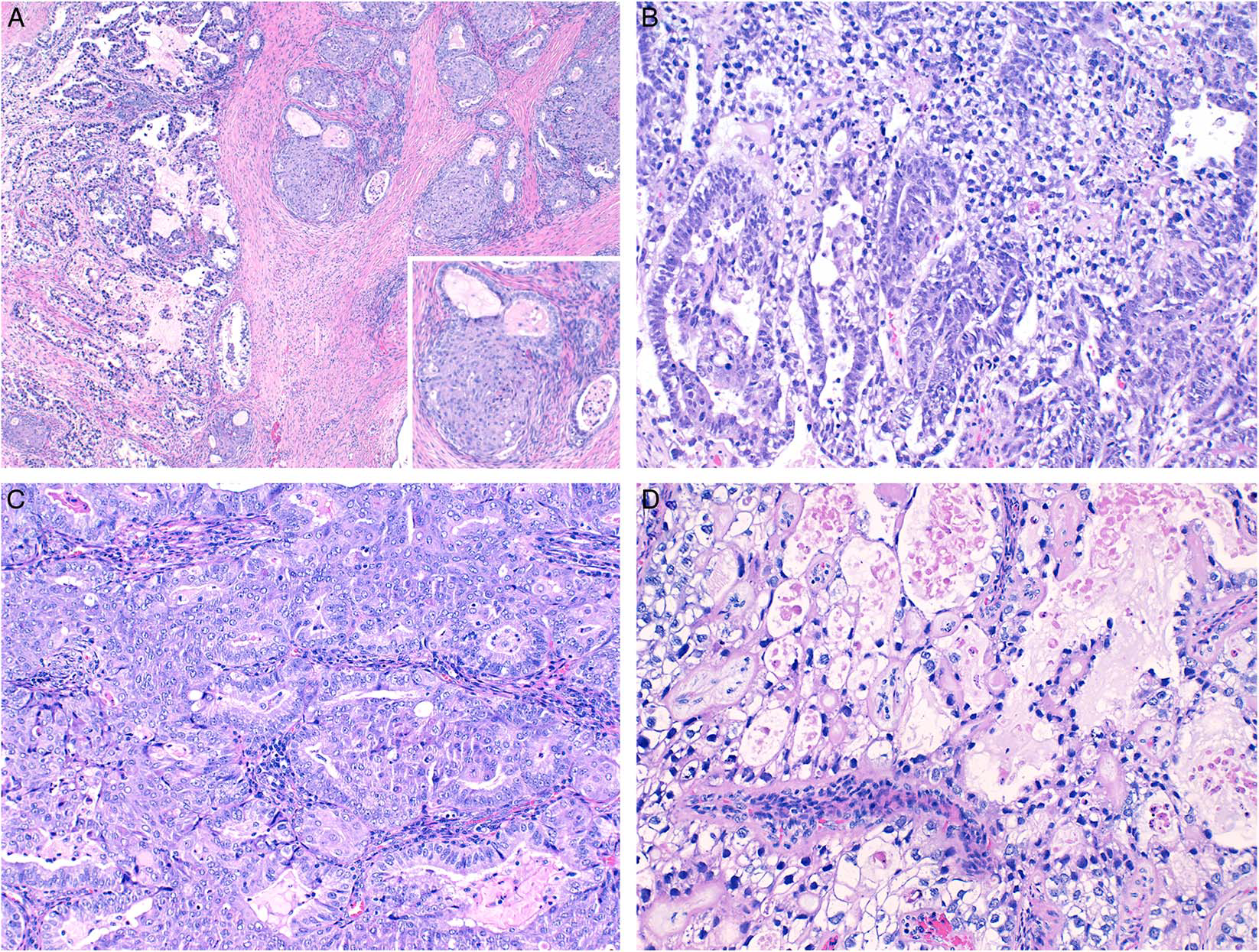 图4.体细胞来源的卵黄囊瘤。(A)图示卵黄囊瘤成分及子宫内膜样成分,伴浸润性腺体及鳞状分化;插图示鳞状分化及相邻子宫内膜样腺体增生;(B)卵黄囊瘤成分,表现为柱状上皮形成的腺样结构,伴核上及核下空泡,细胞核呈原始表现,紧邻实性片状肿瘤成分。(C)子宫内膜样癌成分,部分区域呈筛状结构,散在鳞状分化,细胞核小而圆形;(D)透明细胞癌成分,可见裂隙样腔隙,衬覆细胞胞质中等至丰富,透明表现,细胞核小,伴中等程度非典型。
图4.体细胞来源的卵黄囊瘤。(A)图示卵黄囊瘤成分及子宫内膜样成分,伴浸润性腺体及鳞状分化;插图示鳞状分化及相邻子宫内膜样腺体增生;(B)卵黄囊瘤成分,表现为柱状上皮形成的腺样结构,伴核上及核下空泡,细胞核呈原始表现,紧邻实性片状肿瘤成分。(C)子宫内膜样癌成分,部分区域呈筛状结构,散在鳞状分化,细胞核小而圆形;(D)透明细胞癌成分,可见裂隙样腔隙,衬覆细胞胞质中等至丰富,透明表现,细胞核小,伴中等程度非典型。
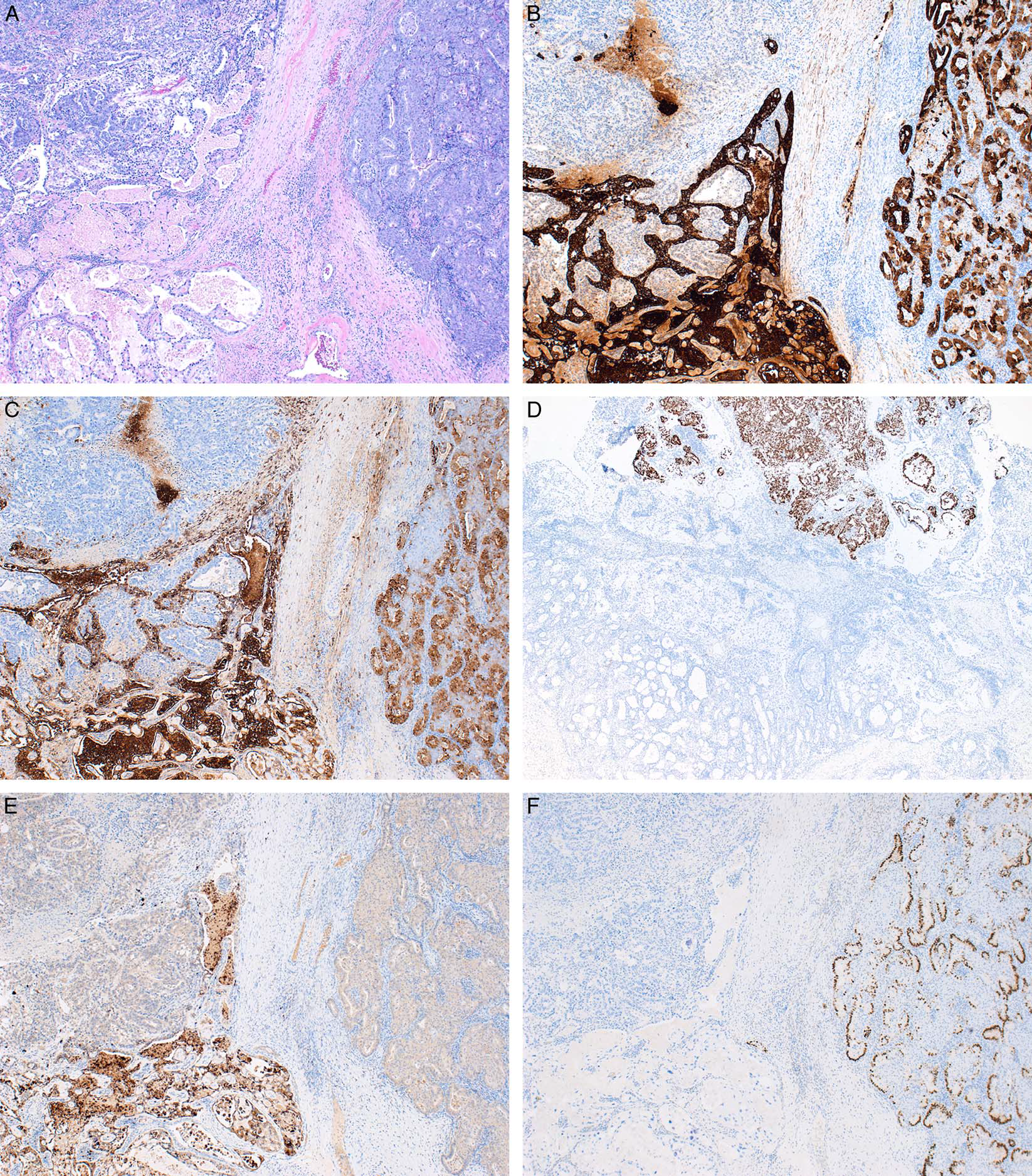 图5.体细胞来源的卵黄囊瘤。(A)可见三种肿瘤成分,左上为卵黄囊瘤,左下为透明细胞癌,右侧为子宫内膜样癌,相互之间有纤维间隔分隔;免疫组化CK7(B)和EMA(C)在透明细胞癌和子宫内膜样癌成分阳性,在卵黄囊瘤为阴性;SALL4(D)在卵黄囊瘤为阴性,在透明细胞癌和子宫内膜样癌为阳性;Napsin-A(E)在透明细胞癌为阳性,在卵黄囊瘤和子宫内膜样癌为阴性;ER(F)在子宫内膜样癌为阳性,在透明细胞癌和卵黄囊瘤为阴性;PR结果与ER相似。
图5.体细胞来源的卵黄囊瘤。(A)可见三种肿瘤成分,左上为卵黄囊瘤,左下为透明细胞癌,右侧为子宫内膜样癌,相互之间有纤维间隔分隔;免疫组化CK7(B)和EMA(C)在透明细胞癌和子宫内膜样癌成分阳性,在卵黄囊瘤为阴性;SALL4(D)在卵黄囊瘤为阴性,在透明细胞癌和子宫内膜样癌为阳性;Napsin-A(E)在透明细胞癌为阳性,在卵黄囊瘤和子宫内膜样癌为阴性;ER(F)在子宫内膜样癌为阳性,在透明细胞癌和卵黄囊瘤为阴性;PR结果与ER相似。
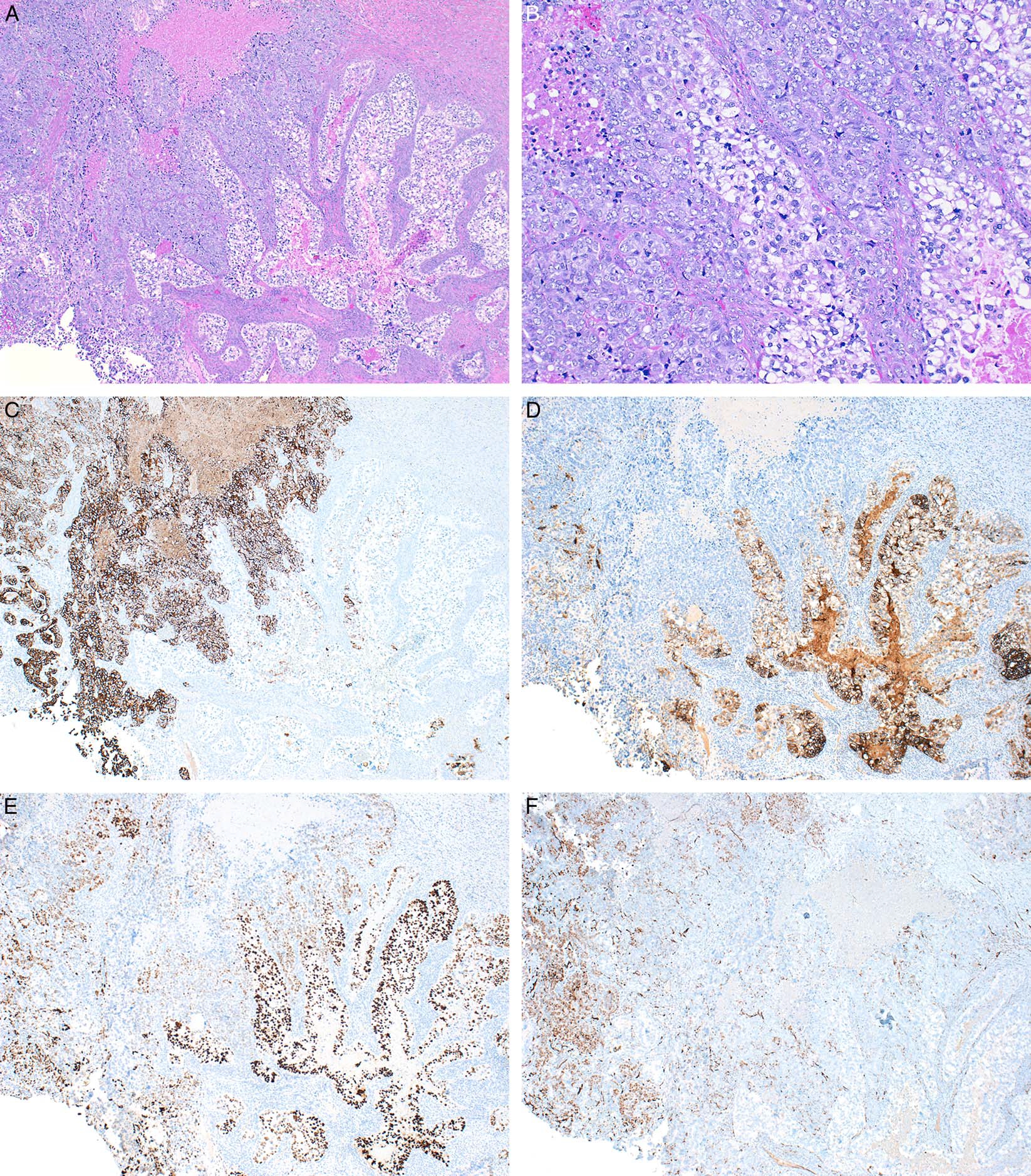
图6.体细胞来源的卵黄囊瘤,本例癌肉瘤成分。(A)图示两种成分,左侧为浆液性癌成分,排列呈片状、条索状,伴地图样坏死;右侧为卵黄囊瘤成分,呈梁状模式;(B)浆液性癌的细胞胞质中等量,嗜酸性,细胞核有多形性;卵黄囊瘤的细胞胞质丰富、透明,细胞核轻度非典型。免疫组化检测,CK7(C)在浆液性癌为阳性,在卵黄囊瘤为阴性;glypican-3(D)和SALL-4(E)则在卵黄囊瘤成分阳性;WT-1(F)在浆液性癌阳性,在卵黄囊瘤阴性。
小结
根据本研究中对40岁以上女性单纯型卵黄囊瘤的研究发现,其肿瘤起源存在异质性:部分病例可能源于生殖细胞,因其携带的基因改变与年轻患者单纯型卵黄囊瘤相似;而另一些所谓“单纯型”肿瘤的分子谱系则与既往报道的体细胞型卵黄囊瘤相符,这提示其本质可能是含有苗勒管癌成分的体细胞型肿瘤、只是取材未取到,而不是真正的生殖细胞起源。在体细胞型卵黄囊瘤中,其相关基因改变与既往研究结果一致,进一步支持其体细胞起源而非生殖细胞起源。
点此下载原文献
参考文献
Numan TA, Ronnett BM, Haley L, et al. Clinicopathologic and Molecular Analysis of Malignant Neoplasms With Yolk Sac Tumor Differentiation in Women 40 Years of Age and Older. Am J Surg Pathol. 2025;49(7):686-700.
doi:10.1097/PAS.0000000000002389



















共0条评论