男,73岁,检查发现右下肺结节2年余,无吸烟史。CT示右下肺叶胸膜下结节状软组织密度影,边界尚清,大小约2.8cm×1.8cm,密度尚均匀,以宽基底与胸膜相连,考虑右肺下叶肿物恶性病变可能性大,建议手术治疗。
01 大体检查
(右下肺叶)灰红色楔形肺组织一块,大小7cm×3.2cm×2.8cm,切开紧邻胸膜见一灰白色结节,大小3cm×2.5cm×1.5cm,切面灰白色,质地较韧,与周围组织界限尚清。
02 组织学检查
肿瘤细胞在肺实质内呈弥漫性生长。 可见肿瘤细胞排列成特征性的筛孔状、管状及小梁状结构。筛孔状结构区域可见大量囊性腔隙,内含嗜碱性物质。细胞形态大小相对一致,呈基底样,胞浆稀少,核深浅,异型性不明显,核分裂象罕见。间质为致密、玻璃样变的纤维结缔组织。高倍镜下未见明显核仁及核分裂象,未见肿瘤细胞明确浸润神经及脉管。
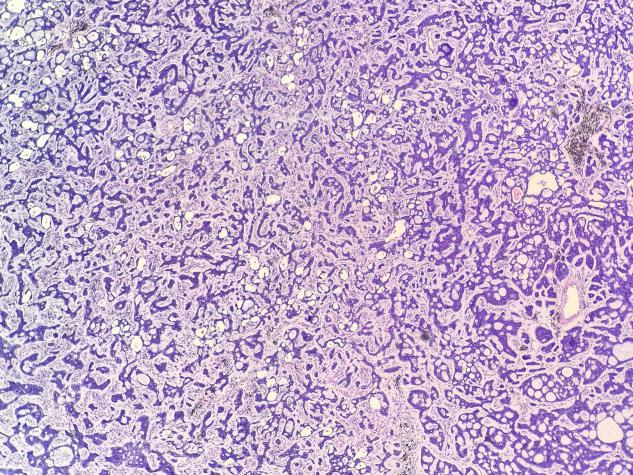
图1 低倍镜下可见肿瘤细胞呈嗜碱性排列呈筛孔状及小梁状
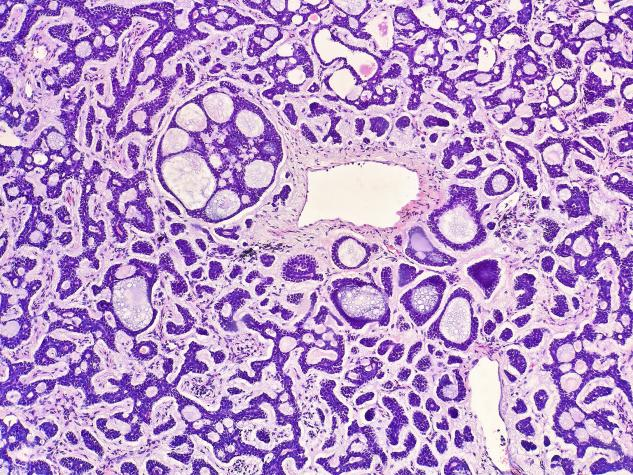
图2 可见明显囊性扩张的区域,部分囊性区域相互融合形成筛状结构
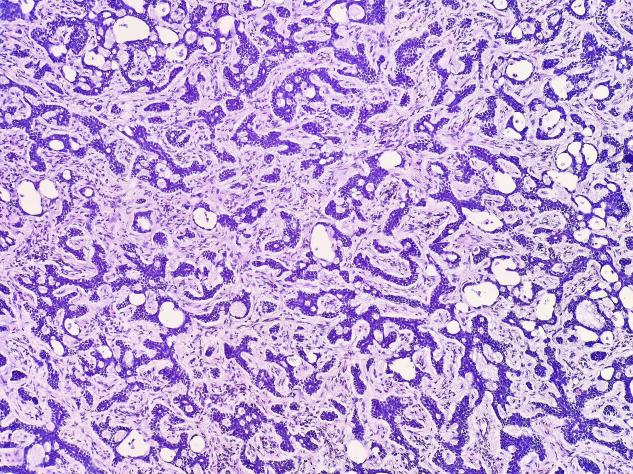
图3 间质为粉染的纤维结缔组织,可伴玻璃样变,肿瘤细胞分散在间质中,排列成大小形态各不相同的小梁状,条索样结构
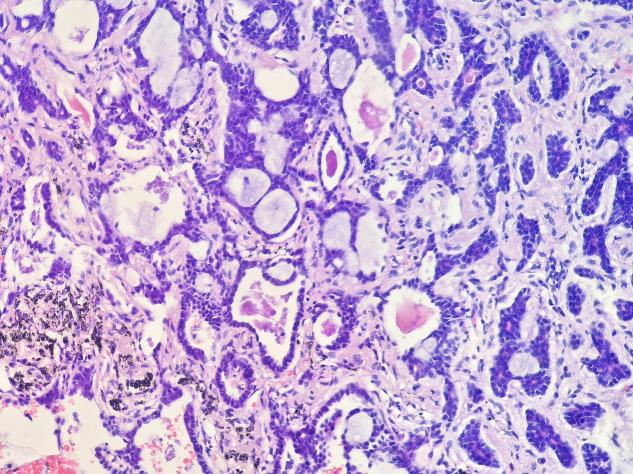
图4 部分管腔内可见嗜酸性物质,左下角可见灰褐色碳末沉积伴出血
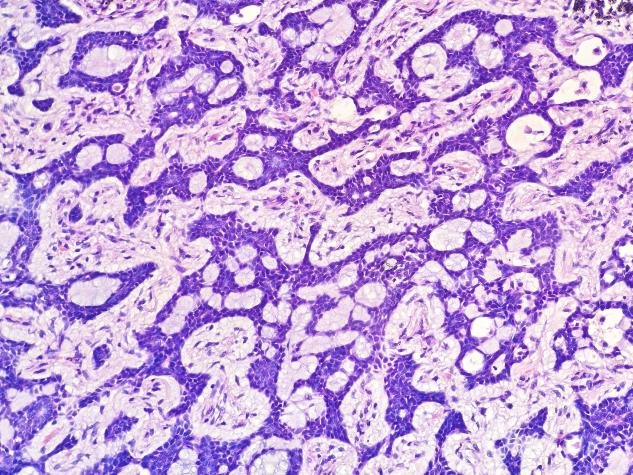
图5 可见肿瘤细胞形成大量筛样结构,似有黏液形成
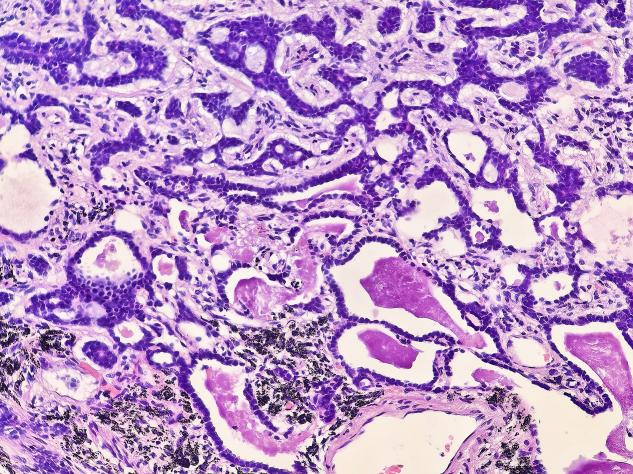
图6 部分肿瘤细胞形成管腔样结构,内含嗜酸性物质
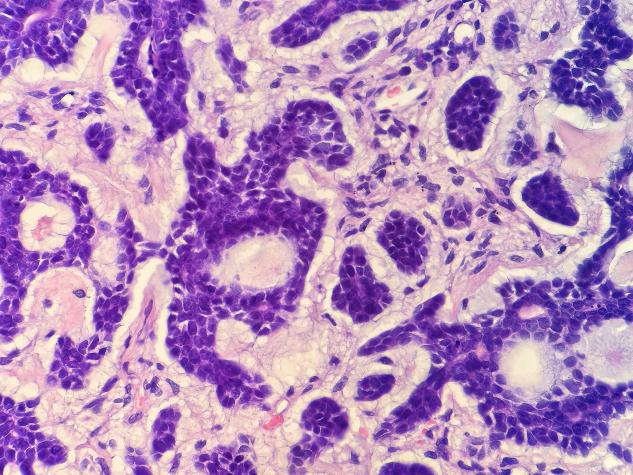
图7 高倍镜下可见部分细胞呈小的实性巢团样结构
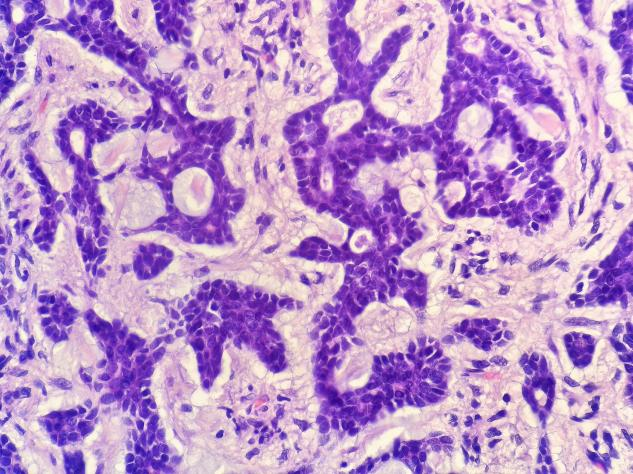
图8 囊性结构中可见嗜碱性似黏液样物质
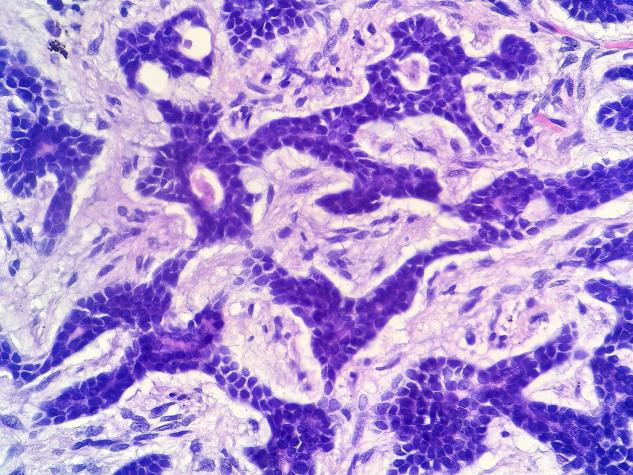
图9 腺样囊性癌的细胞实则有两层细胞构成,外层为肌上皮细胞,内层为导管细胞,往往在管状型中可见明显的双层结构
03 免疫组化
肿瘤细胞表达:EMA(+),TTF-1(少量+),P63(肌上皮细胞+),SMA(肌上皮细胞+),Calponin(肌上皮细胞部分+),CD117(c-kit)(+),CK5/6(+),S-100(少量+)。Ki-67增殖指数约为12%。
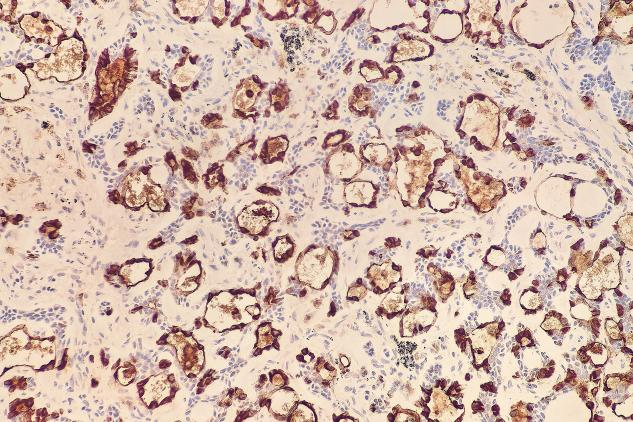
EMA(+)
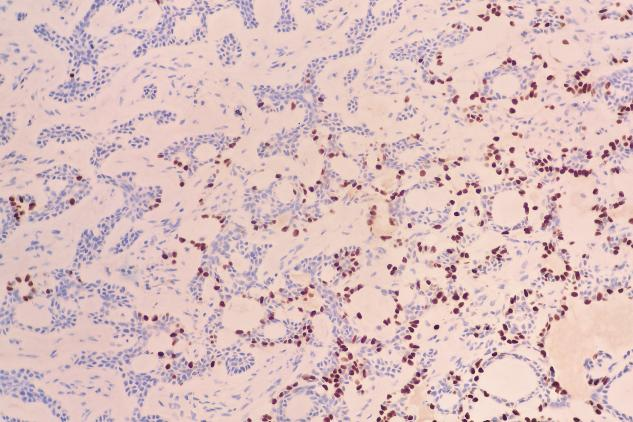
TTF-1(少量+)
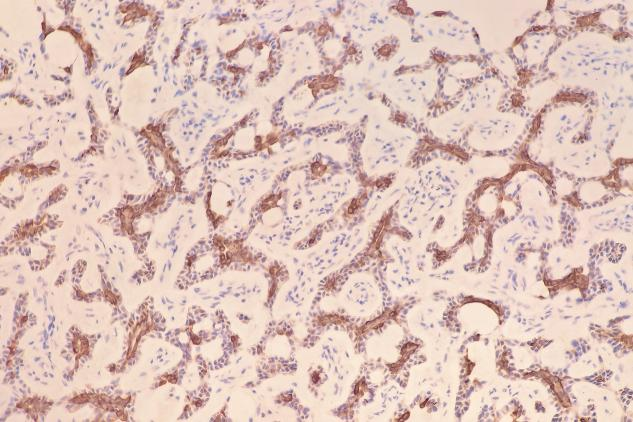
CK5/6(+)
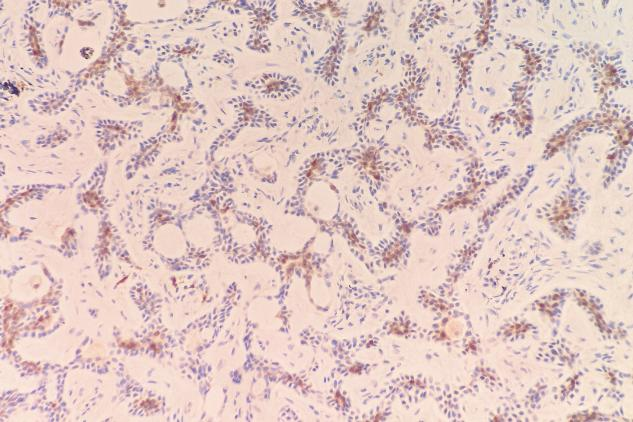
S-100(少量+)
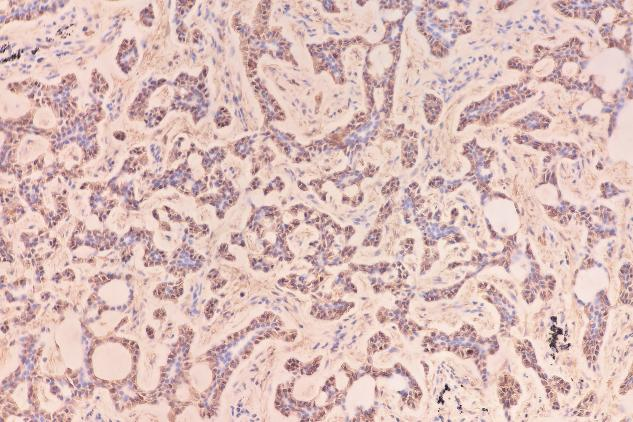
SMA(肌上皮+)
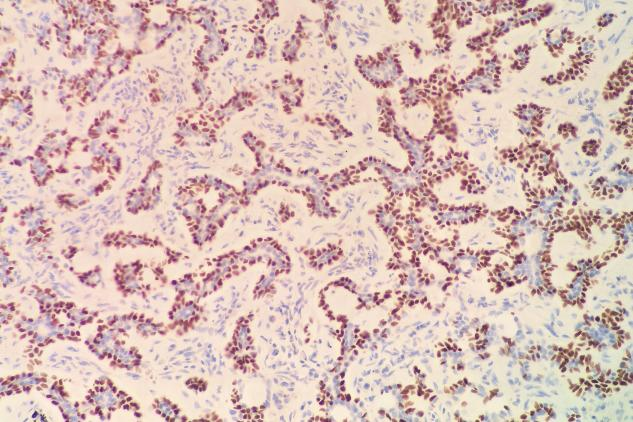
p63(肌上皮+)
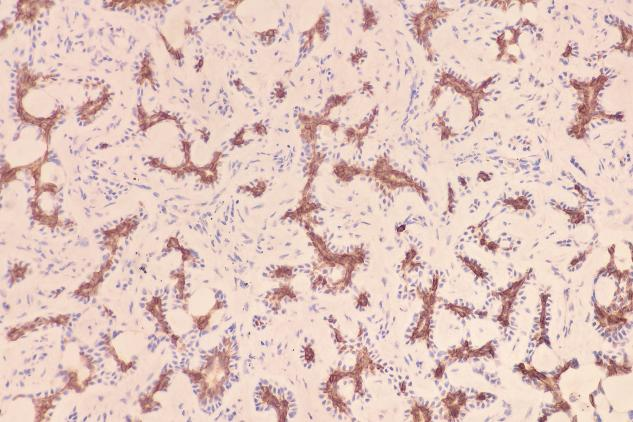
β-catenin(+)
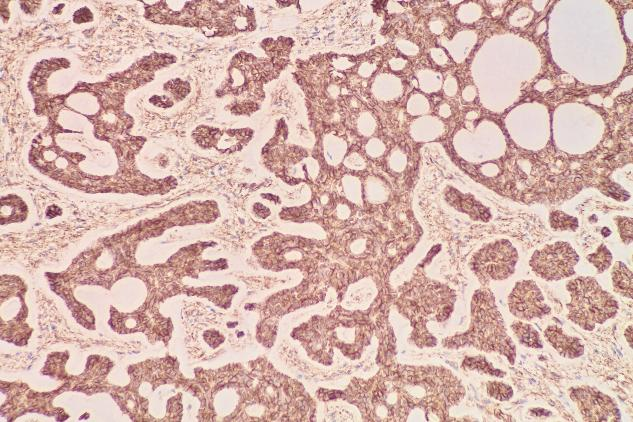
CD117(导管上皮+)
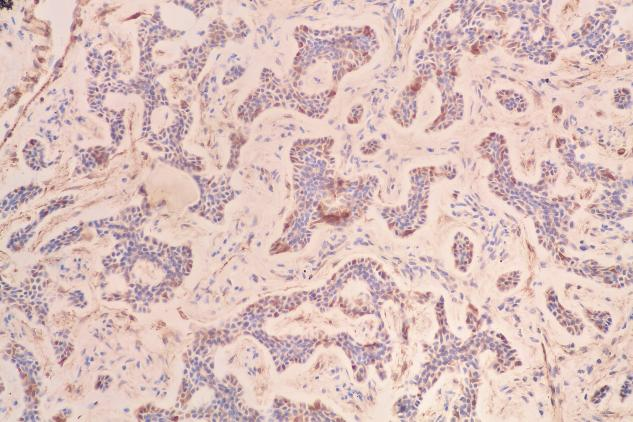
Calponin(部分+)
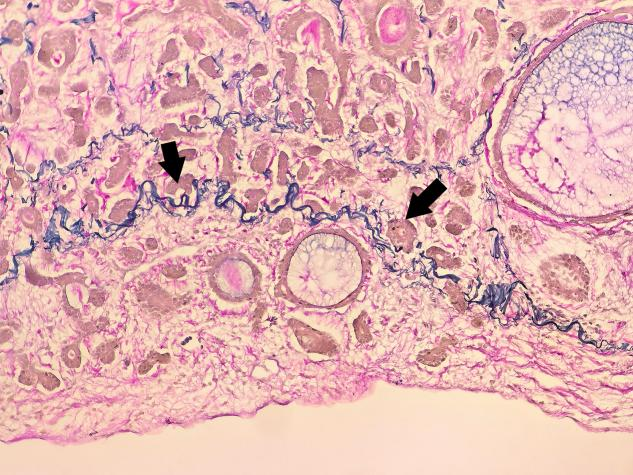
弹力纤维染色(+)侵犯胸膜
04 最终诊断
(右下肺叶)腺样囊性癌,未见明确神经、脉管侵犯,侵犯胸膜,切缘阴性
05 随访
患者术后一个月复查,复查超声右侧胸腔积液,予以胸腔穿刺抽液术,并予以抗肿瘤、对症支持等治疗。术后3个月复查,情况稳定,继续密切随访中。
小结
肺原发性腺样囊性癌(Adenoid Cystic Carcinoma, ACC)是一种罕见的唾液腺型肺部恶性肿瘤,约占所有肺部肿瘤的0.04%-0.2%。其起源于支气管黏膜下的腺体,故好发于主支气管、叶支气管等这些有黏膜下腺体的中央气道,与常见的肺腺癌、鳞癌明显不同。本例发生于肺周边胸膜下,实属罕见。其起源于细支气管黏膜下的腺体,提示肿瘤可沿支气管树一直蔓延到周边部位。发病年龄范围较广,但以40-60岁多见,无明确的性别倾向和吸烟关联。
病理学特征上,肺周边型ACC与中央型形态一致,但因其位置特殊,诊断时更易被误诊为其他常见的周围型肺癌或间皮瘤。 典型的筛孔状、管状结构,一致的基底样细胞,丰富的玻璃样变间质,以及高发的神经侵犯是其诊断要点。免疫组化显示双相分化(CK7+的导管细胞和P63/SMA+的肌上皮细胞) 和CD117(c-kit)的强阳性是强有力的诊断依据。MYB-NFIB基因融合是其特征性的分子遗传学改变,对于不典型病例或与小细胞肺癌、基底样鳞癌等鉴别时,FISH检测具有决定性价值。
鉴别诊断上,本例肿瘤位于肺周边,组织学上为基底样细胞呈筛状生长,需与以下疾病进行鉴别:
1. 基底样鳞状细胞癌: 形态上可与ACC的实体型混淆,也常呈分叶状浸润性生长。但前者细胞异型性更明显,核分裂象多见,无真正的导管分化及筛孔结构。免疫组化上,虽可表达P40和P63,但通常为肿瘤细胞弥漫阳性,且不表达肌上皮标志(SMA、Calponin),CD117通常为阴性或局灶弱阳性。最重要的是,其缺乏MYB-NFIB基因融合。
2. 小细胞肺癌: 肿瘤细胞小,呈蓝色细胞肿瘤形态。但小细胞肺癌细胞核染色深,核仁不明显,挤压假象常见,坏死和核分裂象极其活跃。免疫组化Syn、CgA、CD56阳性,且TTF-1在大多数病例中为阳性。Ki-67增殖指数通常极高(>50%),与ACC的低增殖指数形成鲜明对比。
3. 原发性肺黏液表皮样癌:同为支气管唾液腺型肿瘤,但由黏液细胞、中间细胞和表皮样细胞构成,缺乏ACC典型的筛孔状结构和基底膜样物质。免疫组化P40/P63主要在高分化表皮样细胞中表达,而非肌上皮模式,CD117通常阴性。分子遗传学上常存在MAML2基因重排,而非MYB重排。
临床行为与预后方面,肺ACC生长缓慢,但具有局部高侵袭性的特点。周围型ACC因位置隐匿,早期症状不明显,发现时往往体积较大且已侵犯胸膜等周边结构,可能导致分期更晚。胸膜侵犯是明确的预后因素,增加了治疗难度和复发风险。
治疗与展望,手术完整切除仍是治愈的基石。对于本例伴有胸膜侵犯的情况,术后辅助放疗是标准策略,旨在杀灭残留的微小病灶,显著降低局部复发率。对于晚期患者,化疗效果有限。针对MYB 通路、CD117 以及NOTCH 信号通路等靶点的治疗策略是未来的研究热点。此例罕见的周围型肺ACC报告,旨在提高病理及临床医生对该肿瘤发生部位多样性的认识,避免误诊。
参考文献
1. Moran CA, et al. Primary salivary gland-type tumors of the lung. Adv Anat Pathol. 2019.
2. Coca-Pelaz A, et al. Adenoid cystic carcinoma of the head and neck – An update. Oral Oncol. 2015.
3. Dillon PM, et al. Adenoid cystic carcinoma: A review of recent advances, molecular targets, and clinical trials. Head Neck. 2016.
4. ISHIKAWA H, SATOH H, HIZAWA N. Tracheobronchial adenoid cystic carcinoma mimicking bronchial asthma[J]. Journal of Postgraduate Medicine, 2023, 69(1): 56-58.
5. NING Y, HE W, BIAN D, et al. Tracheo-bronchial adenoid cystic carcinoma: a retrospective study[J]. Asia-Pacific Journal of Clinical Oncology, 2019, 15(4): 244-249.
































共0条评论