[导读] 编译整理:强子
某些散发性肾肿瘤
BRAF p.V600E突变的乳头状肾肿瘤
后肾肿瘤家族包括了主要由上皮成分构成者(后肾腺瘤)、主要由间质成分构成者(后肾间质性肿瘤)、双相型肿瘤(后肾腺纤维瘤)。后肾腺瘤为无包膜的病变,具体为衬覆单层细胞的小管构成,胞质稀少,核分裂罕见或缺失;后肾间叶性肿瘤的特点是梭形细胞围绕陷入的肾小管呈同心圆状生长,并且这些病变常伴有球旁细胞增生及血管发育不良等特征。后肾腺纤维瘤中则既有上皮成分、又有间质成分。
后肾肿瘤的潜在分子特征是存在“热点”BRAF p.V600E改变,可见于近90%的后肾腺瘤、大部分的后肾腺纤维瘤/后肾间质性肿瘤(文献中报道的病例规模相对较小)。需要注意的是,无BRAF p.V600E改变的后肾腺瘤则曾有相关报道称伴有非V600E改变的BRAF异常(如V600D、K601L)、以及其他分子驱动改变(如NTRK3基因重排);文献中伴ALK重排肾细胞癌的罕见病例则与后肾腺瘤存在显著形态学重叠。
鉴于后肾肿瘤大部分都有相同的分子特征,因此其形态学和免疫组化(WT-1阳性)也有重叠,所以已有人提出后肾肿瘤可能是Wilms肿瘤中分化最好的情况。最近有研究表明,具有高分化(上皮为主)特征、Ki-67增殖指数低的Wilms肿瘤有一部分在形态学上和后肾腺瘤存在重叠,且有相似的BRAF p.V600E改变。这一结果说明,鉴于相同的分子改变,部分高分化的Wilms肿瘤和后肾腺瘤可能是密切相关的。
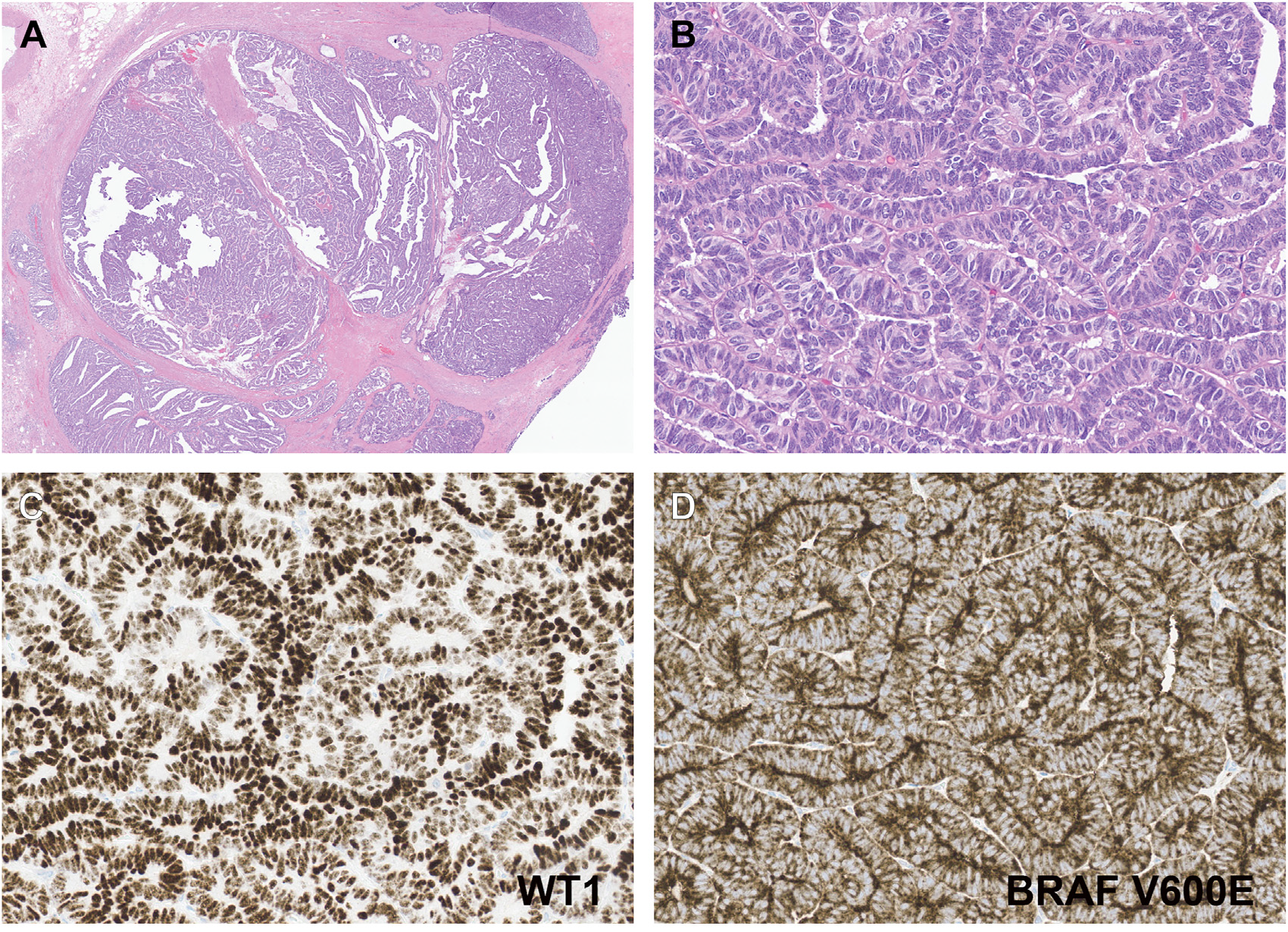 图5.成人发生的Wilms肿瘤代表性形态学所见,免疫组化WT1阳性,BRAF V600E阳性。
图5.成人发生的Wilms肿瘤代表性形态学所见,免疫组化WT1阳性,BRAF V600E阳性。
与BRAF p.V600E突变肾脏肿瘤相关的文献大多着眼于后肾/Wilms肿瘤,但也有BRAF p.V600E突变乳头状肾细胞癌的罕见病例报道。自从第一例BRAF p.V600E突变乳头状肾细胞癌(具有特征性形态、且有7/17号染色体的获得)报道以来,英文文献中报道尚不足10例;其中还包括了一例具有乳头状特征的肾细胞癌(CK7+/WT1-),该癌与一个含有后肾腺瘤(CK7-/WT1+)成分的后肾腺纤维瘤并存。需要注意的是,伴乳头状特征的肾细胞癌以及后肾成分都有BRAF p.V600E改变,说明它们存在克隆相关性。此外,未见7/17号染色体获得的报道,这说明这类肿瘤可能具有不同于乳头状肾细胞癌的分子特征。癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中2例(n=274,占比0.7%)伴BRAF p.V600E突变的乳头状肾细胞癌也并无7/17号染色体的获得,也支持前述可能性。不过,通过免疫组化BRAF V600E对394例乳头状肾细胞癌进行筛查,并未检出更多病例,说明BRAF p.V600E突变乳头状肾细胞癌的确为罕见肿瘤类型,其在伴乳头状特征的肾细胞癌中占比大约为0.3%(2/668)。文献中另外还有2例提示该肿瘤与后肾腺瘤存在形态学重叠、且为CK7+/CD57+/BRAF V600E+/WT1-免疫表型、无7/17号染色体的获得。最后需要注意的是,尽管这部分肿瘤似乎为惰性,但仍有部分病例显示集合系统受累,这可能导致肿瘤分期升高。对于这类肿瘤,曾提出过“肾源性乳头状肿瘤”(nephrogenic papillary neoplasm)的命名;但尚需更多研究来更好的定义BRAF p.V600E突变乳头状肾脏肿瘤的临床病理特征。
伴MTOR/TSC1/TSC2改变的肾血管母细胞瘤
血管母细胞瘤主要报道于中枢神经系统,既可见于散发病例,也可见于综合征相关病例。伴VHL病的患者一般表现为视网膜血管母细胞瘤,而小脑是中枢神经系统受累时的常见部位。罕见情况下,该肿瘤也曾报道于外周神经系统和其他部位,其中也包括肾脏。不过,目前普遍认为,肾脏血管母细胞瘤尚未见报道于VHL病背景下或与VHL基因致病性变异相关的情况下。
以往报道的肾脏血管母细胞瘤免疫表型为程度不等阳性表达inhibin和S100,但最近的研究表明这类肿瘤的PAX8阳性是不同于中枢/外周神经性系统相应肿瘤的。目前的研究已证实,此类肿瘤表现出CA9的细胞膜弥漫阳性,日常工作中已将这一现象用作VHL基因功能缺失性改变的替代性标记。这种情况下,伴广泛退行性改变的透明细胞肾细胞癌与肾血管母细胞瘤鉴别可能很困难,因为二者均为PAX8/CA9阳性。不过,免疫组化表达inhibin和S100,支持肾血管母细胞瘤的诊断。
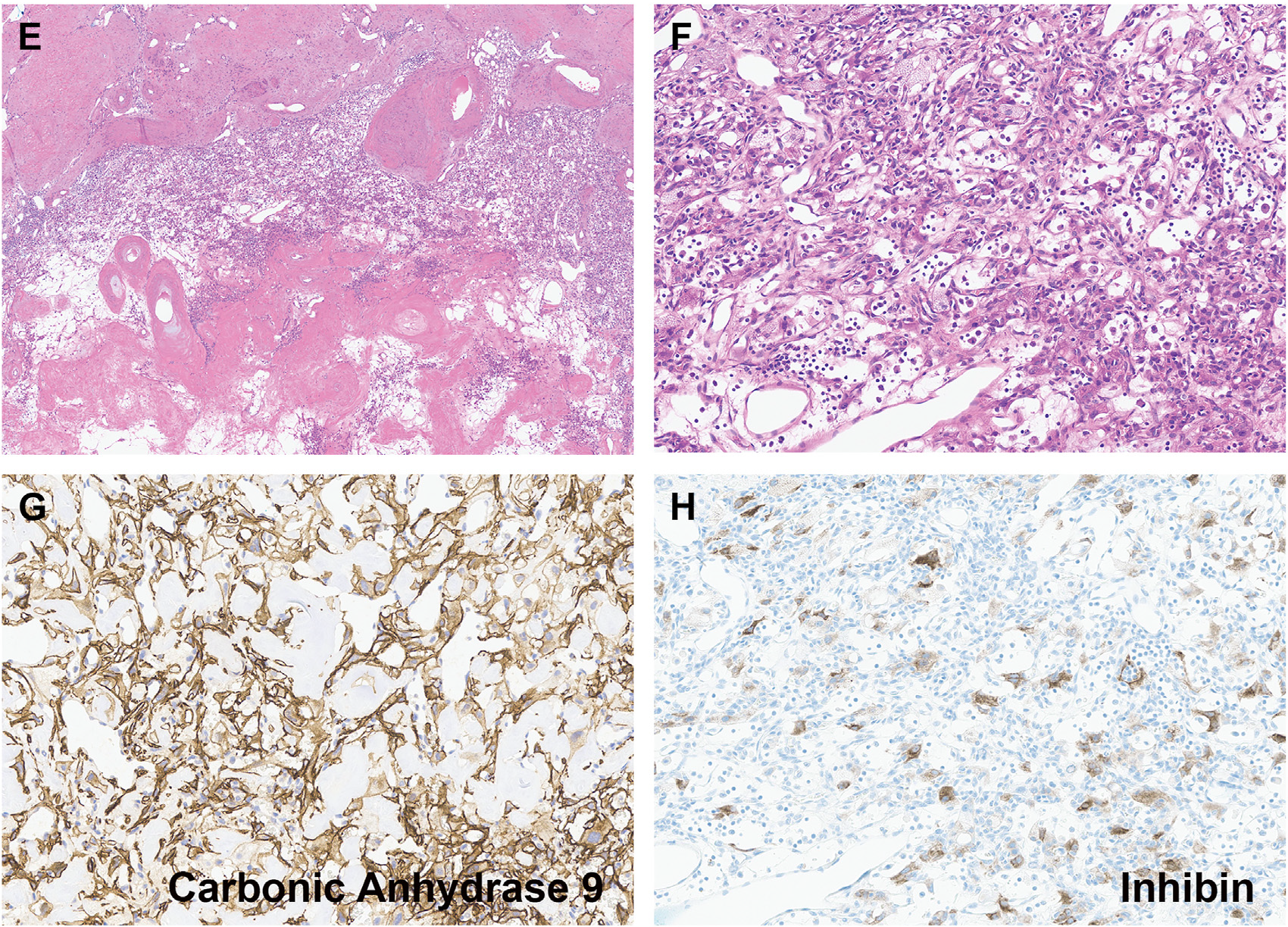 图6.(上)肾血管母细胞瘤HE所见,与伴退行性改变的透明细胞肾细胞癌存在显著形态学重叠。与伴退行性改变的透明细胞肾细胞癌相似,肾血管母细胞瘤免疫组化CA9为细胞膜着色(左下);不过,该肿瘤一般阳性表达inhibin(右下)。二代测序证实本例存在MTOR基因的致病性改变,未见VHL基因改变。
图6.(上)肾血管母细胞瘤HE所见,与伴退行性改变的透明细胞肾细胞癌存在显著形态学重叠。与伴退行性改变的透明细胞肾细胞癌相似,肾血管母细胞瘤免疫组化CA9为细胞膜着色(左下);不过,该肿瘤一般阳性表达inhibin(右下)。二代测序证实本例存在MTOR基因的致病性改变,未见VHL基因改变。
鉴于近期对具有透明细胞特征的肾细胞肿瘤提出了大量新的鉴别诊断,因此肾血管母细胞瘤的诊断标准仍不明确。
伴肾素过表达的球旁细胞瘤
肾球旁细胞瘤(juxtaglomerular cell tumors,JCTs)起源于肾小球旁器(juxtaglomerular apparatus)内专职的产生肾素的细胞。与血管球瘤相似,肾球旁细胞瘤也起源于血管周间质细胞;不过,与血管球瘤不同,肾球旁细胞瘤仅位于肾脏,常表现出由肾素过度表达引起的副肿瘤现象,如高血压和低钾血症。文献中也有无功能性肾球旁细胞瘤的罕见病例报道。
由于肾球旁细胞瘤临床并无特异性,且病理医师评估相关病变时一般并不知道术前高血压的典型病史,因此常导致诊断困难。此外,该肿瘤相对小,但形态谱系宽泛,且因为罕见而导致对其诊断性特征了解很少。
肾球旁细胞瘤最常见的组织学表现为片状及结节状血管周肿瘤,细胞为圆形至卵圆形的形态单一表现,细胞分界清晰。第二常见特点为梭形细胞增生,偶有陷入的(PAX8阳性的)肾小管,因此形成双相型表现。
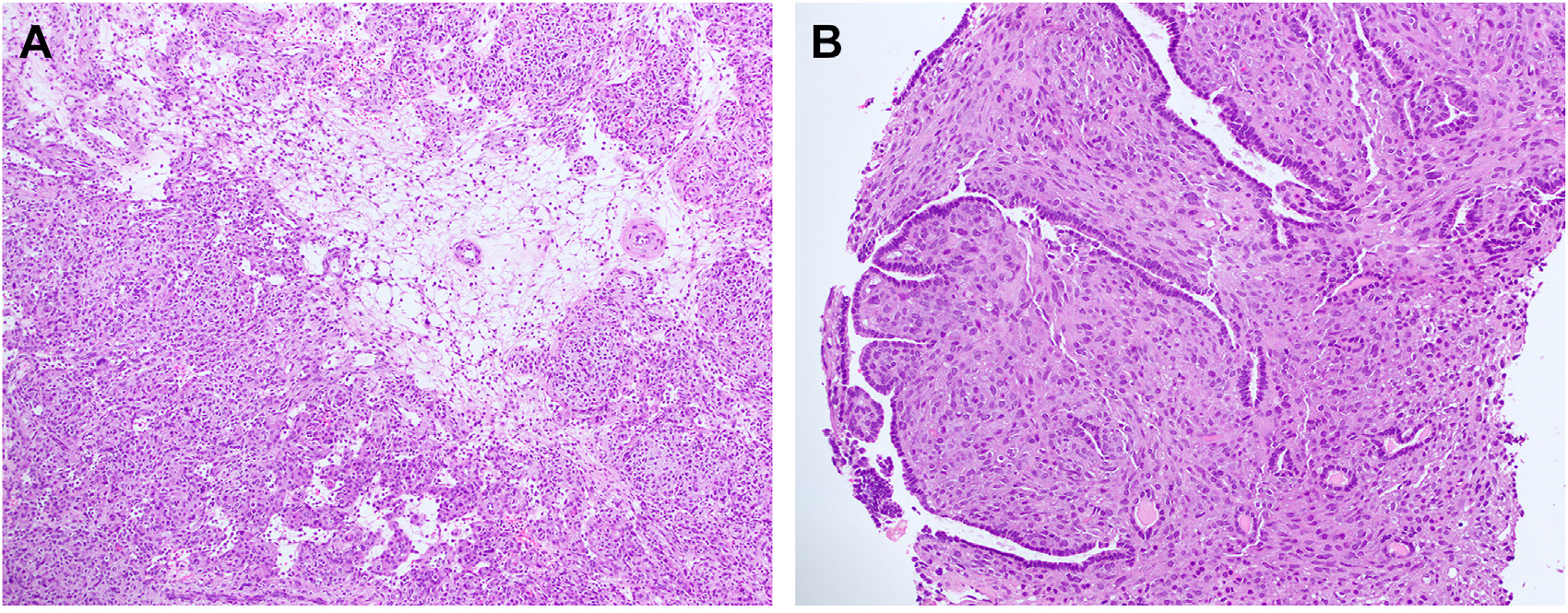 图7.肾球旁细胞瘤形态学表现,左图示片状及结节状血管周肿瘤形态,右图示双相型表现。
图7.肾球旁细胞瘤形态学表现,左图示片状及结节状血管周肿瘤形态,右图示双相型表现。
肾球旁细胞瘤的诊断中,肾素免疫组化染色(以非肿瘤性肾脏中的球旁细胞作为阳性内对照)或在电子显微镜下观察到菱形晶体(rhomboid crystals)具有诊断意义,但大多数临床医疗机构基本上无法进行这些检查。肾球旁细胞瘤中常为阳性的其他标记物还有SMA、CD34、IV型胶原;不过这些标记物并不能鉴别肾球旁细胞瘤和形态学可能相似的血管球瘤。关于该肿瘤中的CD117阳性还有争议,因为最近有研究表明其CD117的表达与浸润的胰蛋白酶阳性肥大细胞位置相同。此外,最近还有研究提出GATA3可作为部分肾球旁细胞瘤诊断的替代性标记。
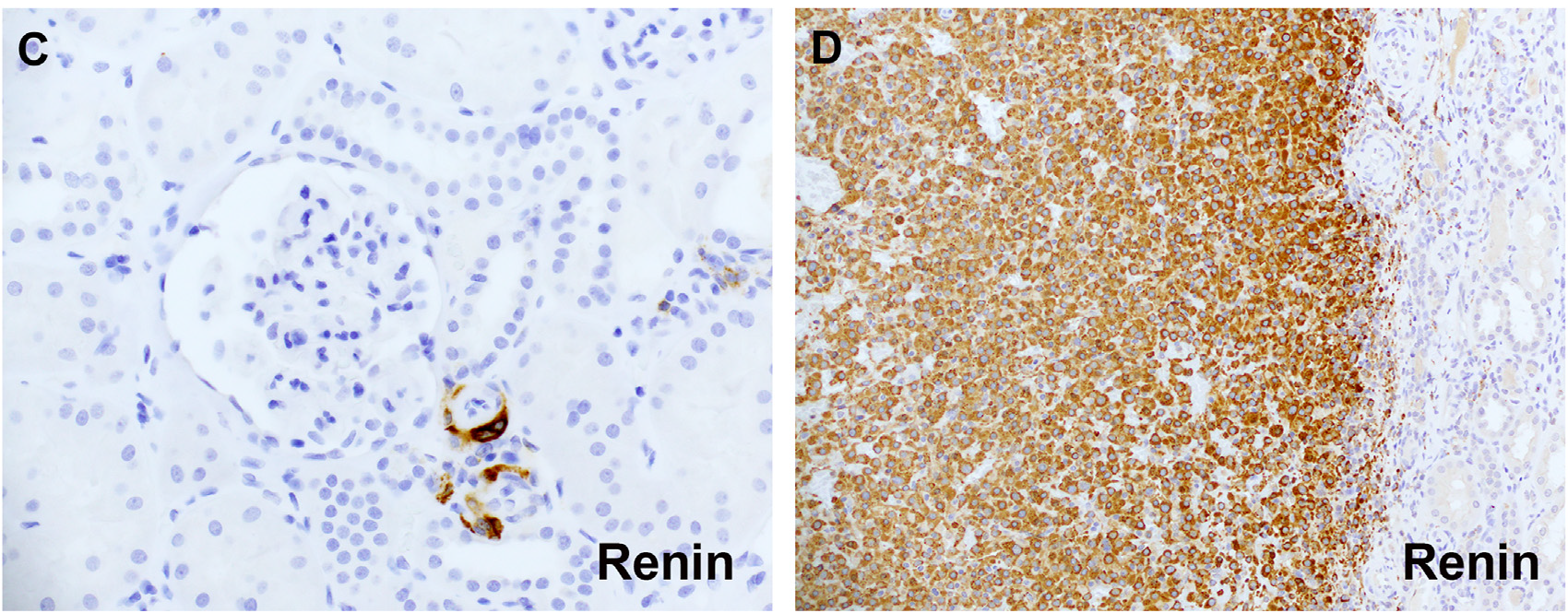 图8.肾素免疫组化,左侧示非肿瘤性球旁细胞有着色,右侧示肾球旁细胞瘤及相邻肾实质的着色表现。
图8.肾素免疫组化,左侧示非肿瘤性球旁细胞有着色,右侧示肾球旁细胞瘤及相邻肾实质的着色表现。
此前的细胞遗传学研究表明,肾球旁细胞瘤中的染色体异常包括9号染色体和X染色体的缺失、以及伴有10号染色体的获得。全外显子测序研究表明该肿瘤并无重复性基因改变,但有伴BRAF p.G469A、或伴KRAS p.G12D改变而提示MAP激酶信号通路失调的罕见病例。目前也有少数基因表达谱研究,证实肾球旁细胞瘤中肾素基因表达水平显著升高。虽然最近有研究称肾球旁细胞瘤存在NOTCH1的活性重排,大部分血管球瘤也存在这一特征,但尚无独立研究重现这一结果。有一项基因表达研究已提出,肾球旁细胞瘤中存在NOTCH1信号通路的失调;还有一项研究发现该肿瘤中存在Wnt信号通路转录调节因子(SFRP1和SFRP4)及GATA3的失调。Wnt信号通路的增强与此前报道一致:该肿瘤有部分病例β-catenin免疫组化定位于细胞核。
肾球旁细胞瘤大部分都可通过手术切除而治愈,但也有转移的罕见病例报道;且由于该肿瘤罕见,因此还不清楚转移性肿瘤是否有遗传学异常。尚需更多研究来更好的确定该肿瘤的生物学行为。相比其他较为常见的肿瘤来说,对该肿瘤中肾素过表达所致副肿瘤综合征加强研究,也有重要的临床意义。比如最近一项研究表明,在肾透明细胞癌的肿瘤微环境中,虽然肾素表达的升高水平远低于肾球旁细胞瘤,但也与高血压的高发生率相关,并且这些患者在接受血管紧张素信号通路抑制剂治疗后,可能会显示出更好的预后。
未完待续
往期回顾:
其他罕见亚型肾细胞癌及少见临床表现(一)
其他罕见亚型肾细胞癌及少见临床表现(二)

















共0条评论