[导读] 作者:陈旭
病史
男,25岁,右侧腰部隐痛4天,肉眼血尿1天。CT:右肾形态欠规整,右肾中下部:团块状囊实混杂密度影,可见厚薄不均囊壁,大小约为4.5cm×2.8cm,增强扫描病变不均匀强化,动脉期强化较明显,倾向肿瘤可能。行右侧肾脏肿瘤根治术。
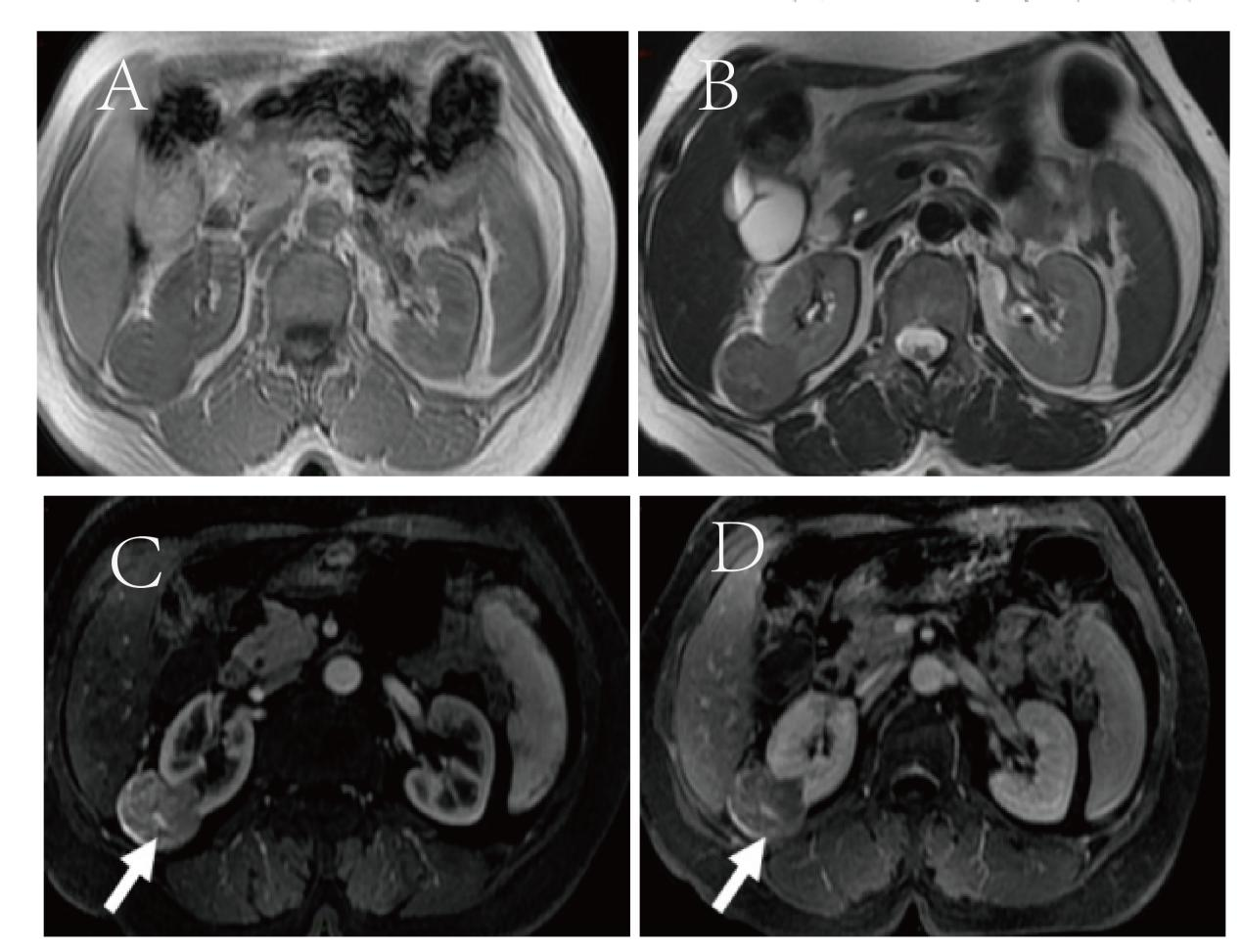
图1.患者影像资料(CT)。(A)T1WI呈等信号;(B)T2WI信号低于肾实质;(C、D)增强扫描动脉期及实质期病灶均呈网格状不均匀强化,其内可见条索状强化血管影(白色箭头)。
大体观察
右肾大小11cm×10.5cm×6.5cm,表面包膜完整,上附输尿管一段,长9cm,直径0.8cn。肾脏切面中-下极可见灰褐肿物,大小4.8cm×3.1cm×2.5cm,大部分呈实性,灰红、灰褐色,部分为囊性,囊腔直径 0.3~0.8cm,质地中等。另见脂肪组织一堆,大小5cm×4cm×2cm。

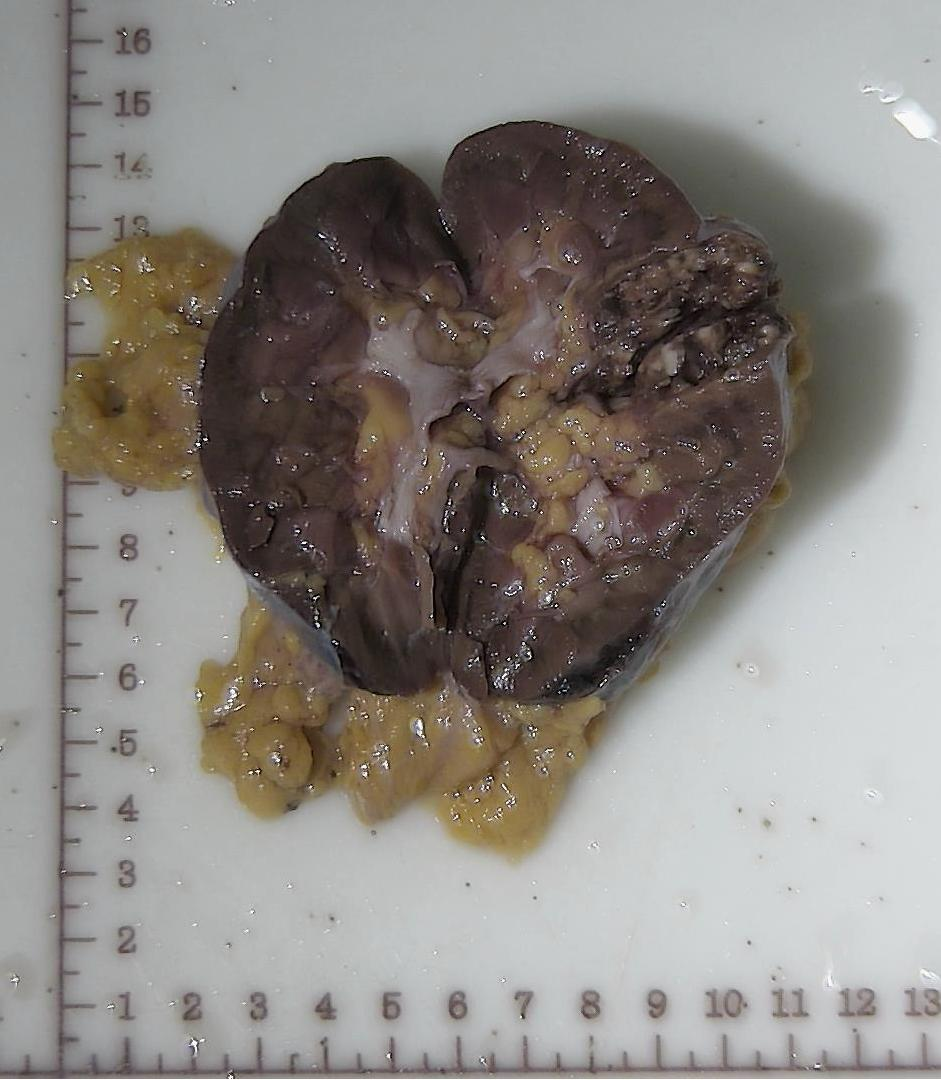
图2.手术切除标本大体观察。肿物位于肾脏中下极,为蓝色箭头所示处。
组织学特点
肿瘤细胞绝大部分由上皮样细胞组成,细胞数量占肿瘤的95% 。肿瘤细胞排列呈弥漫片状及旋涡,不规则或血管外皮瘤样。肿瘤细胞体积大,胞质宽且透明,其间仔细寻找可见胞质嗜酸的带状细胞。细胞核圆形或椭圆形、偏位,有一定的异型性,可见双核和多核肿瘤细胞,并可见核分裂象,核染色质空泡状,核仁明显居中。肿瘤细胞之间和间质内可见单核细胞、淋巴细胞和浆细胞浸润,可见多灶性坏死、出血和含铁血黄素沉着。
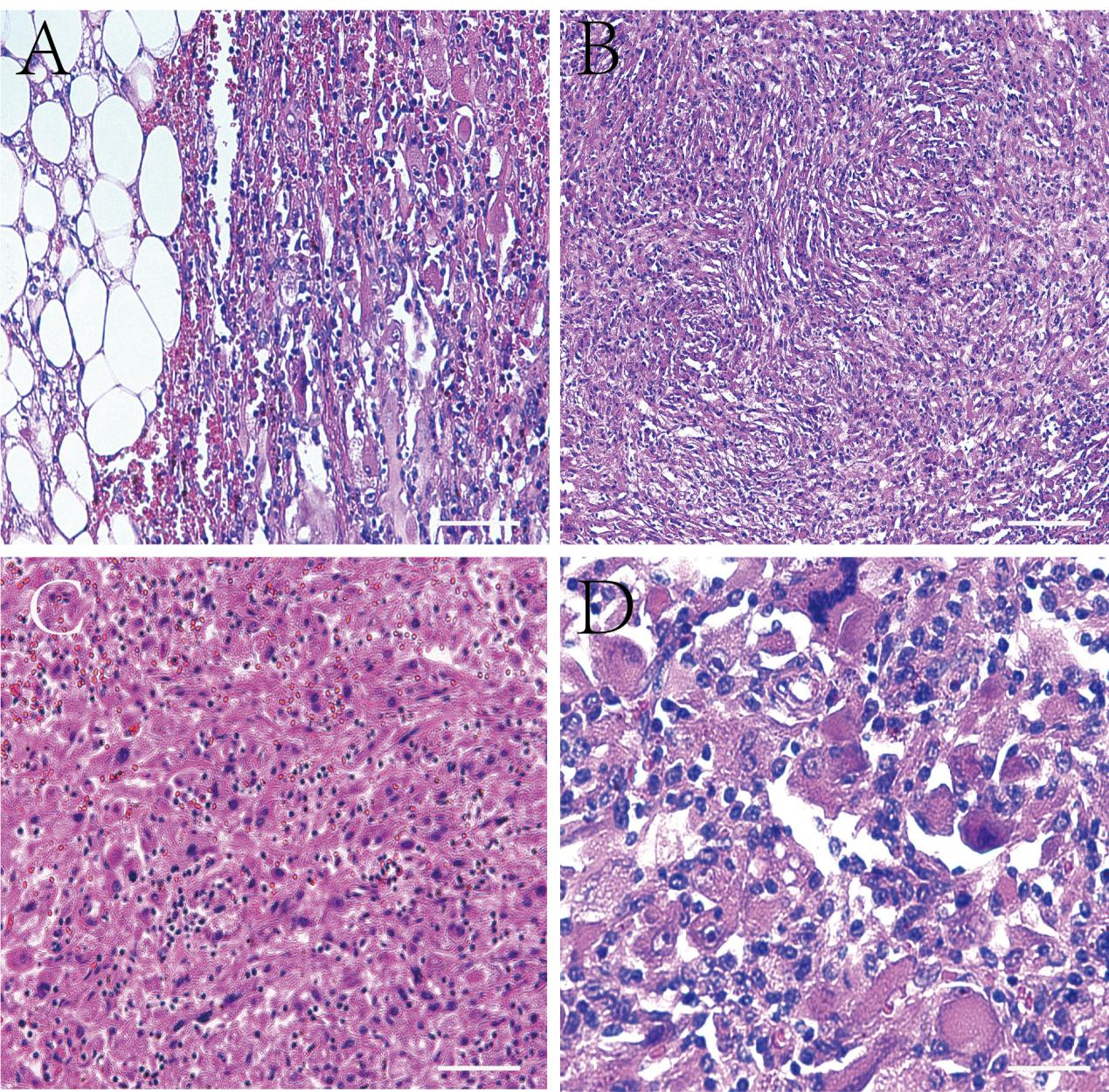
图3.组织学形态特点。(A)低倍镜下(4X,标尺为200μm),可见肿瘤侵犯肾脏背膜,大小细胞混杂分布;(B)低倍镜下(10X,标尺为100μm),可见肿瘤细胞排列成旋涡状、片状分布;(C)中倍镜下(20X,标尺为50μm),肿瘤细胞体积大,胞质宽且透明,胞质嗜酸性,可见核偏位,肿瘤细胞轻至中度异型,其间混杂淋巴细胞、浆细胞及红细胞,灶状区域可见含铁血黄素颗粒;(D)高倍镜下(40X,标尺为20μm)可见双核和多核肿瘤细胞,并可见核分裂象,核染色质空泡状,核仁明显居中。
免疫组化
CK7(-),Vimentin(+),RCC(-),CA9(-),HMB45(+),MelanA(+),S-100(-),CD34(-),SMA(+),TFE-3(+),Ki-67(增殖指数为20%)。
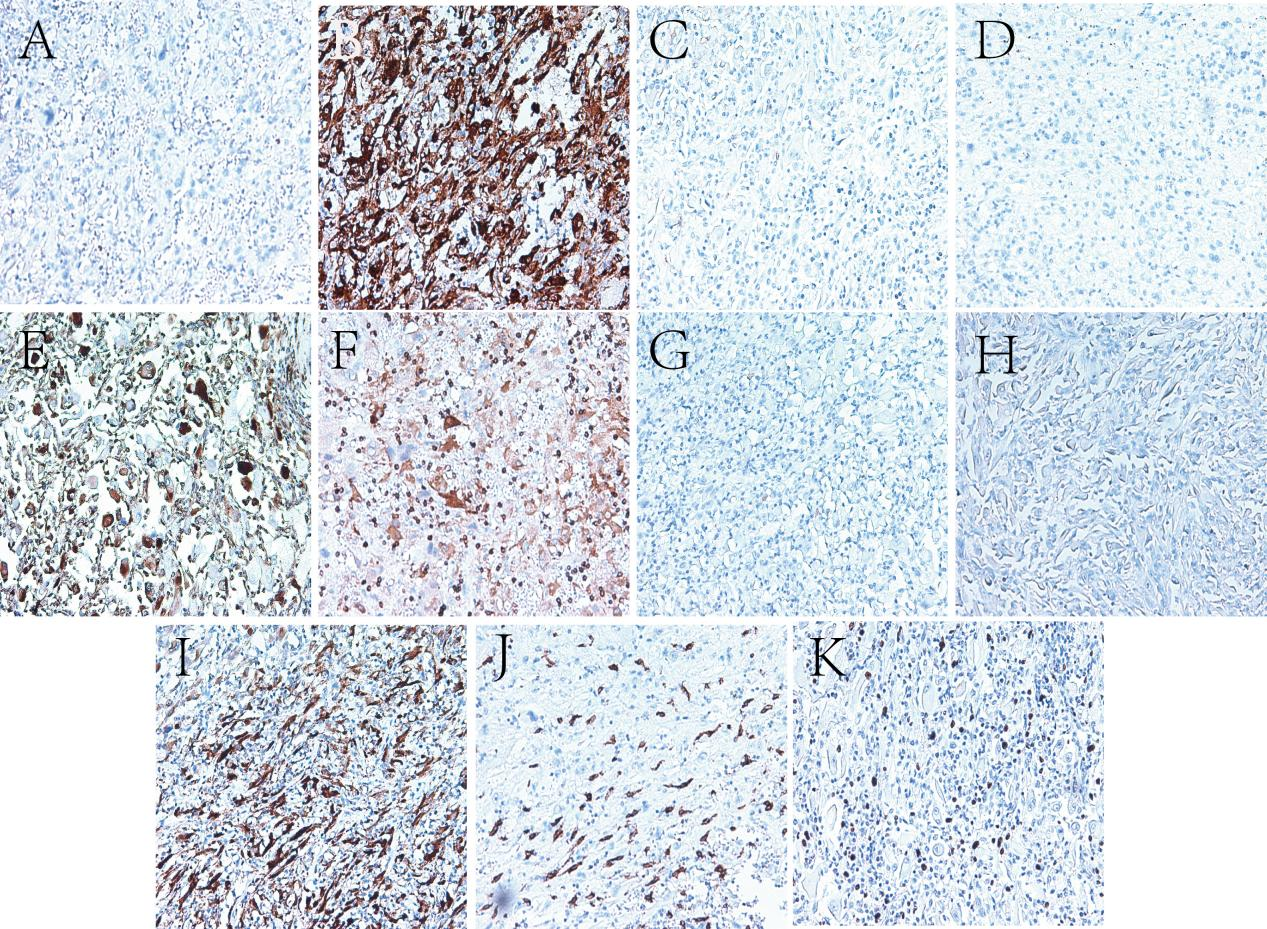
图4.免疫组化染色。(A)CK7;(B)Vimentin;(C)RCC;(D)CA9;(E)HMB45;(F)Melan-A;(G)S-100;(H)CD34;(I)SMA;(J)TFE3;(K)Ki-67
分子检测结果
TFE3 FISH检测结果显示:TFE3断裂阳性。
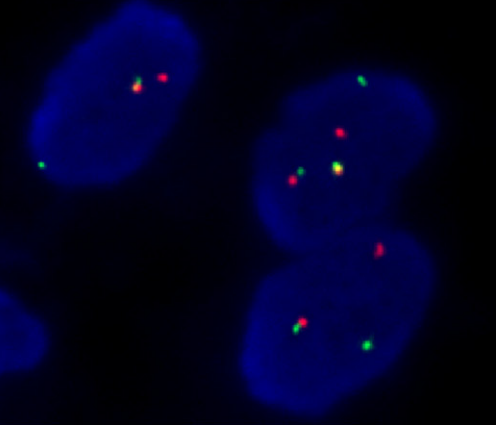
图5.FISH检测结果显示,TFE3断裂阳性,提示存在TFE3基因重排。
最终诊断
(右肾)肾脏恶性上皮样血管平滑肌脂肪瘤,伴TFE3基因重排,肿瘤累及肾脏背膜。肾周脂肪、肾盂肾窦及输尿管切缘未见肿瘤累及。
随访
术后13个月在右肺中下叶查见一直径约为1.6cm结节,遂行CT引导下肺部病变穿刺活检术。低倍镜下,上皮样肿瘤细胞浸润肺泡。高倍镜下,肿瘤细胞体积大,胞质嗜酸,可见核分裂及核仁。免疫组化染色提示:TTF-1(-),Vimentin(+),SMA(+),HMB45(+),Melan-A(+),S-100(-),TFE3(+),Ki-67(增殖指数约为30%)。最终诊断为(右肺)转移性肾脏恶性上皮样血管平滑肌脂肪瘤。患者于2024年8月15日口服替西罗莫司(250mg,每日1次)治疗,随访至今,肿瘤大小不变,无新发转移瘤。
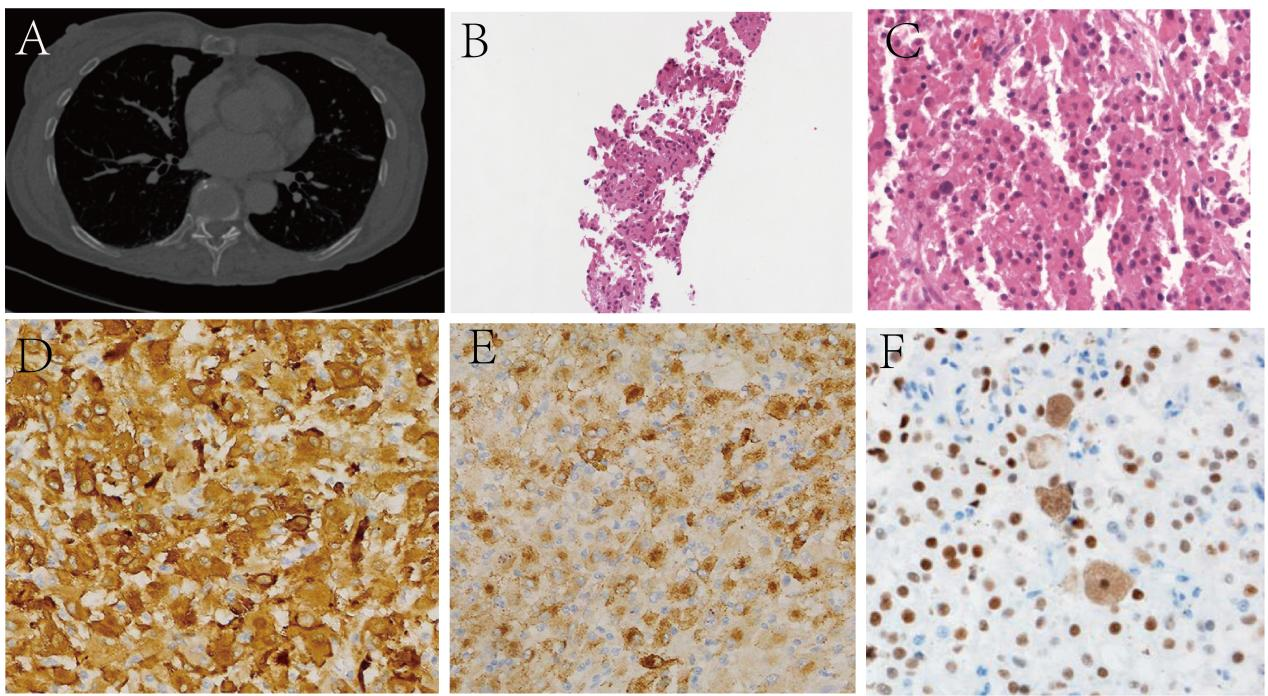
图6.患者复查资料。(A)CT提示右肺中下叶结节;(B)穿刺组织低倍镜下可见上皮样肿瘤细胞(10X);(B)高倍镜下(40X),上皮样肿瘤细胞体积大,可见多核及核偏位,胞质嗜酸,可见异型及核分裂像;(D)HMB45;(E)SMA;(F)TFE3。
讨论
肾脏上皮样血管平滑肌脂肪瘤(epithelioid angiomyolipoma,EAML)为血管平滑肌脂肪瘤(angiomyolipoma,AML)的上皮样亚型。肾EAML少见,占手术切除AML的4.6%。EAML多数为良性,但部分病例临床表现为侵袭性肿瘤,术后很快出现复发和远处转移,恶性程度高,为致死性疾病。
EAML主要或几乎全部由上皮样细胞构成,同时可具有少量经典AML的血管和脂肪成分。在病理诊断时以下三点最重要:(1)大量上皮样细胞在血管周围呈套袖样排列。肿瘤细胞圆形或多角形,细胞核较大,核仁明显,可见核分裂象。常出现多核瘤细胞及神经节样细胞,有时可见出血、坏死灶。(2)异常的厚壁血管和血窦及极少许经典的AML成分。广泛取材仔细寻找厚壁血管和经典的AML成分对明确诊断肾EAML有帮助。(3)免疫组化对诊断EAML有决定性意义。上皮样细胞表达黑色素细胞标记(HMB-45、Melan-A),不同程度表达平滑肌细胞标记(如SMA和MSA),但不表达上皮性标记物。
目前病理上良恶性判断多参考Brimo与Nese提出的预测与评分标准。Brimo提出的判断标准基于组织学:①≥70%的不典型上皮样细胞;②核分裂象≥2/10HPF;③不典型核分裂象;④坏死。出现3个及以上判断指标,则高度提示恶性。Nese的判断标准则强调肿瘤的侵袭性生长方式,首先必须为EAML,按以下预测因子分组:①伴有结节性硬化;②肿瘤大小>7cm;③实性巢片状的生长方式;④侵犯肾周脂肪或肾静脉;⑤坏死。其中满足4-5个预测因子属于高度危险组。有研究认为免疫组化Ki-67的表达水平也是良恶性判断及预后的指标。
目前有研究表明,约10%的病例与结节性硬化综合征(TSC)的肿瘤抑制基因(TSC1、TSC2)缺失突变有关。部分病例可见TFE3基因易位。
主要鉴别诊断包括肾细胞癌、肾肉瘤、黑色素瘤、嗜酸性细胞腺瘤、Xp11.2相关性肾癌。根据各自形态学特点和免疫组化,可与EAML鉴别。
对于局限性EAML的治疗,手术治疗是唯一有可能治愈的手段。而对于转移性EAML的治疗,目前仅见少数病例报告,缺乏公认有效的治疗方法。
参考文献
1. Brimo F, Robinson B, Guo C, Zhou M, Latour M, Epstein JI. Renal epithelioid angiomyolipoma with atypia: a series of 40 cases with emphasis on clinicopathologic prognostic indicators of malignancy. Am J Surg Pathol. 2010 ;34(5):715-22. doi: 10.1097/PAS.0b013e3181d90370. PMID: 20410812.
2.Wang D, Gong G, Fu Y, Zhu L, Yin H, Liu L, Zhu Z, Zhou G, Yan A, Lei G, Chen C, Pang P, Yi X, Kuang Y, Chen BT. CT imaging findings of renal epithelioid lipid-poor angiomyolipoma. Eur Radiol. 2022 ;32(7):4919-4930. doi: 10.1007/s00330-021-08528-y. PMID: 35124718.
3. Guo G, Gu L, Zhang X. Everolimus in Invasive Malignant Renal Epithelioid Angiomyolipoma. Front Oncol. 2021 ;10:610858. doi: 10.3389/fonc.2020.610858. PMID: 33575217.
4. Salles DC, Asrani K, Woo J, Vidotto T, Liu HB, Vidal I, Matoso A, Netto GJ, Argani P, Lotan TL. GPNMB expression identifies TSC1/2/mTOR-associated and MiT family translocation-driven renal neoplasms. J Pathol. 2022 ;257(2):158-171. doi: 10.1002/path.5875. PMID: 35072947.
5. Saoud R, Kristof TW, Judge C, Chumbalkar V, Antic T, Eggener S, Modi P. Clinical and pathological features of renal epithelioid angiomyolipoma (PEComa): A single institution series. Urol Oncol. 2022 ;40(2):18-24. doi: 10.1016/j.urolonc.2021.09.010. PMID: 34815169.
6. Collins K, Bridge JA, Mehra R, Mannan R, Dickson BC, Lotan TL, Idrees MT, Ulbright TM, Acosta AM. Renal epithelioid angiomyolipomas overexpress TFE3 and the TFE3-regulated gene TRIM63 in the absence of TFE3 rearrangement. Virchows Arch. 2024 ;485(3):471-478. doi: 10.1007/s00428-024-03855-z. PMID: 38971946.



















共0条评论