[导读] 作者:陈旭
临床病史
女性患者,15岁,左侧腮腺无痛性肿物进行性增大半年;既往体健。于我院头颈外科就诊,门诊查体提示:左侧腮腺触及约4cm×4cm×3cm质韧肿物,边界尚清,活动稍差,无红肿、压痛;全身未见浅表淋巴结肿大。实验室检查无明显异常。超声检查提示:于左侧腮腺内探及3cm×3cm×1.2cm低回声肿块,腮裂囊肿可能。MRI检查提示:左腮腺见结节状异常信号,T1WI与肌肉相比呈等信号,T2WI呈稍低信号、低于邻近腮腺信号,考虑肿瘤可能。遂于我院行左侧腮腺肿物切除术治疗。
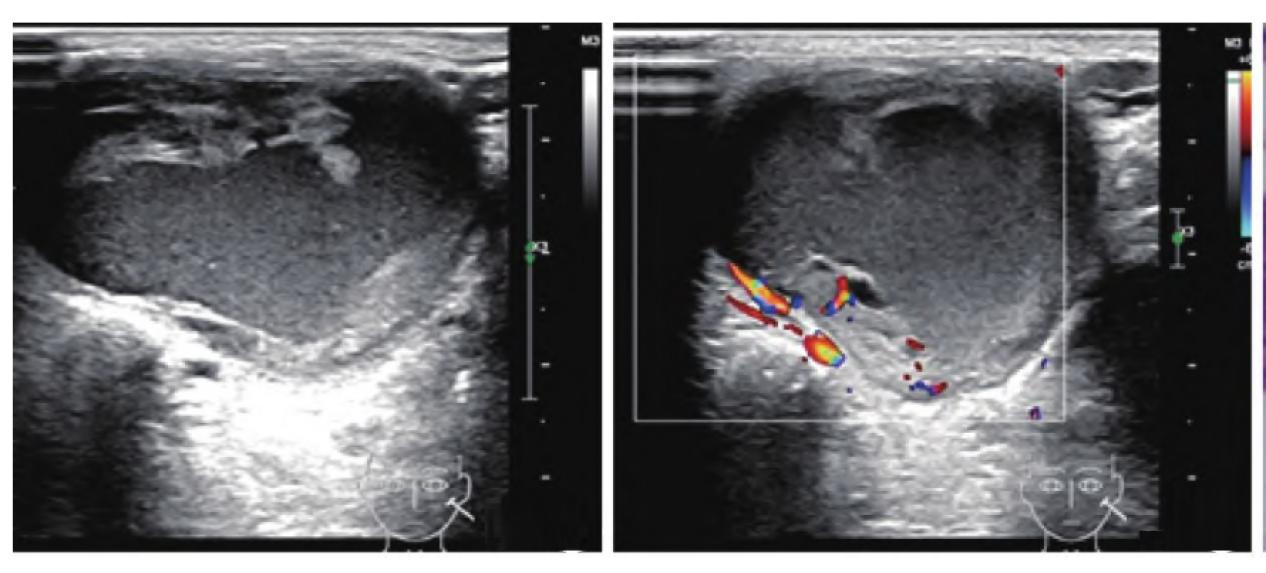
图1.患者超声资料。低回声肿块,边界清晰,形态规则,可见厚壁及呈稍高回声的实性凸起,中心充满密集点状等回声,后方回声增强(左图);CDFI于肿块壁及实性部分见血流信号(右图)。
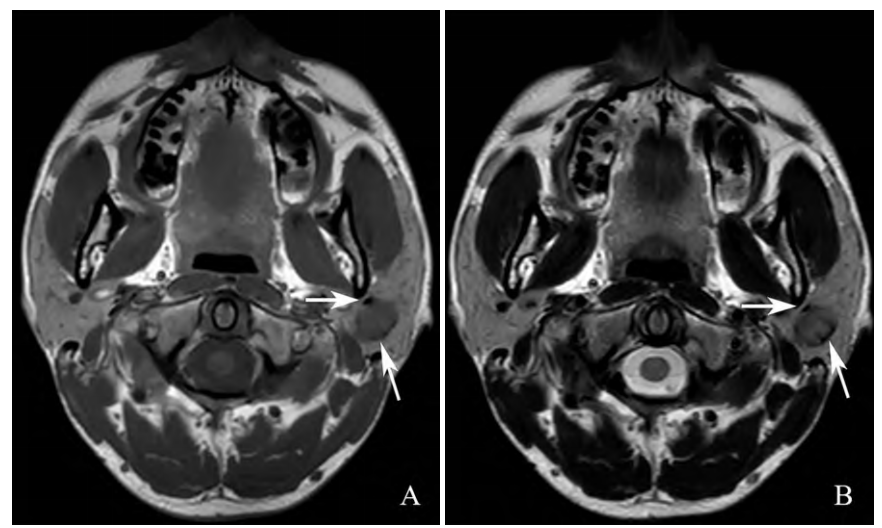
图2.患儿影像资料。(A)MRI平扫横断位T1WI示左侧腮腺区椭圆形等信号影,边缘见弧形低信号(箭头所示);(B) 横断位 T2WI呈稍低信号,病灶边缘见弧形低信号影(箭头所示)。
术中所见
患儿行左腮腺浅叶及肿物切除术+面神经解剖术+邻位瓣转移修复术,沿左侧耳垂下切开至下颌角下缘1.5cm,切开皮肤、皮下组织、颈阔肌,显露腺体,术中见面神经总干及颞面干紧邻肿物,解剖面神经分支并保护,完整摘除肿瘤及腺体浅叶。
大体观察:(左侧腮腺肿物)灰褐不整组织一块,大小3.2cm×3.2cm×1.9cm,切面灰褐囊实性,与周围组织界限清。
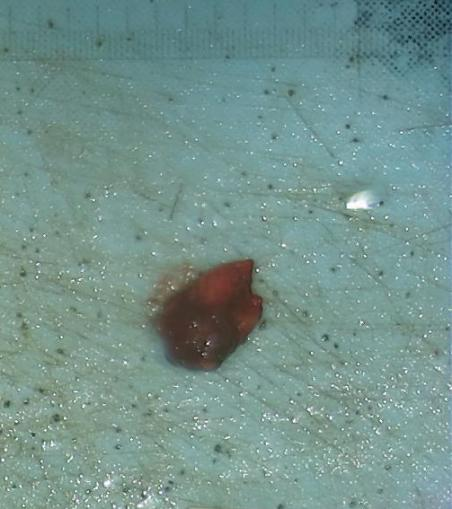
图3.标本大体。病变上附着少许脂肪与涎腺组织,病变与周围组织界限清。
组织形态学特点
低倍镜下病变局部区域呈囊性,囊壁为纤维组织,厚薄不一,囊腔内可见肿瘤细胞围绕纤维血管轴心形成乳头状或筛状/微囊状结构,类似乳腺导管内乳头状肿瘤,局灶浸润囊壁,未见坏死;高倍镜下,囊内肿瘤细胞与囊壁内衬细胞形态学相同,大小较一致、形态温和、轻度异型,圆形或多边形,胞质丰富嗜酸性,细胞核圆形或椭圆形,核仁不明显,核分裂象少见;囊壁外侧可见正常脂肪组织,未见肿瘤。
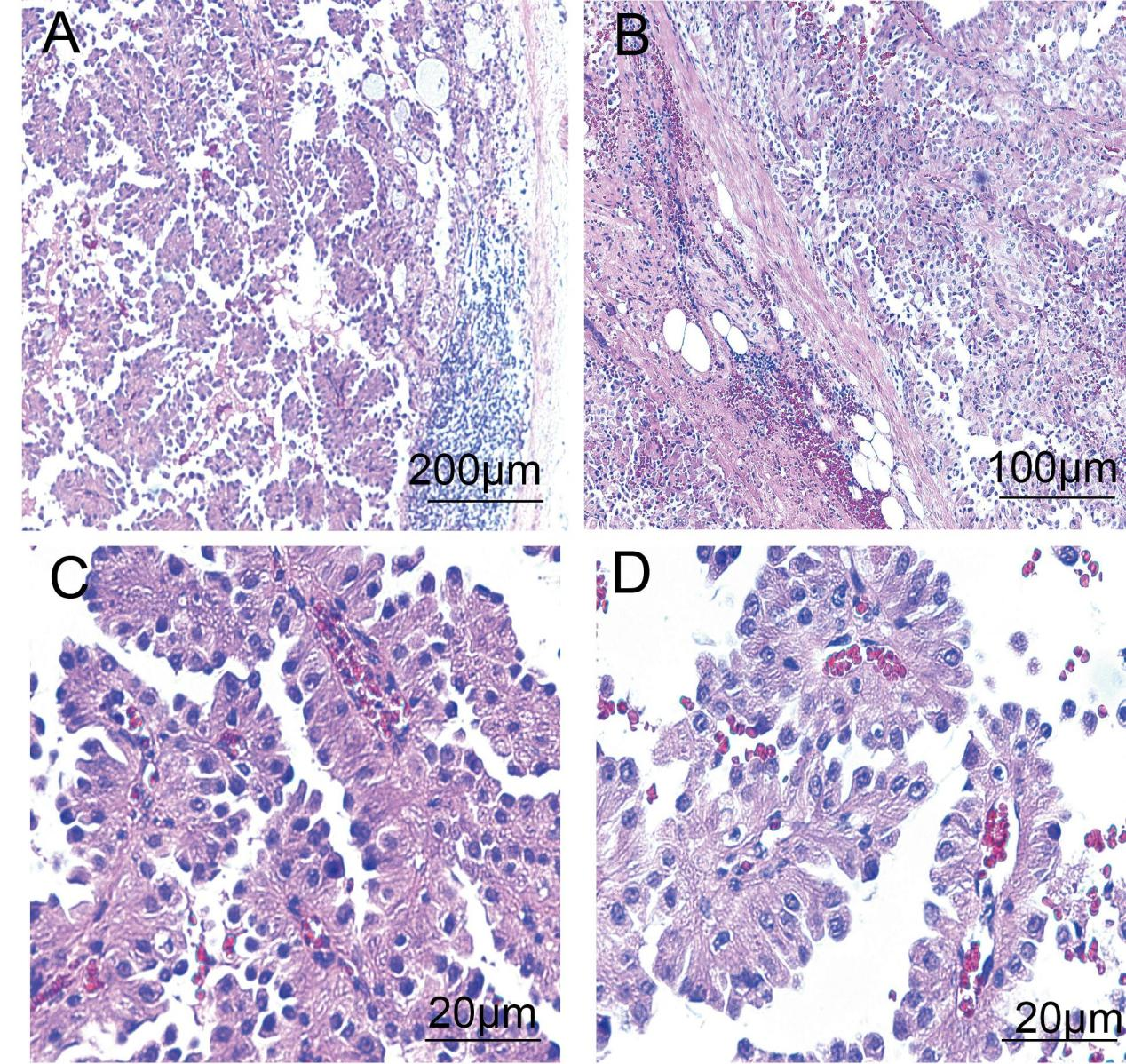
图4.组织学形态特点。低倍镜下,(A,4x)肿瘤与周围囊壁界限清,肿瘤细胞排列成乳头状,部分区域可见微囊状结构;(B,10X)肿瘤灶状区域累及囊壁,周围组织伴出血及纤维化,未见坏死;高倍镜下,(C,40X)肿瘤细胞围绕纤维血管排列成分支乳头状,(D,40X)核分裂相罕见。
免疫组化染色结果
CK7(+),S-100(+),Mammaglobin(+),Vimentin(+),pan-TRK(+),CK5/6(-),P63(-),NR4A3(-),CD117(-),Ki-67(增殖指数约为10%)。
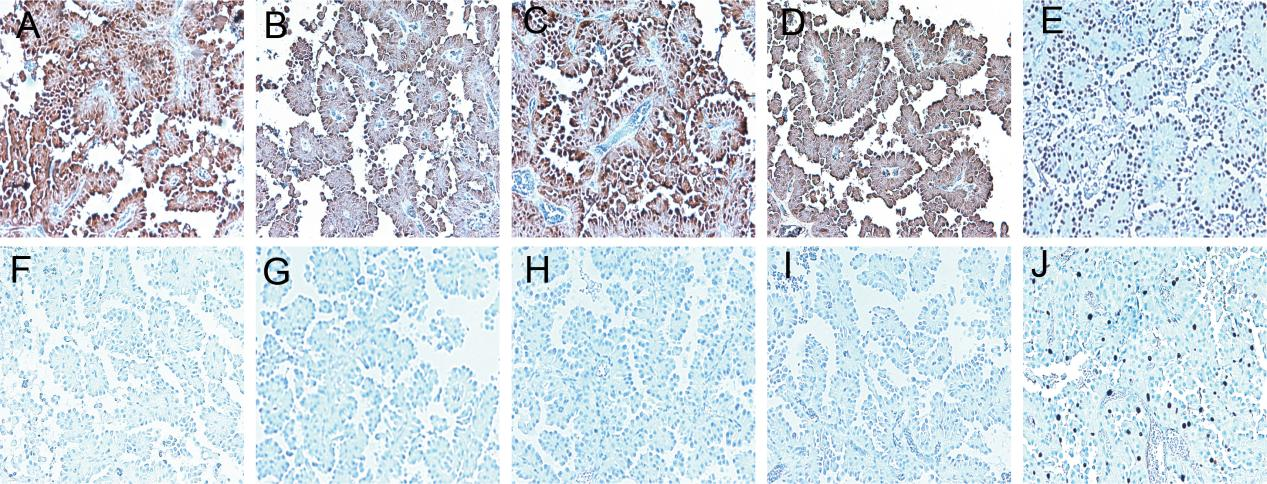
图5.免疫组化。(A)CK7;(B)S-100;(C)Mammaglobin;(D)Vimentin;(E)pan-TRK;(F)CK5/6;(G)P63;(H)NR4A3;(I)CD117;(J)Ki-67
分子遗传学结果
FISH检测结果显示,ETV6::NTRK3基因融合阳性。
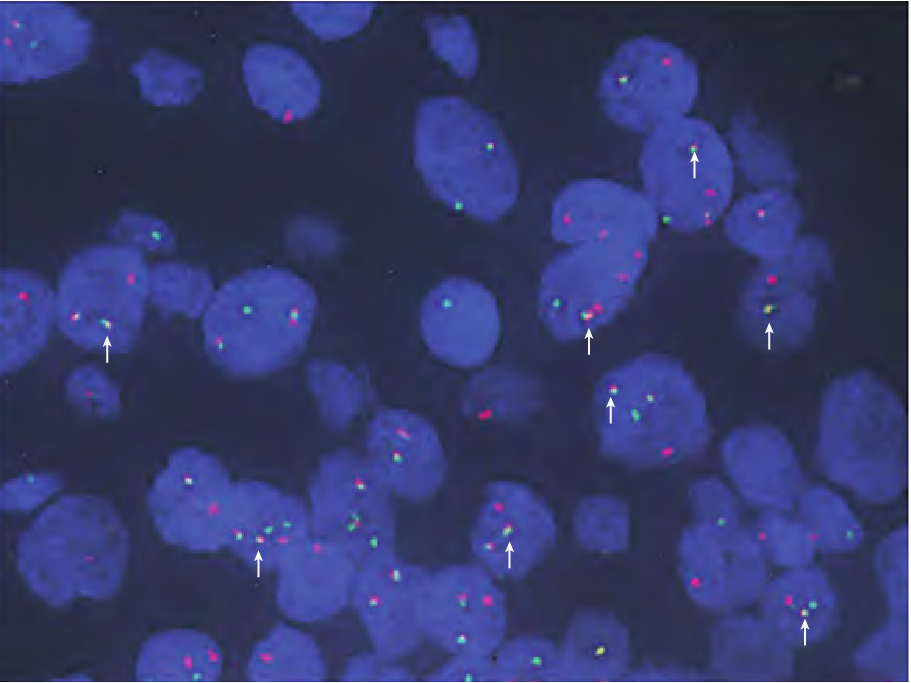
图6.FISH检测结果。绿色信号为ETV6,红色信号为NTRK3,黄色信号(箭头所示)为融合信号。融合信号占比为55%,提示ETV6::NTRK3基因融合阳性。
最终诊断
(左侧腮腺)涎腺分泌性癌(SCSG)。
随访
患者随诊32个月,未见复发。
临床概述及流行病学特点
涎腺分泌性癌(secretory carcinoma of salivary gland,SCSG)是近些年来新发现的头颈部涎腺恶性肿瘤,于2010年由Skálová首次发现提出,此类涎腺肿瘤主要发生于腮腺和下颌下腺,其次为软腭、颊粘膜、舌和唇等部位。常见于成人,发病年龄13-77岁,平均45岁,男性稍多。临床表现主要为生长缓慢的无痛性肿物。
超声-影像学改变
超声多表现为一侧腮腺内低回声囊实性肿物,边界多欠清晰,形态常不规则,其内回声不均,部分可见乳头状凸起,CDFI可见血流信号。部分病例在腮腺内可见边界清晰、形态规则的囊性肿物,囊壁厚薄不均,内见不规则乳头状实性突起,易误诊为腮腺良性病变。
影像学表现为:CT呈类圆形、边界清晰的稍低密度灶,也可表现为多房性肿块,伴高级别转化时呈巨大不均质肿块影,增强扫描病变内部呈均匀或不均匀强化,壁可局部增厚并呈轻度强化。MRI表现为伴有乳头状突起的囊实性肿块影,囊变区T1WI高信号对诊断SCSG有提示作用,可出现液平面,实性部分T1WI呈等信号,T2WI为低-高信号。SCSG常伴有含铁血黄素沉积的出血,T2WI特征性表现为低信号,增强扫描附壁软组织结节可明显强化或无明显强化。
组织学特点
SCSG巨检主要表现为实性或囊实性结节状肿块;低倍镜下,肿瘤多与周围组织界限清楚,无包膜,可侵犯周围涎腺组织,肿瘤典型表现为3种生长模式:(1)乳头/微囊状结构,肿瘤通常由微囊状和轻度扩张的管状腺腔组成,腺腔内充满均质分泌物,消化过碘酸雪夫(PAS)染色呈阳性,边界较清楚,外周有局灶或完整的纤维包膜;(2)实性/小叶状生长,肿瘤细胞巢被增生的纤维组织分隔成分叶状或结节状,常有明显的周边浸润;(3)大囊/滤泡样结构,肿瘤以单层囊肿为主,内衬上皮可呈靴钉样排列,囊肿内含丰富嗜酸性分泌物。大多数肿瘤可同时表现2种或2种以上的生长模式。SCSG细胞核为圆形或椭圆形泡状核,中央可见核仁,大都表现为无或轻度异性,核分裂像少见。部分SCSG可伴有高级别转化,高级别SCSG的特征是间变性细胞以实性和小梁的形式分布并伴有周围神经侵犯或远处转移。
免疫组化特点
免疫组化标记方面,SCSG肿瘤细胞表达CK7、CK8、CK19、Vimentin、乳腺球蛋白和S-100蛋白,而p63、calponin和CD117常为阴性,S-100和乳腺球蛋白是诊断SSC比较重要的阳性指标。pan-TRK在SCSG中敏感度约85%;pan-TRK作为一个有诊断价值的免疫组化标记,还需更多的大规模实验数据来进一步证实其在涎腺肿瘤中的作用。
分子遗传学特点
SCSG具有特征性的染色体异位t(12;15)(p13;q25),从而形成ETV6-NTRK3融合基因,是目前诊断SSC的金标准,除了在乳腺的分泌性癌中存在,ETV6-NTRK3融合基因在婴儿纤维肉瘤中、先天性间质型肾母细胞瘤里也呈阳性表达。新近文献发现个别SCSG可有ETV6-NTRK3基因融合以外的基因融合,如ETV6-RET、ETV6-MET等。
鉴别诊断
(1)腺泡细胞癌
腺泡细胞癌与分泌性癌两者在组织学结构相似,均有实性、囊状、乳头—囊状、滤泡型及微囊型等,故鉴别困难;但二者在细胞学及免疫表型表现不同:细胞学方面,前者胞质内可见嗜碱性酶原颗粒,而后者胞质为细颗粒状、嗜酸性;免疫表型方面,前者Dog-1及NR4A3阳性、S-100及乳腺球蛋白阴性,分泌性癌为Dog-1阴性、S-100及乳腺球蛋白阳性;第三在分子方面,腺泡细胞癌无ETV6-NTRK3的基因重排。
(2)黏液表皮样癌
部分分泌性癌肿瘤细胞可含片状透明胞质,且周围可有黏液聚集,形态学上需与黏液表皮样癌鉴别。黏液表皮样癌包含表皮样细胞、中间型细胞及黏液细胞3类细胞,常见透明细胞及黏液池,可见细胞间桥且黏液细胞为明显含透明黏液的杯状细胞。免疫表型方面,黏液表皮样癌表达p63、不表达S-100,而分泌性癌弥漫表达S-100、基本不表达p63;在分子学方面,黏液表皮样癌(50%)存在CRTC1-MAML2或CRTC3-MAML2基因融合,而无分泌性癌 ETV6-NTRK3的基因融合。
(3)多形性低度恶性腺癌
主要发生于小涎腺,腮腺等大涎腺少见,而SCSG多数发生于腮腺等大涎腺; 形态学上,多形性低度恶性腺癌多以小叶状、乳头状、筛状或腺管样结构为主,而微囊性结构少见。常表达S-100蛋白,不表达 Mammaglobin。
(4)低度恶性涎腺导管内癌(LGCCC)
形态学上与乳腺低级别导管原位癌类似,由单个或多个囊及邻近的导管内上皮增生构成,囊内衬覆增生的导管上皮细胞,呈筛状、乳头状或实性,腔面细胞胞质内常含有黄色的脂褐素。LGCCC与SCSG均可共表达S-100蛋白和Mammaglobin,鉴别要点在于LGCCC肿瘤细胞巢周围围绕一层肌上皮细胞,p63、p40、Calponin等标记阳性。
治疗及预后
SCSG属于低度恶性肿瘤,因此大多数普通型SCSG仅需要手术彻底切除,对伴淋巴结转移或高级别转化的SSC可能需要手术彻底切除及颈淋巴结清扫,高Ki-67指数可能是分泌性癌预后不良的独立危险因素,需密切随访。ETV6-NTRK3基因融合可作为SCSG的治疗靶点,在常见的恶性肿瘤(如肺癌、乳腺癌)中的融合频率较低,SCSG的ETV6-NTRK3融合频率>90%,临床针对NTRK融合突变的药物如恩曲替尼等治疗效果明显,有较高的无进展生存期,故可通过抑制NTRK3基因重排,在未来临床治疗中发挥较多作用。
参考文献
1. WANG TY,YANG XX,YAO LH,et al.Clinicopathological analysis of 18 cases of secretory carcinoma of the salivary glands[J].J Dent Sci,2024,19(1) : 109-117.
2. LENG XC,SUN XL,LIN YS,et al.Secretory carcinoma in the parotid gland presenting as a cystic lesion and harboring ETV6-NTRK3 gene rearrangement[J]. Oral Oncol,2024,152( 0) : 106804.
3. BIN X,MOHAMED RHAR,CRISTINA RA,et al,Pan -Trk immunohistochemistry is a sensitive and specific ancillary tool for diagnosing secretory carcinoma of the salivary gland and detecting ETV6-NTRK3 fusion[J].Histopathology,2020,76( 3) : 375.
4. Alena S, Martina B, R D L T, et al. Expanding the Molecular Spectrum of secretory Carcinoma of Salivary Glands With a Novel VIM-RET Fusion[J]. The American journal of surgical pathology,2020,44(10):1295-1307.
5. Borges D L A, Cristina A M D, Alves T F, et al. A systematic review of secretory carcinoma of the salivary gland:where are we?[J]. Oral Surgery,Oral Medicine Oral Pathology and Oral Radiology,2020,132(4):e143-e152.
6. Na K,Hernandez-Prera JC,Lim JY,et al.Characterization of novel genetic alterations in salivary gland secretory carcinoma[J].Mod Pathol,2020,33(4):541-550.



















共0条评论