[导读] 编译整理:强子
微浸润性癌
查见高级别导管原位癌,就应注意马上寻找微浸润,因为这是可能漏诊的典型例子-可能会漏掉浸润灶。导管原位癌周围存在伴显著炎症细胞(主要为淋巴细胞)浸润的纤维化、导管轮廓不规则,一般是提示微浸润的特征。癌细胞一般呈单个细胞、小巢状浸润,因此可能的确难以识别出来。周围的炎症细胞浸润以及内皮细胞,也会遮盖、或类似肿瘤细胞。这种情况下,病理医师应仔细观察导管原位癌周围的病灶,并确定出导管轮廓不规则的区域,且基底膜也是不连续的。这种情况下免疫组化极有帮助,广谱CK和肌上皮标记即可做出鉴别,如果可能的话也可以做双重染色。
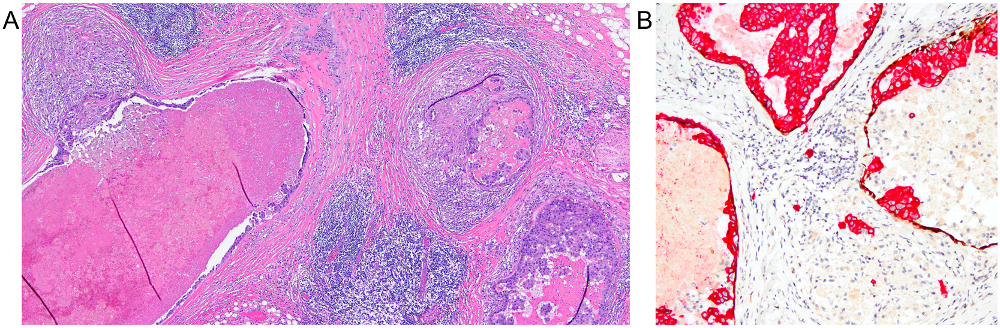 图5.高级别导管原位癌,周围有纤维化、广泛炎症细胞浸润、且导管轮廓不规则;这些特征都高度可疑存在微浸润。联合免疫组化检测(红色为上皮,棕色为肌上皮)显示杂乱的背景中有浸润性癌细胞的存在。
图5.高级别导管原位癌,周围有纤维化、广泛炎症细胞浸润、且导管轮廓不规则;这些特征都高度可疑存在微浸润。联合免疫组化检测(红色为上皮,棕色为肌上皮)显示杂乱的背景中有浸润性癌细胞的存在。
相似的情况下,小叶原位癌周围也可有微浸润性小叶癌,一般见于多形性小叶原位癌。这种情况下免疫组化双染(即CK和肌上皮标记)有助于鉴别。与原位癌不相连的微浸润性小叶癌非常罕见,加之浸润性小叶癌一般不会导致间质改变,因此是个非常困难的诊断问题。此外,微浸润性小叶癌中的小而无黏附性癌细胞也可能很容易被误判为淋巴细胞。本文原作者提醒,病理医师一定要对此有警惕性,尤其是患者有小叶肿瘤病史的情况下,必要时加做免疫组化。
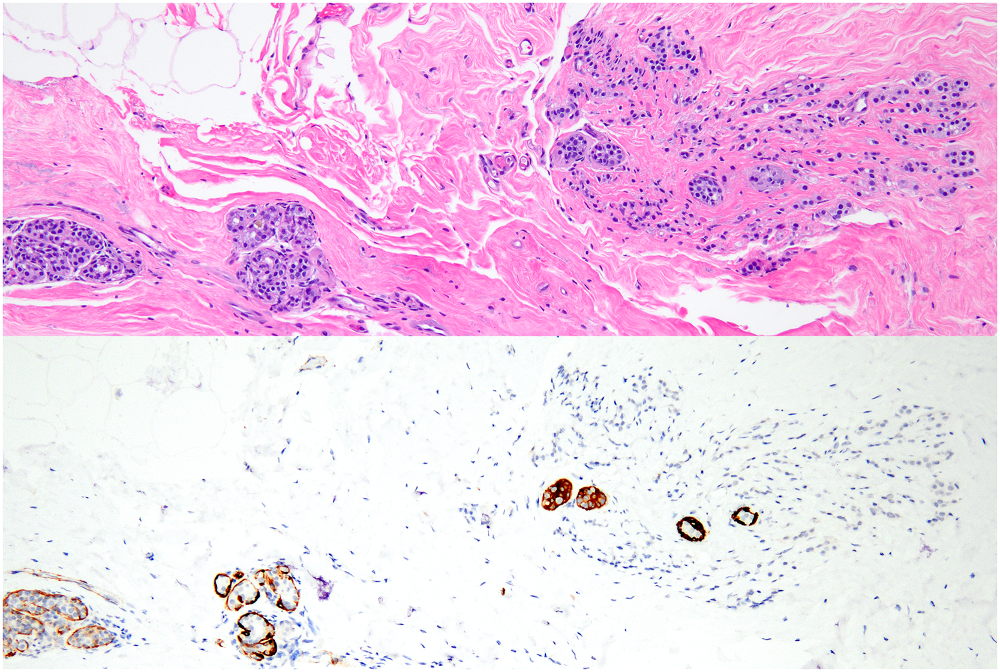 图6.(A)不那么显著的微浸润性小叶癌(图中右侧),无间质反应;但图中可见非典型小叶增生(左下角);(B)免疫组化myosin证实的确存在微浸润。
图6.(A)不那么显著的微浸润性小叶癌(图中右侧),无间质反应;但图中可见非典型小叶增生(左下角);(B)免疫组化myosin证实的确存在微浸润。
伴硬化的浸润性导管癌
浸润性导管癌一般会有促纤维结缔组织增生反应,具体为黏液样基质中有纤维母细胞增生。不过,偶有间质致密纤维化、硬化的情况,会导致与放射状瘢痕的核心区鉴别困难,尤其粗针穿刺活检标本中。高分化浸润性导管癌一般会呈星型表现,这一点和放射状瘢痕相似;但浸润性癌并无分带状结构,且腺体遍布病灶内、不规则分布。放射状瘢痕的周边一般会有增生性改变、边缘呈推挤性;而腺体广泛侵入肿物周围、并显著侵犯周围组织,则考虑为浸润性导管癌。此外,这种情况下查见导管原位癌也有助于明确诊断。肌上皮免疫组化标记可用于这种情况下的诊断,但建议检测多项指标,因为放射状瘢痕中肌上皮细胞可能会变得不那么明显。
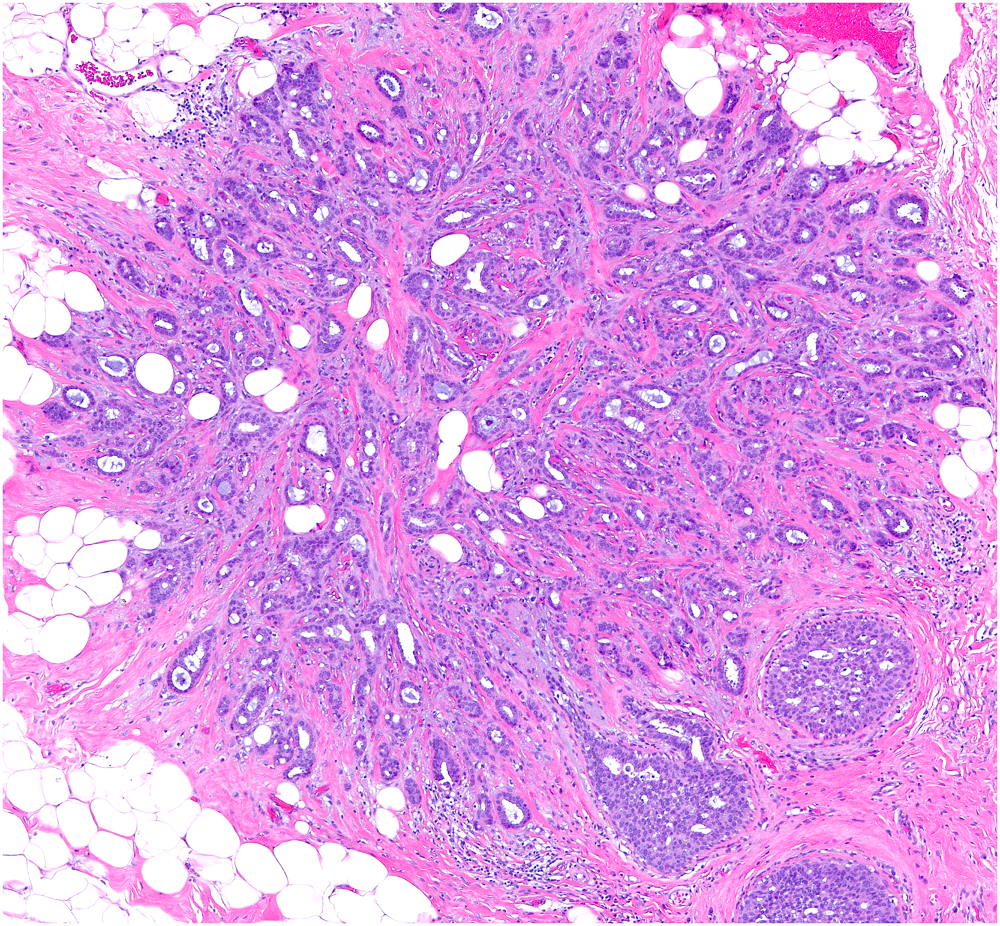 图7.高分化浸润性导管癌,低倍镜下表现类似放射状瘢痕,但图中右下角有导管原位癌。
图7.高分化浸润性导管癌,低倍镜下表现类似放射状瘢痕,但图中右下角有导管原位癌。
罕见情况下,硬化性表现可能非常广泛、以至于粗针穿刺标本中难以识别出浸润性腺体。这种情况下,遇到杂乱分布、形状不规则的小管,则病理医师就要尽量加做肌上皮标记免疫组化。
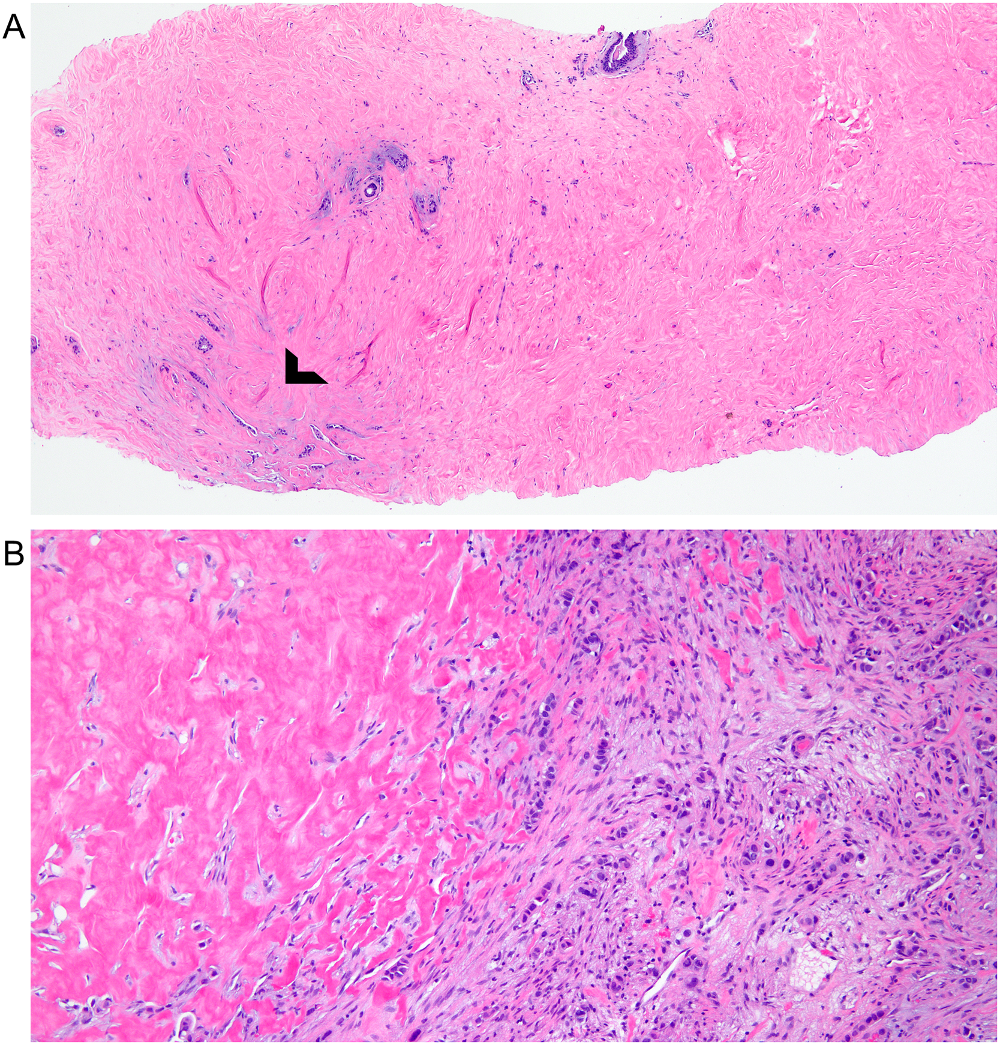 图8.(A)广泛硬化的表现,影响了对形状不规则浸润性腺体(箭头所示)的观察。(B)另一病例,在硬化性边缘查见癌细胞,因此相对容易诊断。
图8.(A)广泛硬化的表现,影响了对形状不规则浸润性腺体(箭头所示)的观察。(B)另一病例,在硬化性边缘查见癌细胞,因此相对容易诊断。
新辅助治疗后的残余浸润性癌
新辅助化疗情况下,残余浸润性癌的评估可能会有很大难度。化疗后的肿瘤细胞一般会有诸多形态学改变,比如体积增大、胞质丰富且多呈空泡状,细胞核大、深染、多形性。罕见情况下,治疗后的癌细胞会变得更小一些。背景也常见相应改变,如纤维化、水肿、血管增生、慢性炎症细胞浸润。残余的浸润性癌如果表现为单细胞或小巢状、背景为“杂乱”表现,且有时候炎症细胞可类似浸润性癌,则这种情况下诊断难度很大;当然,反之亦然。此时建议必须做CK免疫组化,因为病理医师会惊奇的发现在HE染色切片中被忽略的浸润灶。
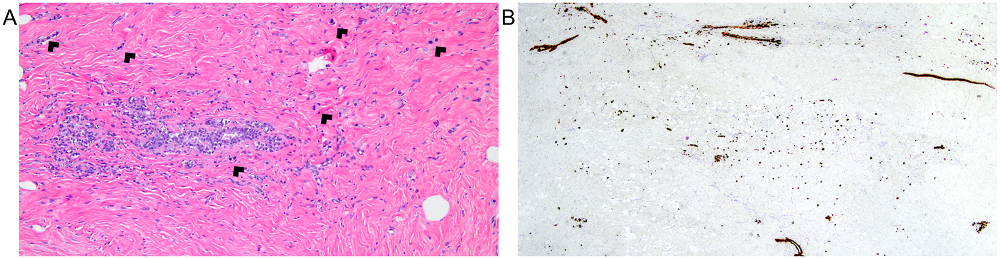 图9.(A)本例为新辅助治疗后的标本,散在有非典型细胞,细胞核大、深染,可疑残余浸润性癌;(B)同一区域的CK免疫组化,可见比HE切片中更多的癌细胞。
图9.(A)本例为新辅助治疗后的标本,散在有非典型细胞,细胞核大、深染,可疑残余浸润性癌;(B)同一区域的CK免疫组化,可见比HE切片中更多的癌细胞。
罕见类型的浸润性癌
某些罕见类型的浸润性癌因为形态学与其他病种存在重叠,因此可能会有漏诊或诊断不足的问题。这方面来说首先要注意两种亚型的浸润性小叶癌:组织细胞型,腺泡型。
组织细胞型浸润性小叶癌的瘤细胞为低至中等级别细胞核,胞质丰富、泡沫状,类似组织细胞。这些浸润性癌细胞可能会误判为炎症细胞;不过,一般并不伴有慢性炎症细胞。腺泡型浸润性小叶癌则为簇状浸润,此时可能会误判为小叶原位癌。这两种情况下一般都会有经典型小叶原位癌,可以帮助做出鉴别。疑难病例中,CK免疫组化可证实组织细胞亚型浸润性小叶癌中瘤细胞为上皮性质,肌上皮标记可证实腺泡型浸润性小叶癌中的浸润灶。
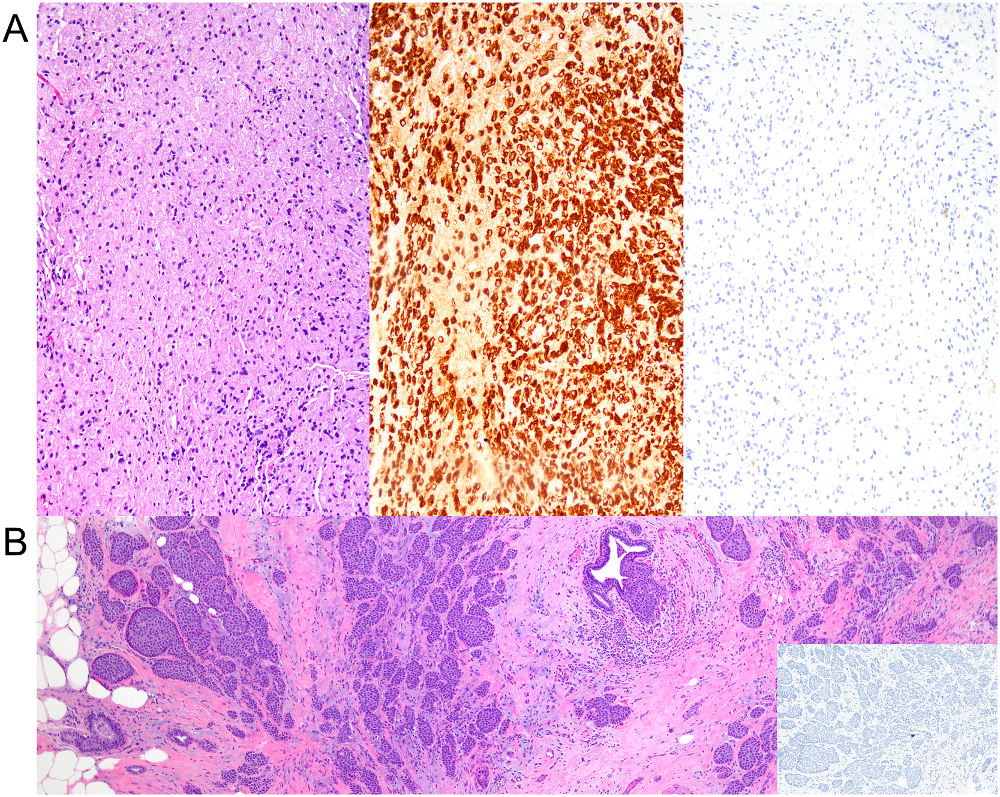 图10.(A)组织细胞型浸润性小叶癌,瘤细胞呈片状分布,胞质丰富、泡沫样;免疫组化CK证实细胞为上皮性,而E-cadherin阴性,支持小叶分化;(B)腺泡型浸润性小叶癌,为圆形巢状,可能会误判为小叶原位癌;不过这些细胞巢的分布也和正常乳腺结构不同;免疫组化myosin检测,证实这些细胞巢为浸润性。
图10.(A)组织细胞型浸润性小叶癌,瘤细胞呈片状分布,胞质丰富、泡沫样;免疫组化CK证实细胞为上皮性,而E-cadherin阴性,支持小叶分化;(B)腺泡型浸润性小叶癌,为圆形巢状,可能会误判为小叶原位癌;不过这些细胞巢的分布也和正常乳腺结构不同;免疫组化myosin检测,证实这些细胞巢为浸润性。
与腺泡状浸润性小叶癌相识,浸润性导管癌罕见情况下也可出现推进性浸润,具体例子之一如浸润性筛状癌。这些情况一般常伴更为经典的浸润性方式;不过如果粗针穿刺活检标本中仅有这类浸润的时候,推进性浸润可能会被低诊断为导管原位癌。这样的病例中,簇状浸润性癌细胞的分布和导管原位癌累及的导管/小叶不同,且“背靠背”的表现也提醒病理医师应注意浸润性可能。免疫组化有助于鉴别诊断,但也要注意:伴广泛导管原位癌的导管中,肌上皮细胞可能不那么明显,因此建议用多项肌上皮指标进行免疫组化检测。
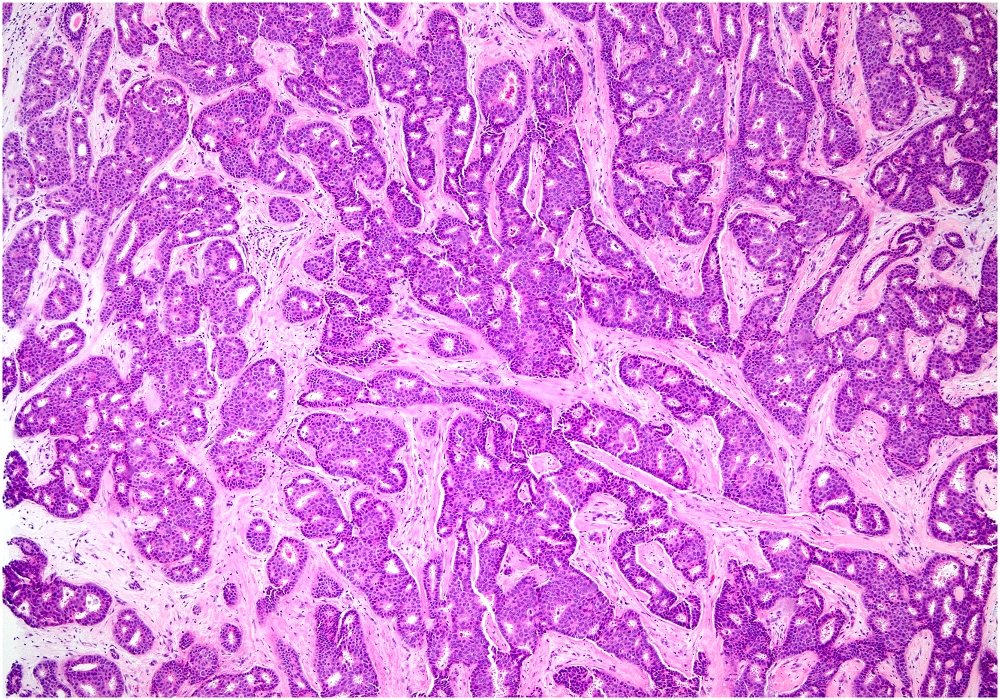 图11.浸润性筛状癌,可能会低诊断为导管原位癌;不过,浸润性癌巢的分布方式与导管原位癌的分布不同。
图11.浸润性筛状癌,可能会低诊断为导管原位癌;不过,浸润性癌巢的分布方式与导管原位癌的分布不同。
低级别腺鳞癌为化生性癌,也容易低诊断。发生于放射状瘢痕/复杂型硬化性病变、或者粗针穿刺活检标本中的低级别腺鳞癌可能极难诊断,因为很难准确的区分出癌和硬化性病变:低级别腺鳞癌中的腺体成分可能类似放射状瘢痕中的腺体;硬化性病变中也常见鳞状化生。免疫组化虽然可以作为确诊线索,但结果“总是没有一致性”,甚至可能会使得病理医师更为困惑。
遇到伴不规则结节和鳞状化生的硬化性病变时,病理医师需要仔细评估;此时要注意可能伴有低级别腺鳞癌。对于切除标本来说,病理医师应尽量确定出浸润性生长方式、并寻找伴随的淋巴细胞簇,这些都有助于明确诊断。
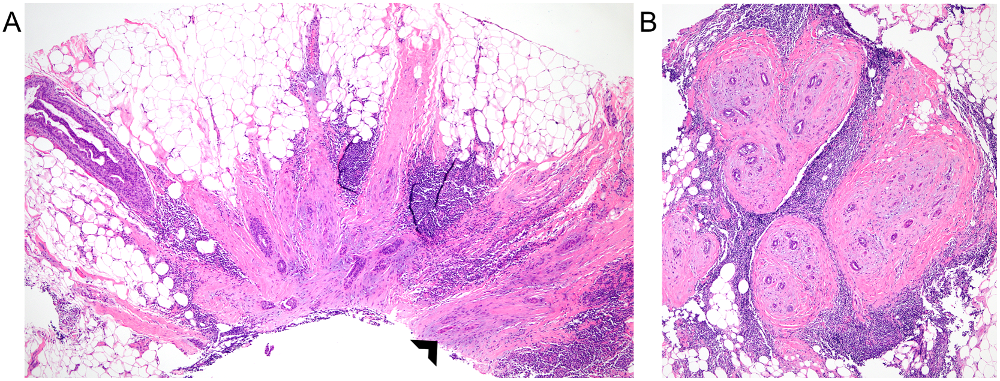 图12.(A)粗针穿刺标本中,查见伴鳞状化生(箭头所示)及淋巴细胞簇的放射状瘢痕,让人不得不考虑低级别腺鳞癌可能;(B)切除标本中,证实为腺鳞癌。
图12.(A)粗针穿刺标本中,查见伴鳞状化生(箭头所示)及淋巴细胞簇的放射状瘢痕,让人不得不考虑低级别腺鳞癌可能;(B)切除标本中,证实为腺鳞癌。
——全文完——
往期回顾:
翻来覆去学病理-乳腺癌诊断中的漏诊/诊断不足问题(一)





















共0条评论