[导读] 作者:病理小言
病史
会诊病例。男,49岁,发现右耳下肿物8月,约“花生”大小。
CT检查:左侧腮腺结节,约1.3cm*1.2cm,考虑腮腺混合瘤可能。
大体检查
大体检查:灰红色组织一块,大小2.7×1.7×1.2cm,切面见一枚结节,1.4×1.2cm,边界清楚,灰红灰黄色。
组织学检查
肿瘤边界清楚,局灶呈舌状推挤性浸润至正常腮腺实质内。整个肿瘤呈嗜酸性,与含有嗜碱性酶原颗粒的正常腮腺腺泡形成鲜明对比。肿瘤以乳头状囊性结构模式为主,也有少量微囊结构和近似实性的密集结构。囊性结构和微囊内含有明显的嗜酸性分泌物。细胞学形态温和,中到大的圆形至卵圆形或鞋钉状闰管型导管细胞,含有丰富的粉红色颗粒状细胞质、形态一致的圆形至卵圆形核,有一到两个明显核仁。少数表面细胞的胞质质含有大空泡和大量泡沫状小空泡,表层形成透明细胞形态。未见腺泡细胞癌特征性的嗜碱性酶原颗粒。未见核分裂象和坏死。
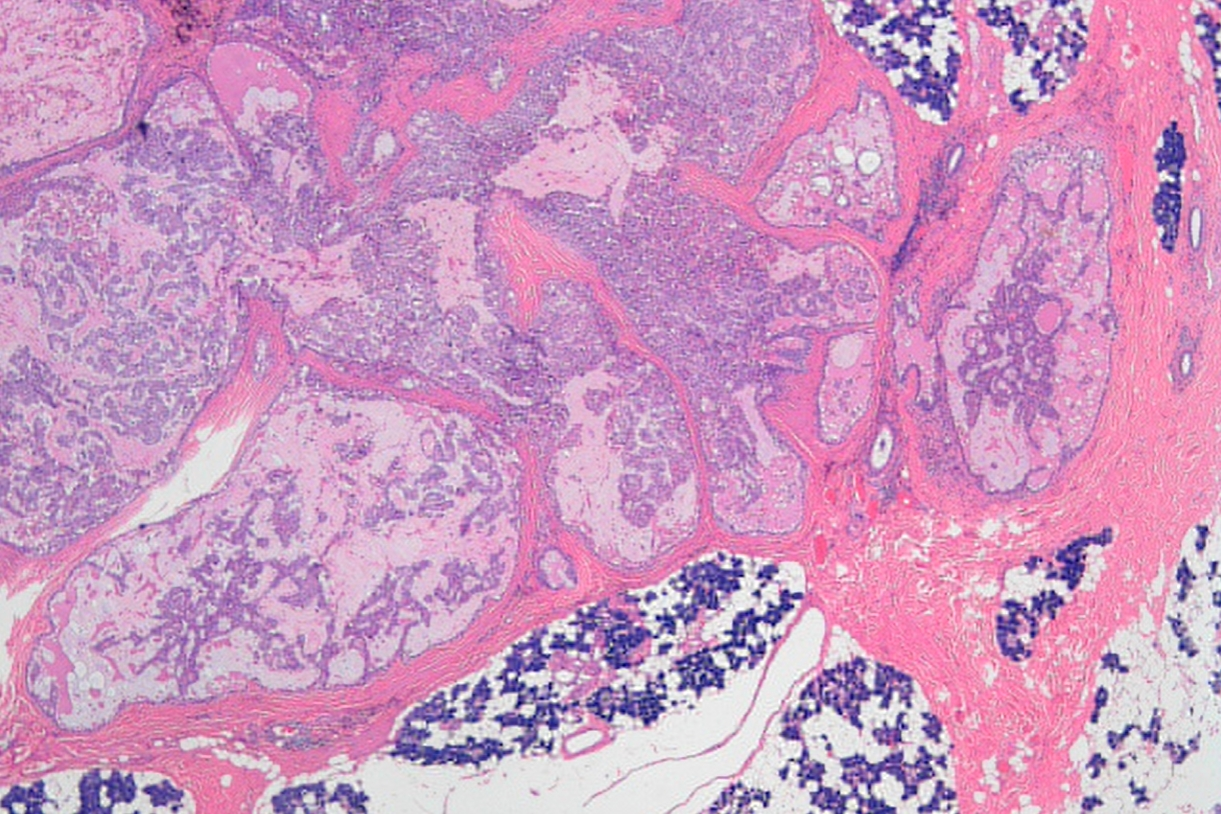
图1 低倍观察,肿瘤边界清楚,图右侧肿瘤呈推挤性浸润至正常腮腺实质内。肿瘤呈嗜酸性,与含有嗜碱性酶原颗粒的正常腮腺腺泡(图下方和右上方)形成鲜明对比。肿瘤以乳头状囊性结构模式为主,并有少量微囊结构模式(40倍放大)。
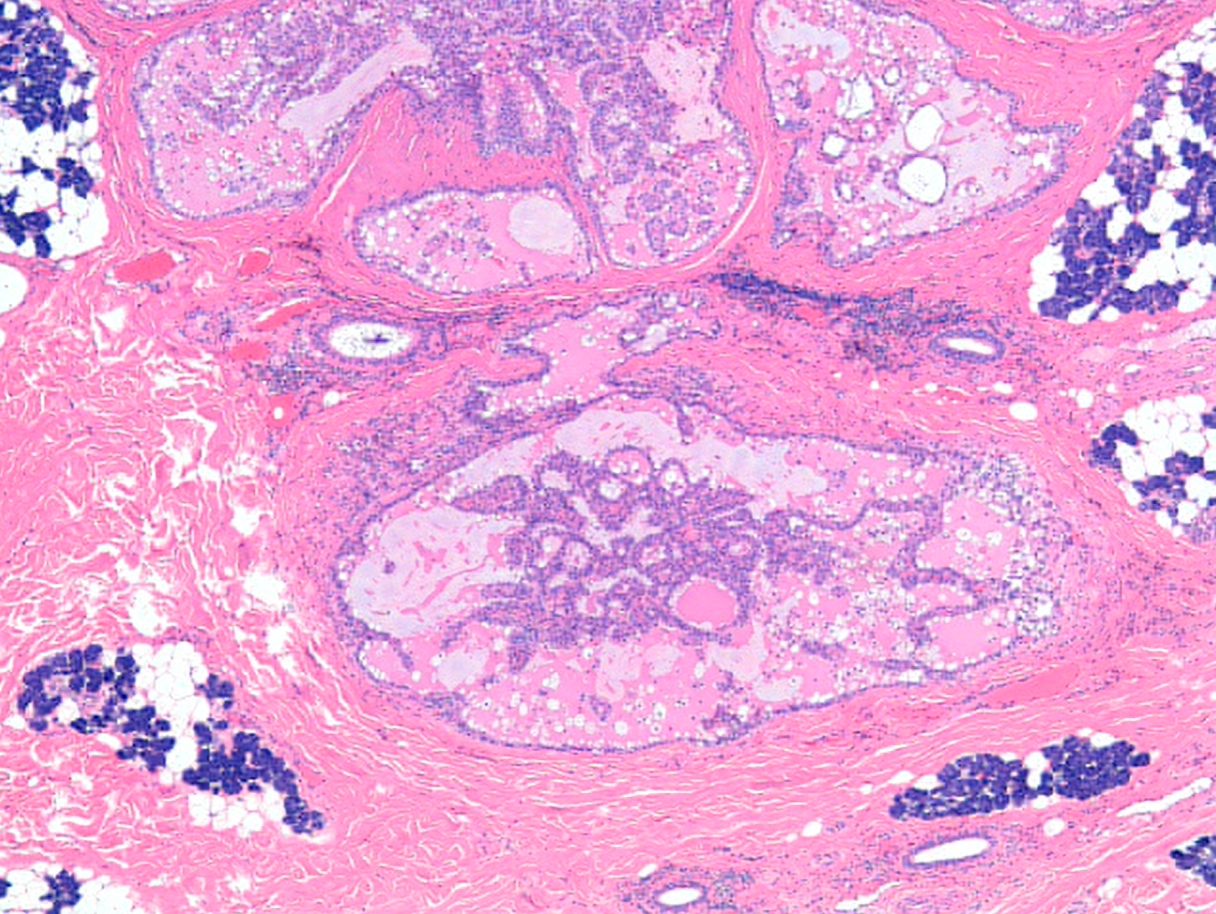
图2 上图浸润部分的局部放大,顺时针旋转90度。肿瘤呈嗜酸性,与含有嗜碱性酶原颗粒的正常腮腺腺泡形成鲜明对比。这部分肿瘤显示乳头状囊性结构模式,囊内含有明显的嗜酸性分泌物(100倍放大)。
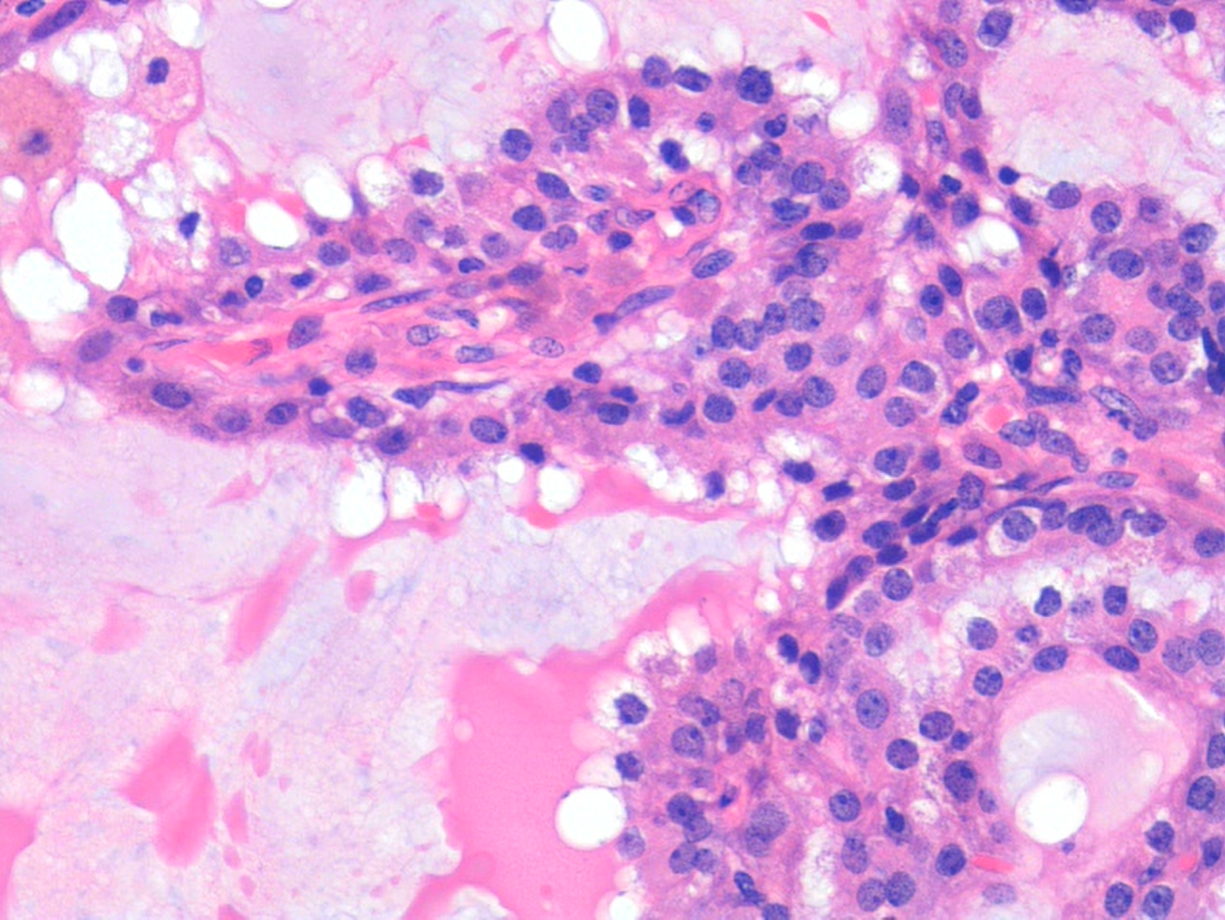
图3 高倍观察细胞学特征:中到大的圆形至卵圆形或鞋钉状闰管型导管细胞,含有丰富的粉红色颗粒状细胞质、形态一致的圆形至卵圆形核,有一到两个明显核仁。细胞质可能有大空泡和大量泡沫状小空泡,表层形成透明细胞形态。未见腺泡细胞癌特征性的嗜碱性酶原颗粒。细胞学温和,未见核分裂象和坏死(400倍放大)。
免疫组化
原单位免疫组化:肿瘤细胞呈EMA(+),S100(+),SOX10(弱+,内对照强+),p63(-),calponin(-),CK5/6(-),CD117(-),DOG1(-),CD34(血管+),p53(野生型),Ki67(+,5%)。我单位免疫组化显示:肿瘤细胞呈mammaglobin(+,10%),GATA3(弱+),GCDFP15(-),MUC4(+),CK广(+),CK5/6(-),P63(-),calponin(-),DOG1(-),CD117(-),P53(+,野生型),Ki67(+,5%),P16(斑驳+),BRAF(-),EGFR(弱+),ALK(-)。特殊染色显示:分泌物呈粘液卡红(+),PAS(+),PAS-D(+),癌细胞呈粘液卡红(+),PAS(-),PAS-D(-)。
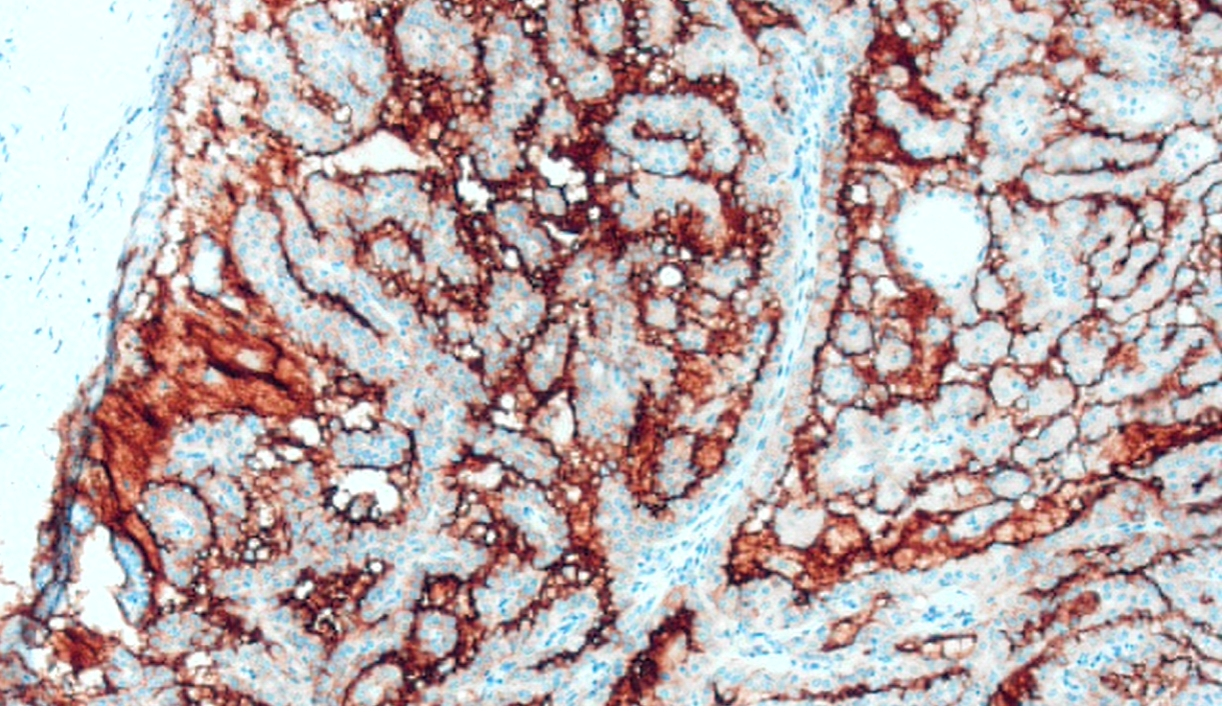
图4 涎腺分泌性癌,免疫组化MUC4阳性(100倍放大)。
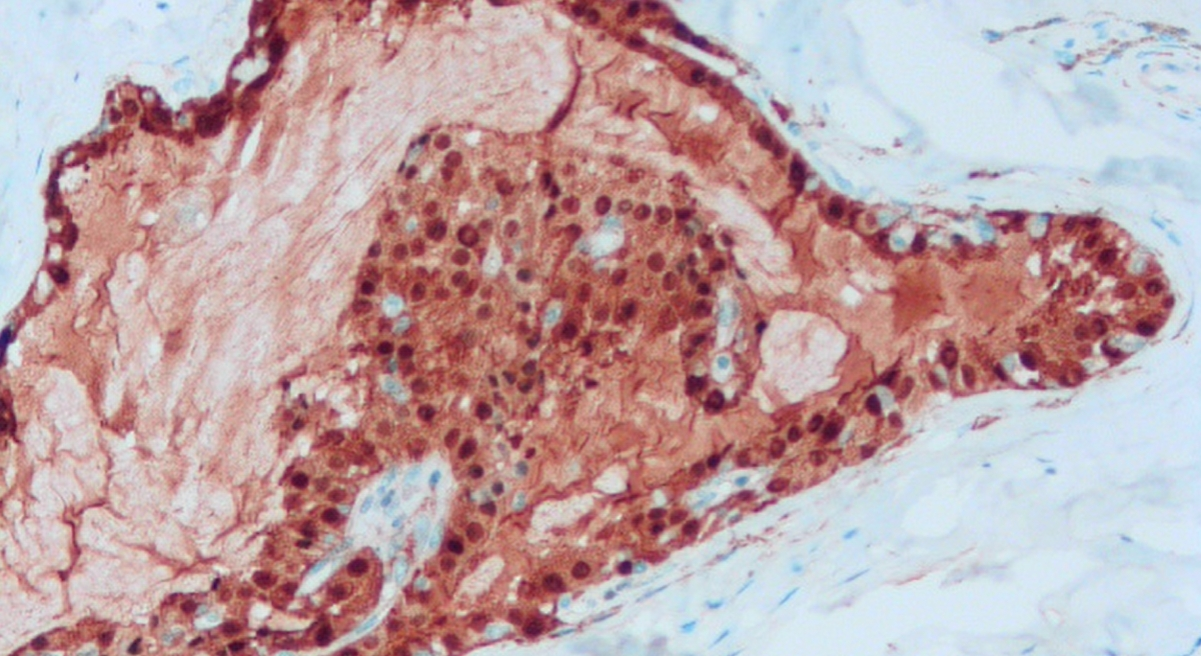
图5 涎腺分泌性癌,免疫组化S100阳性(100倍放大)。
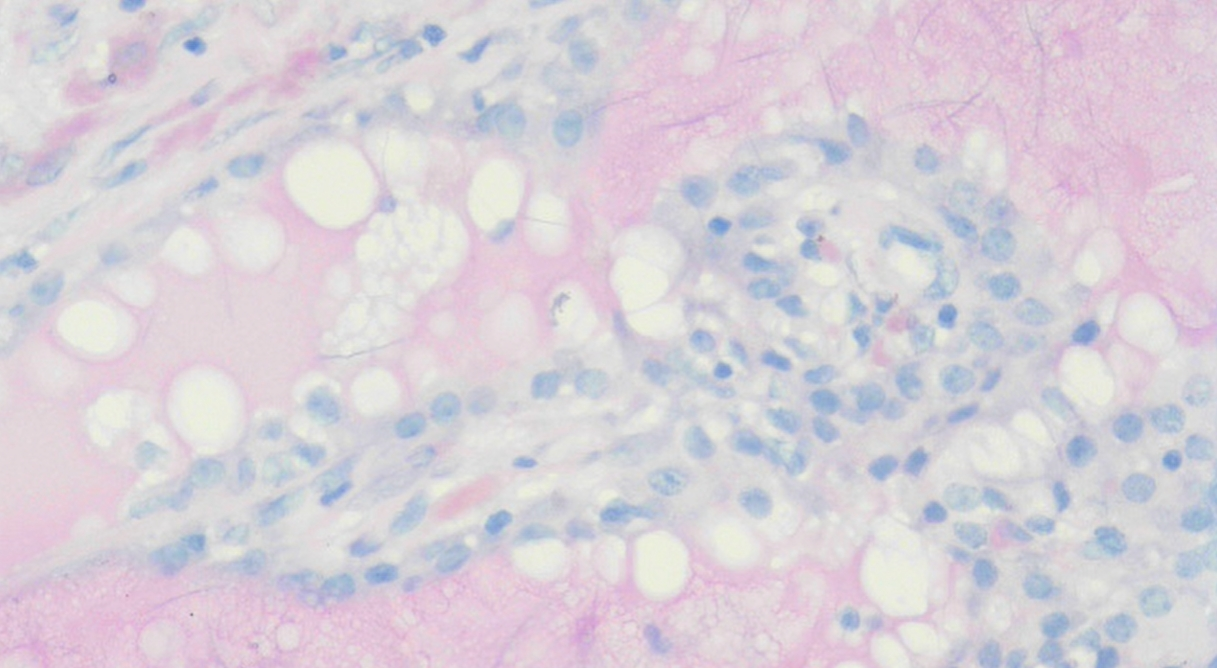
图6 涎腺分泌性癌,PAS特殊染色。囊内分泌物和微囊内分泌物呈PAS阳性(200倍放大)。另外,与腺泡细胞癌鉴别时,主要看细胞:腺泡细胞癌细胞PAS阳性,分泌性癌细胞PAS阴性。
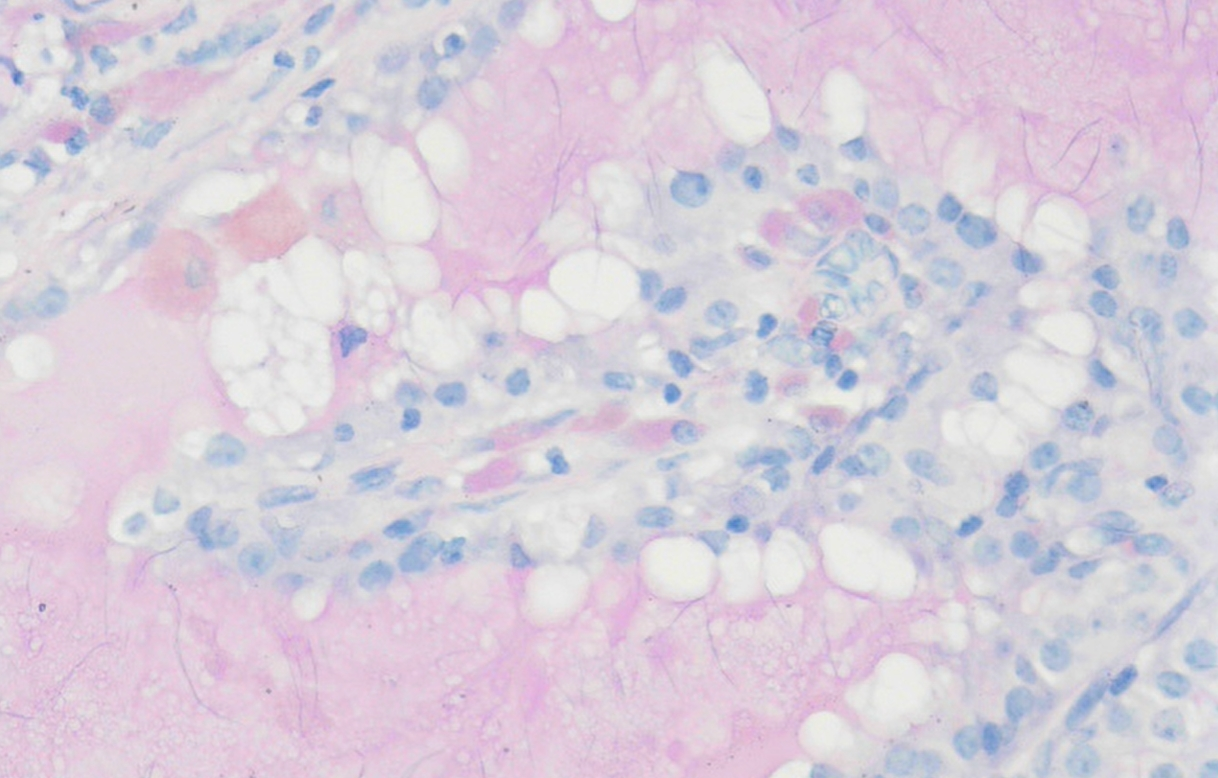
图7 涎腺分泌性癌,PAS-D特殊染色。囊内分泌物和微囊内分泌物呈PAS-D阳性(200倍放大)。另外,与腺泡细胞癌鉴别时,主要看细胞:腺泡细胞癌细胞PAS-D阳性,分泌性癌细胞PAS-D阴性。
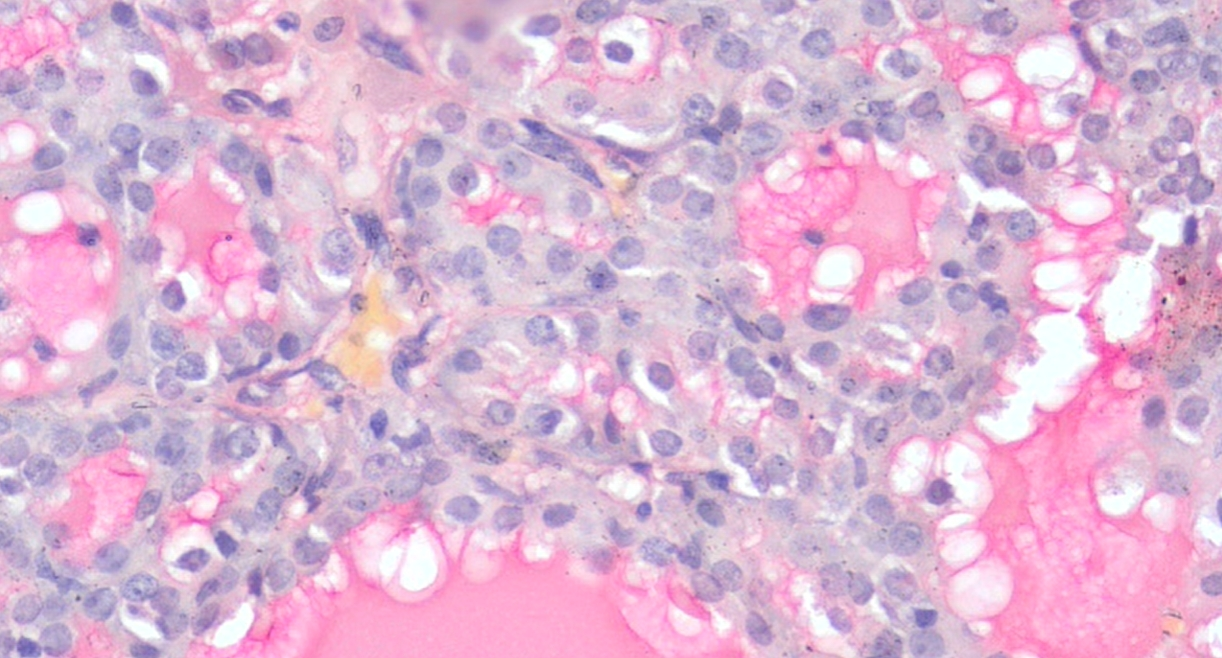
图8 涎腺分泌性癌,黏液卡红特殊染色。囊内分泌物、微囊内分泌物和部分透明细胞的胞质呈黏液卡红阳性(400倍放大)。另外,与腺泡细胞癌鉴别时,主要看细胞:腺泡细胞癌细胞黏液卡红阴性或罕见阳性,分泌性癌细胞黏液卡红阴性。
病理诊断
左侧腮腺:形态学和免疫组化符合分泌性癌(参见备注)。
备注:腮腺肿物切片显示分化良好的腺体肿瘤,多结节状,边界较清楚,局部呈推挤性浸润性生长,伴分泌现象。免疫组化(如上文),结果支持上述诊断。建议FISH检测ETV6重排进一步明确诊断。
FISH检测
检测结果:FISH检测到ETV6基因断裂重排(阳性)。
检测所见:分析200个间期细胞,各信号模式分别如下:1G1R1F59.5%,1G1R15.0%,1R1F 12.0%,1G1F 7.5%,2F 6.0%。
探针:LBP ETV6基因断裂探针:绿色信号(G)为GSPETV6(Centromere),红色信号(R)为GSP ETV6(Telomere)
判读标准:(1)本探针为断裂重排探针,红色荧光标记5'ETV6(12p13)探针,绿色荧光标记3'ETV6探针,正常信号模式为2F,典型阳性信号模式为1G1R1F(注:G为绿色信号,R为红色信号,F为黄色信号或绿色与红色叠加信号)。(2)由病理医生对组织HE玻片进行形态学评估,确定肿瘤及杂交区域。应用LBP-ETV6基因断裂探针进行荧光原位杂交,分析至少两个视野的200个分裂间期的肿瘤细胞。(3)ETV6基因断裂可应用于婴儿纤维肉瘤(IF)、先天性中胚层肾瘤、涎腺乳腺样分泌性癌的鉴别和辅助诊断。
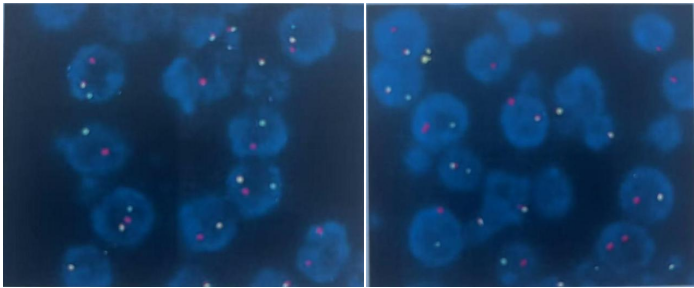
图9 FISH检测到ETV6基因断裂重排(600倍放大)。
最终诊断(整合报告)
左侧腮腺肿物(切除):综合形态学、免疫组化和FISH检测结果,符合涎腺分泌性癌。
注:涎腺分泌性癌(secretory carcinoma of salivary gland),又称涎腺的乳腺样分泌性癌(mammary analogue secretory carcinoma),是一种由闰管型导管细胞组成的涎腺腺癌,其形态学、免疫表型和遗传学类似于乳腺分泌性癌。涎腺分泌性癌由Skálová等人于2010年首次报道,于2017年首次纳入头颈部肿瘤WHO分类(第四版)。
未完待续,下期内容:涎腺分泌性癌详解
上期内容:涎腺分泌性癌:类似乳腺分泌性癌的新认识肿瘤
涎腺分泌性癌详解
涎腺分泌性癌(secretory carcinoma of salivary gland),又称乳腺样分泌性癌(mammary analogue secretory carcinoma),是一种由闰管型导管细胞组成的涎腺腺癌,其形态学、免疫表型和遗传学类似于乳腺分泌性癌。涎腺分泌性癌由Skálová等人于2010年首次报道,于2017年首次纳入头颈部肿瘤WHO分类(第四版)。
闰管组织学及其相关肿瘤
涎腺正常结构与肿瘤组织学类型之间存在相关性,有助于我们理解涎腺肿瘤的形态学分类。闰管是最重要的涎腺肿瘤发生部位,许多肿瘤与之相关,包括多形性腺瘤、腺样囊性癌、基底细胞腺瘤、上皮–肌上皮癌、多形性低级别腺癌、基底细胞癌和胚胎性肿瘤。与正常闰管一样,这些肿瘤显示出上皮和肌上皮分化。【现在,请在你自己的知识库中为闰管相关肿瘤加上“分泌性癌”,并且它只有上皮分化,没有肌上皮分化】
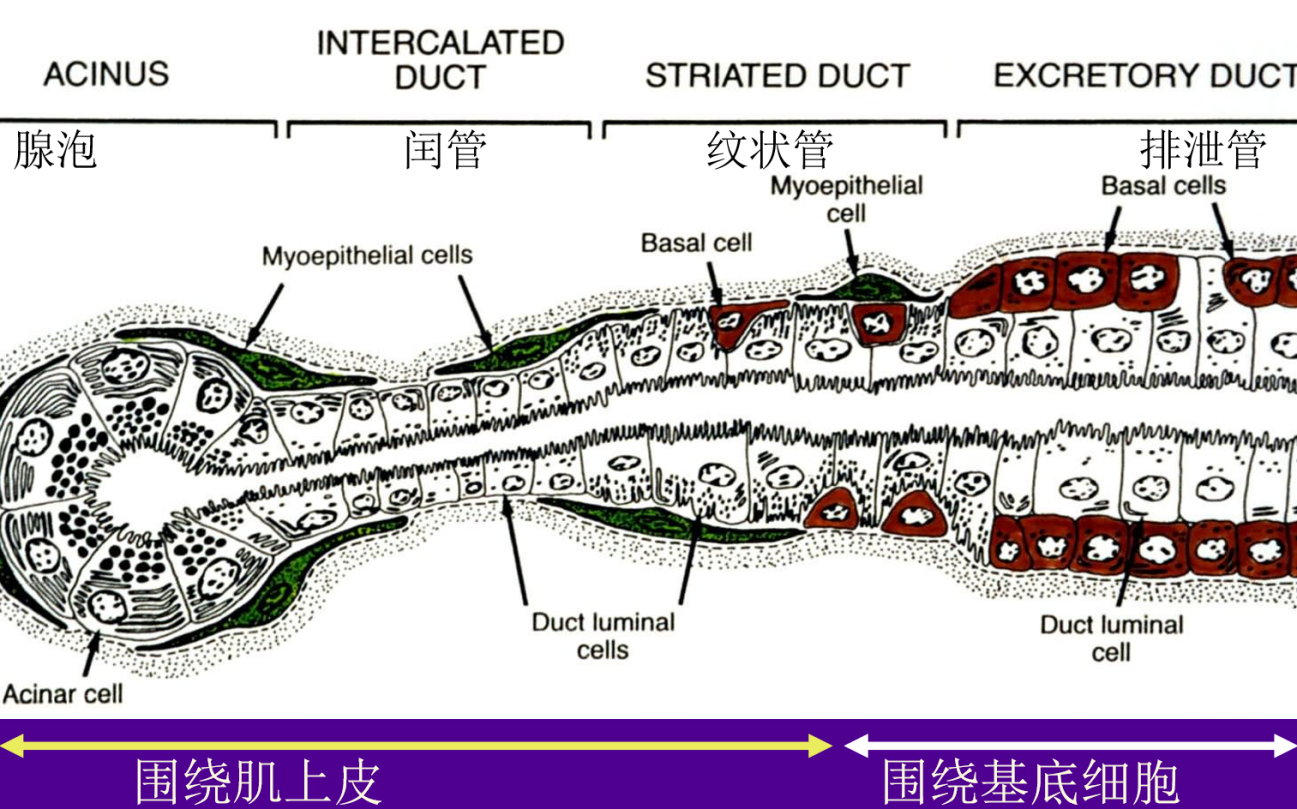
图1.涎腺组织学示意图。闰管与腺泡直接相连,内衬单层立方上皮和一层不规则的肌上皮细胞。
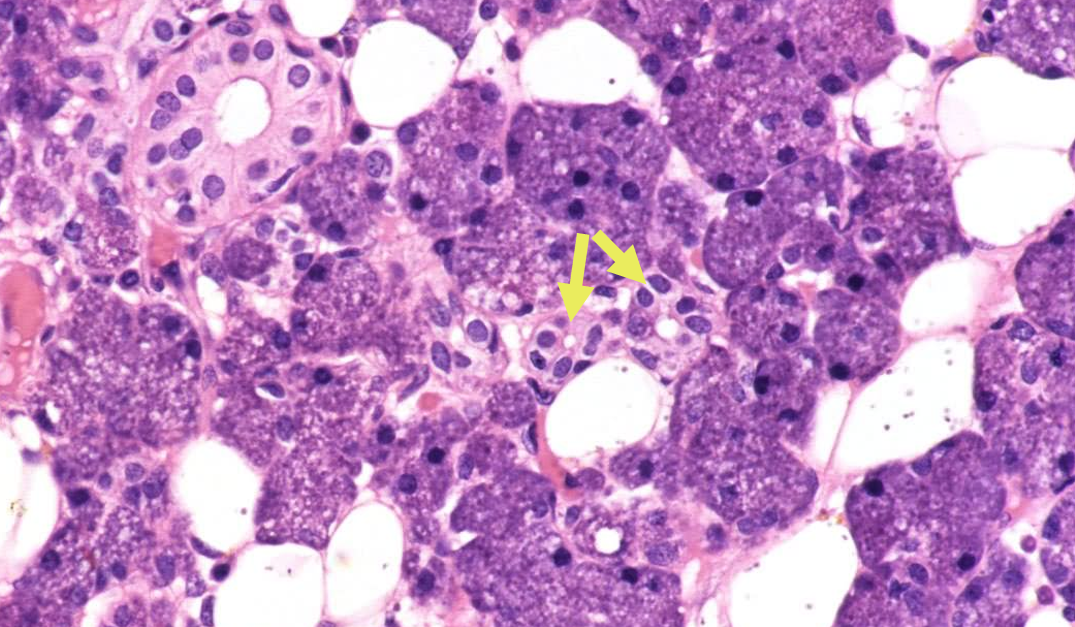
图2.正常腮腺组织学。注意特征性嗜碱性浆液性腺泡。箭头为闰管,与腺泡直接相连。
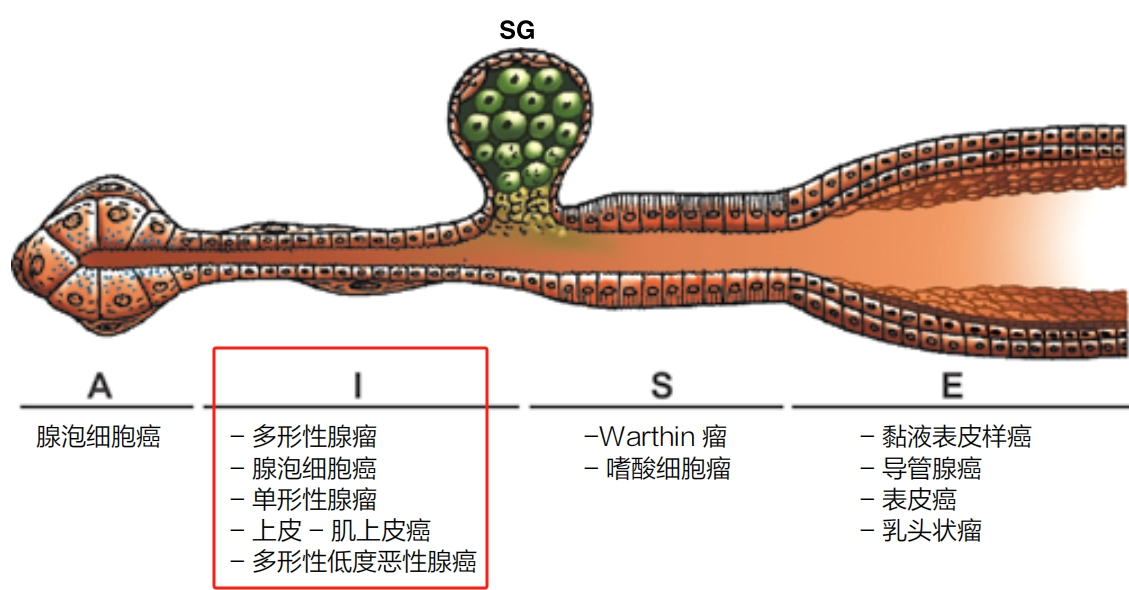
图3.部分肿瘤与涎腺正常上皮结构[腺泡(A)、闰管(I)、纹状管(S)、皮脂腺(SG)和排泄管(E)]具有形态学相似性,但肿瘤形态学表现与组织发生无必然联系。【现在,请在你自己的知识库中为红框部分(闰管肿瘤)加上“分泌性癌”】
一般特征
由于最近才被认识到,分泌性癌的发病率尚不清楚。首次描述以来,又报告了250多例,说明这种肿瘤似乎并不罕见。一项研究中,分泌性癌占原发性涎腺癌的9%,不列颠哥伦比亚癌症机构肿瘤登记中,分泌性癌占恶性泪腺肿瘤的2%。
分泌性癌最常见于腮腺(约70%),其次是口腔(20%)和颌下腺(8%),极少数病例来自鼻窦和副腮腺。
分泌性癌通常发生在成人(平均45岁;范围5-86岁),男性略多(男:女=1.2:1)。儿科病例并不少见。事实上,Xu等人在一家大型医疗中心发现,分泌性癌是第四大最常见的儿科涎腺癌。
临床特征
分泌性癌通常表现为生长缓慢、无痛的肿块。罕见病例(通常是高度转化的病例)伴有面神经麻痹、颈部淋巴结肿大或远处转移。
大体检查
分泌性癌大体表现为不同程度的界限清楚,质硬如橡胶,切面呈黄褐色。可见囊性成分。肿瘤平均约为2厘米,小涎腺发生的肿瘤往往更小。
组织学检查
低倍镜下,分泌性癌的边界情况有所不同。大多数病例向周围涎腺实质呈推挤性浸润(图4),偶尔边界很清楚,甚至有包膜(图5)。神经周围浸润少见(10%-20%的病例)(图6),罕见淋巴血管受累。
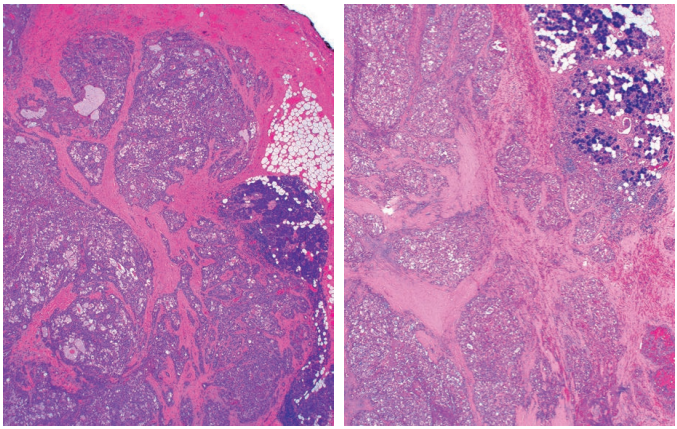
图4.分泌性癌 低倍镜下,分泌性癌通常向邻近正常涎腺腺泡内呈推挤性浸润模式。
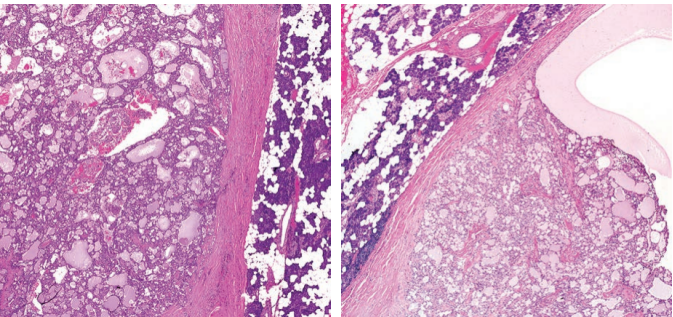
图5.分泌性癌 诊断分泌性癌,浸润性生长方式不是必需的。有些病例边界非常清楚,甚至有包膜,如图所示病例。
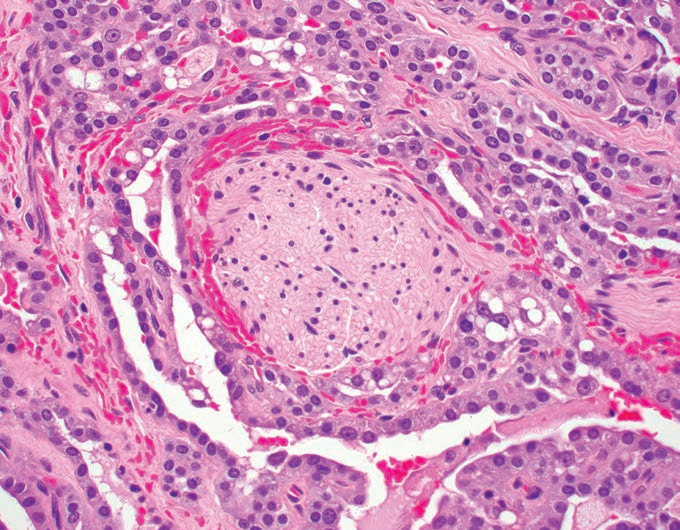
图6.分泌性癌:神经周围浸润 肿瘤腺体和条索包围一个小神经。分泌性癌少见神经浸润。
分泌性癌常被纤维间质分隔成小叶状、推挤性生长,偶尔显著硬化(图7)。可有多种结构模式,包括微囊型(最常见)、管状或滤泡状、实性或乳头状囊性(图8)。肿瘤常以一种结构模式为主,也可能出现多种模式。
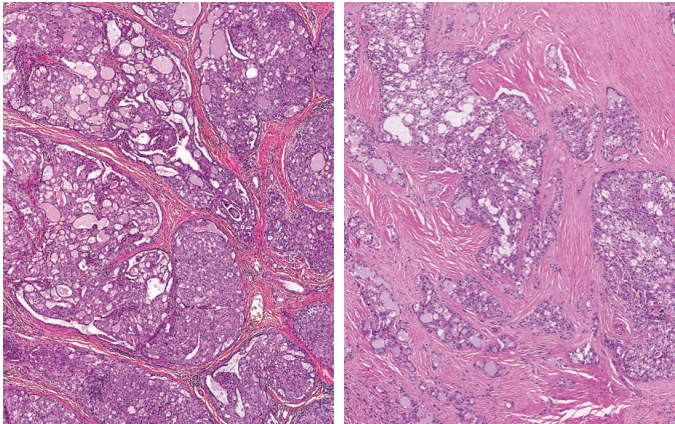
图7.分泌性癌:生长方式 左:纤细的纤维间质把肿瘤分隔成小叶状。右:有些癌显得明显硬化,肿瘤巢和条索被厚胶原束分开。
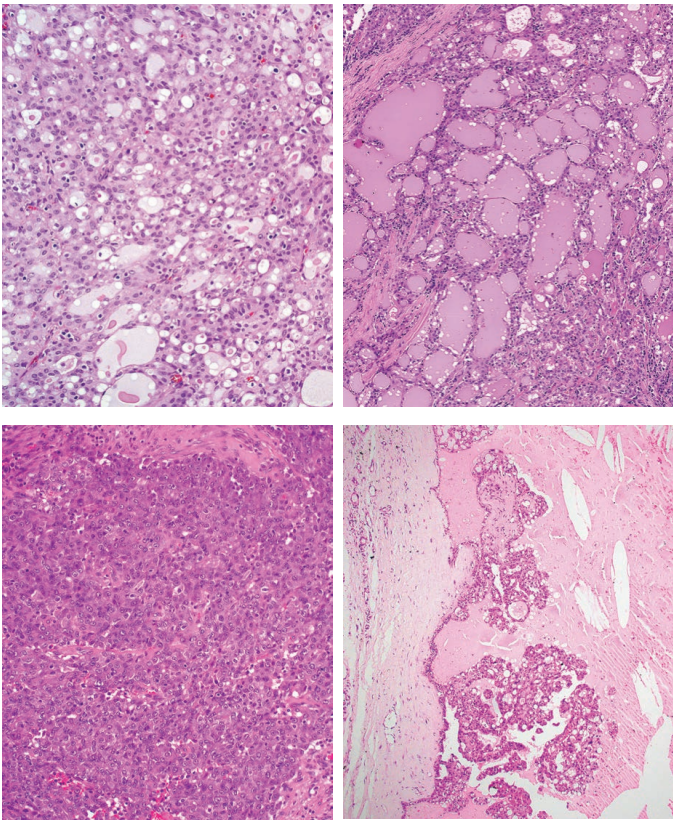
图8.分泌性癌:生长方式 A:分泌性癌结构异质性。微囊生长最常见。B:滤泡生长,合并腔内分泌物,可能貌似甲状腺癌。C:实性模式,成片的细胞,只有很少分泌。D:乳头状囊性模式,伴有腔内分泌物、血液和胆固醇结晶。
尽管分泌性癌有多种结构,但细胞学一致。它由中到大的立方形、多边形或鞋钉状闰管型导管细胞组成,具有大汗腺样形态,含有丰富的粉红色颗粒状细胞质、形态一致的圆形至卵圆形核,伴不同程度的明显核仁(图9)。细胞质可能有空泡化和“泡沫状”,形成局灶透明细胞形态(图9)。没有嗜碱性酶原颗粒。核分裂率通常低,未见坏死。
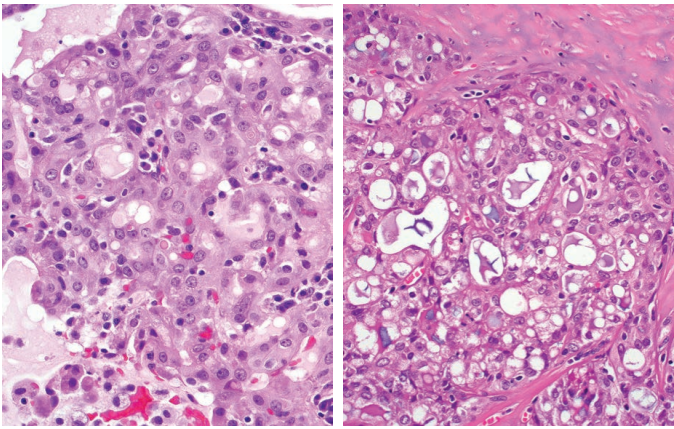
图9.分泌性癌 左:肿瘤细胞含有丰富的嗜酸性胞质和一致的卵圆形核伴开放的染色质和明显核仁。右:部分病例中,肿瘤的细胞质变得空泡化,形成透明细胞。这种改变通常是局灶性。淡染粉红色腔内分泌物使肿瘤得名。
顾名思义,至少部分管腔内或囊腔内恒定发现分泌物,PAS(有和没有淀粉酶消化)和黏液卡红呈阳性,质地从致密强嗜酸性到稀水样双染性不等。分泌物也可能变成空泡。偶见肿瘤相关淋巴样增殖(TALP)(图10)。囊性成分为主的病例可能显示分泌物外渗至邻近组织从而导致的瘤内和瘤周瘢痕、含铁血黄素和胆固醇结晶(图11)。
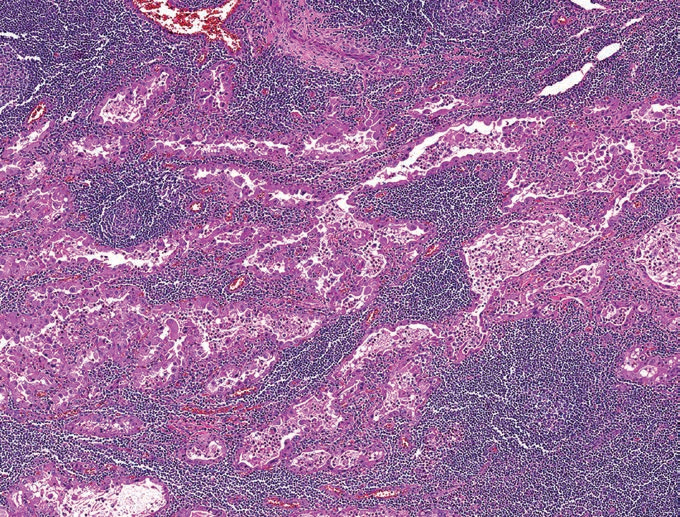
图10.分泌性癌:肿瘤相关淋巴样增殖 拉长的肿瘤腺体,被致密的慢性炎症浸润所分隔。与腺泡细胞癌与黏液表皮样癌相比,分泌性癌很少见到这样的形态。
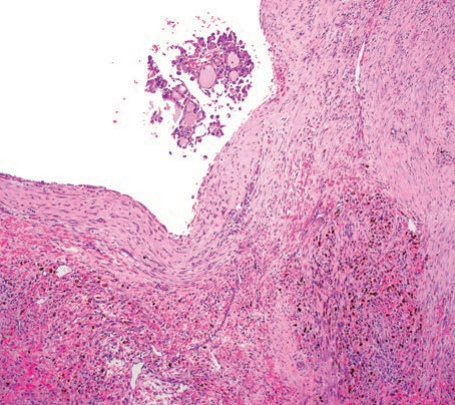
图11.分泌性癌 显著囊性的分泌性癌,由于肿瘤破裂,常有瘢痕、出血和含铁血黄素。
大多数分泌性癌视为低级别,罕见病例出现高级别转化灶。后者具有更明显的实性生长模式、分泌有限和高度侵袭性生长模式,核分裂活跃(>3个/10HPF),核异型性增大,并有坏死(图12)。
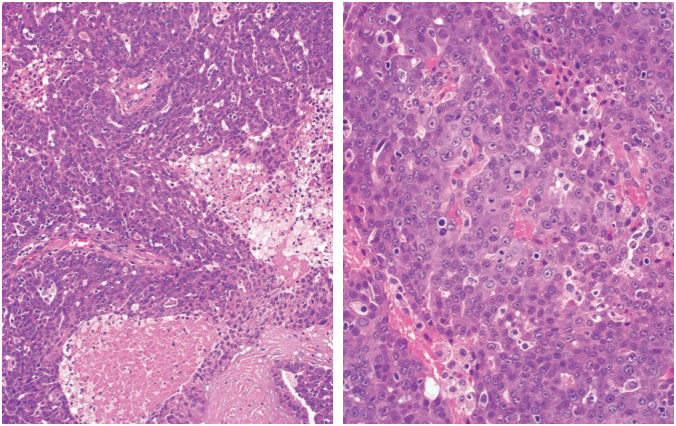
图12.分泌性癌:高级别转化 左:此癌显示更加明显的实性模式,分泌物更少,并有粉刺样坏死。B:可见数个核分裂象,并有更明显的核多形性和实性生长方式。
免疫组化
分泌性癌的特征是广谱CK、CK7、S-100蛋白(图13A)和STAT5a呈阳性,STAT5a通常呈弥漫强阳性。乳腺标志物mammaglobin(图13B)和GATA3(图13C)几乎总是强阳性,GCDFP-15阳性性变化较大。基底细胞标记物和肌上皮标志物如p63、p40、CK5/6和calponin呈阴性,但偶尔会显示局灶的外周肌上皮细胞染色,表明存在非常有限的导管内成分。MUC1、MUC4和SOX10通常阳性,DOG1通常阴性。几乎所有分泌性癌发现了NTRK融合,最近引入的pan-TRK免疫组化标记物似乎是一种相当灵敏的筛查方法。
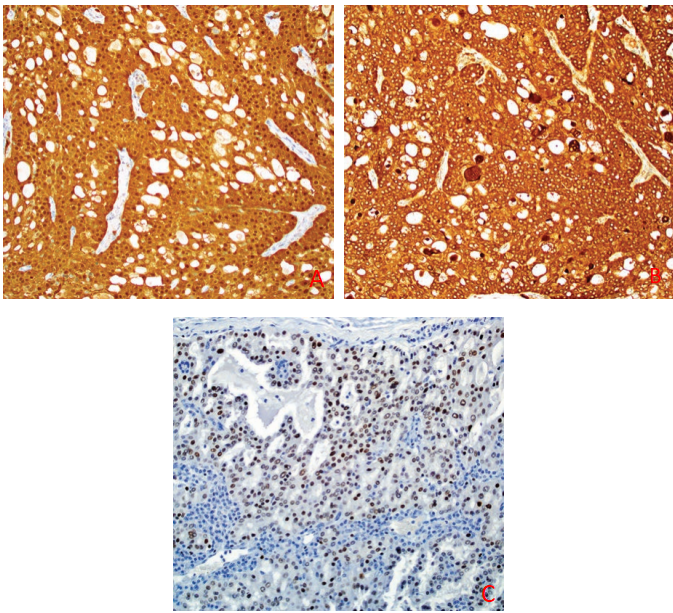


图13.分泌性癌:免疫组化 S100(A)、mammaglobin (B)和GATA3 (C)均为弥漫强阳性,具有特征性。
分子遗传学
分泌性癌的定义性特征是平衡易位t(12;15)(p13;q25)(281)引起的涉及ETV6的基因融合,几乎总是ETV6-NTRK3融合。ETV6-NTRK3融合在其他任何涎腺肿瘤中都没有报道,但有趣的是,在其他器官的多种肿瘤中发现,如婴儿纤维肉瘤、先天性中胚层肾瘤、一些髓系白血病、甲状腺乳头状癌、ALK阴性炎性肌纤维母细胞瘤和非肠型鼻腔鼻窦腺癌。少数罕见的分泌性癌病例显示ETV6与另一个伴侣融合,最常见的是RET。ETV6-RET分泌型癌的临床、组织学或预后特征尚未发现特殊。ETV6重排可用FISH(图14)、RT-PCR或传统核型分析进行检测,其中断点分离探针ETV6 FISH是最敏感的方法。
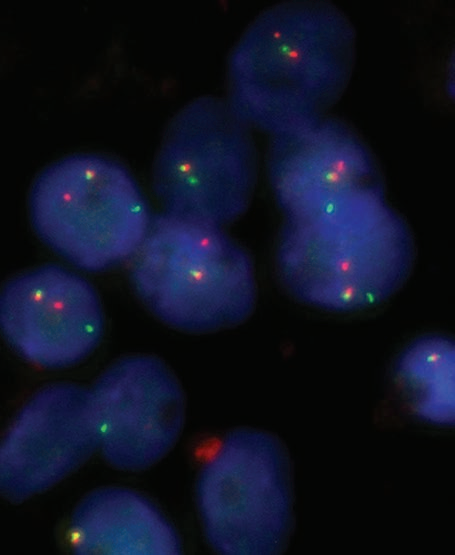
图14.分泌性癌:分子诊断 断点分离荧光原位杂交(FISH)显示肿瘤定义性ETV6重排(绿色和红色信号分开)。
是否需要检测ETV6重排来诊断分泌性癌,这是有争议的。我们的做法是具有形态学和免疫表型特征的分泌型癌不进行常规分子检测。在缺乏分泌性癌典型特征的情况下(例如,非典型免疫表型、不同寻常的发病部位或高度转化),ETV6重排检测是有用的诊断辅助手段,可以证实诊断。
鉴别诊断
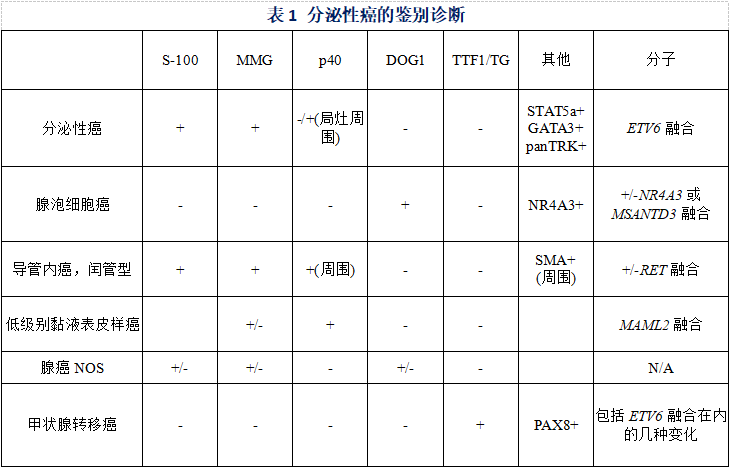
直到最近才认识涎腺分泌性癌,说明它很像其他涎腺肿瘤。鉴别诊断主要包括细胞学温和、“粉红色”细胞形态的肿瘤(见表1)。
1、腺泡细胞癌
在认识分泌性癌之前,分泌性癌最常被误诊为腺泡细胞癌。二者结构模式相似,分泌性癌的细胞类似于腺泡细胞癌的闰管型导管细胞(图15左)。腺泡细胞癌含有酶原颗粒(PAS阳性,PAS-D阳性),这是腺泡细胞癌的定义性特征,而分泌性癌没有酶原颗粒。现在认识到,以前大多数被视为“酶原缺乏”的腺泡细胞癌,通常具有乳头状囊性或滤泡性生长模式,最好归类为分泌性癌。免疫组化有助于区分疑难病例。分泌性癌呈S-100蛋白、mammaglobin和GATA3阳性,而腺泡细胞癌呈阴性。腺泡细胞癌呈DOG1弥漫强阳性(膜染色或小管染色模式)(图15右),而分泌性癌呈阴性或局灶阳性。
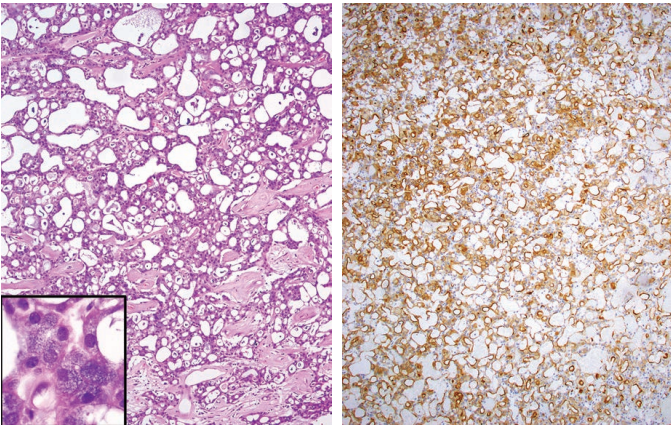
图15.腺泡细胞癌 左:中倍,具有微囊和滤泡生长方式的腺泡细胞癌。然而,高倍可以识别腺泡细胞癌特有的蓝紫色胞质内酶原颗粒(插图)。右:DOG1强染色,呈膜染色/腔面染色模式,这是腺泡细胞癌的特征,仅很少见于分泌性癌。
2、低级别导管内癌
低级别导管内癌通常具有明显的囊性成分,伴有形态温和的嗜酸性导管细胞增殖,常有粉红色管腔内分泌物,这些特征与分泌性癌重叠。此外,导管内癌具有相似的免疫表型:弥漫性表达S-100蛋白、mammaglobin和SOX10。区分导管内癌的关键特征是其导管内分布,用p40或SMA等肌上皮免疫染色容易证明。导管内癌有一层完整的肌上皮细胞包围,而分泌性癌不存在肌上皮,或者最多只有非常局灶的肌上皮表达(图16)。




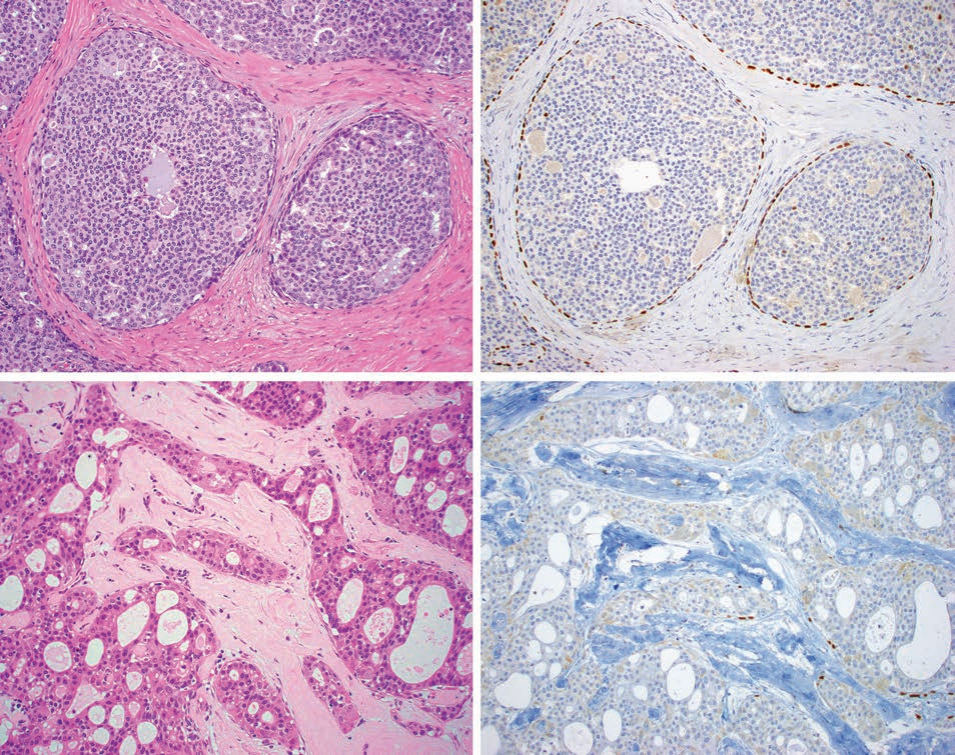
图16.导管内癌与分泌性癌比较 低级别导管内癌(A)与分泌性癌(C)具有相似的肿瘤细胞学、生长方式和分泌物。然而,导管内癌有完整肌上皮围绕,p40阳性(B),而分泌性癌没有或最多只有局灶导管内成分,用p40显示局灶导管内成分(D)。
3、低级别粘液表皮样癌
低级别粘液表皮样癌也可能类似于分泌型癌,两者都有明显的囊性成分、形态温和的细胞伴嗜酸性或空泡化胞质。表皮样细胞和粘液细胞有助于诊断粘液表皮样癌,而分泌型癌没有这两种细胞。此外,粘液表皮样癌的鳞状细胞和中间细胞恒定表达p40,通常不表达S-100蛋白和mammaglobin或仅仅局部表达。大多数低级别粘液表皮样癌都有MAML2融合,检测到MAML2融合可以明确诊断低级别粘液表皮样癌。
4、多形性低级别腺癌
多形性低级别腺癌因为细胞形态温和,S-100蛋白阳性,有时mammaglobin阳性,可能与分泌型癌混淆。然而,多形性低级别腺癌缺乏明显的嗜酸性形态学或分泌物,具有不同的生长模式,包括高度侵袭性条索状、小梁状和成片结构,并且常有神经周围浸润。
5、腺癌或囊腺癌NOS
在认识分泌性癌之前,许多分泌性癌病例被误认为腺癌或囊腺癌NOS。由于肿瘤边界非常局限,分泌性癌也曾被误认为良性囊腺瘤。为了避免这一陷阱,必须记住,分泌性癌可以边界很清楚甚至有包膜;如有其他典型特征,浸润性生长不是诊断所必需的。
6、甲状腺转移性癌
由于分泌性癌可有滤泡或乳头状结构模式和胶样分泌物,可能貌似甲状腺转移性癌,特别是在颈淋巴结中遇到的病例。有些甲状腺乳头状癌携带ETV6-NTRK3融合,分泌性癌偶见于甲状腺,从而更难区分二者。然而,滤泡细胞起源的甲状腺癌恒定表达TTF1和甲状腺球蛋白(TG),而分泌性癌始终呈阴性。
7、涎腺导管癌或高级腺癌NOS
具有高级别转化的分泌性癌,其高级别成分可能很难识别,并可能与涎腺导管癌或高级腺癌NOS相混淆。分泌性癌的高级别区域仍具有与典型病例相同的免疫表型,即:S-100蛋白、mammaglobin和GATA3阳性。几乎所有的涎腺导管癌都呈AR阳性,而分泌性癌呈AR阴性。最后,具有高级别转化的分泌性癌的大部分病例至少局灶出现容易识别的低级别成分。在上述所有鉴别诊断中,分子检测发现ETV6重排阳性证实分泌性癌的诊断,但通常不是诊断所必需的。
治疗和预后
大多数普通型分泌性癌呈惰性生物学行为,与其他低级别癌一样,也有某些侵袭性潜能。高达25%的患者出现淋巴结转移,但远处转移和与肿瘤相关的死亡很少见。分泌性癌罕见高级别转化,成为高度侵袭性肿瘤,经常发生远处转移并致死。分泌性癌罕见发生在皮肤,具有非常惰性的行为。甲状腺发生的分泌性癌常有高分期伴淋巴结转移和高级别特征,但生存情况仍然良好。
分泌性癌尚无标准治疗,通常像其他低级别腺癌一样进行根治性切除,可以加上淋巴结清扫和放射治疗,具体治疗方式取决于肿瘤大小、神经侵犯、阳性切缘和影像学特征。与其他高级别涎腺癌相似,具有高级别转化的分泌性癌在全身化疗的基础上进行更积极的治疗。
对于具有侵袭性、区域性淋巴结转移和远处转移的罕见分泌性癌,ETV6-NTRK3融合可以成为系统性TRK抑制剂的治疗靶点。TRK抑制剂Larotrectinib已获得了FDA批准,为这种罕见侵袭性分泌性癌的治疗方法打开了大门。罕见分泌性癌具有其他替代性融合,可能不会从这种治疗中获益。
参考文献
Tumors of the Salivary Glands. AFIP Atlases of Tumor and Non-Tumor Pathology. Fifth Series, Fascicle 5. 2021
Diagnostic Pathology: Head and Neck. 3ed. 2022







































共0条评论