[导读] 作者:陈旭
临床病史
32岁女性患者,伴左侧腰部隐痛1周,肉眼血尿1天,于泌尿外科门诊就诊,腹部CT提示左侧肾盂9cm占位,考虑肾细胞癌可能,患者遂行左侧肾脏切除术。
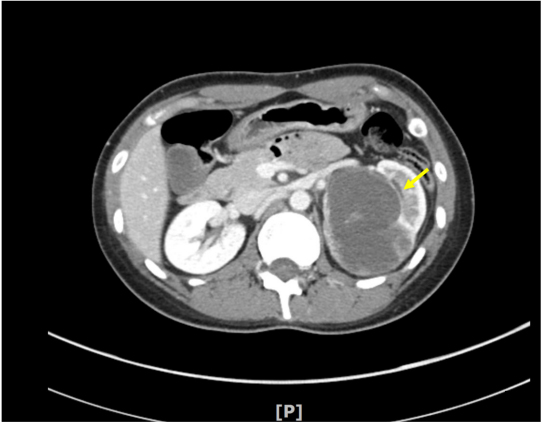
图1.患者影像学资料。左侧肾脏可见边界清晰、体积巨大的实性囊性肿瘤,伴有局灶性强化(箭头所示)。
大体观察
(左侧肾脏)肾脏切除标本,大小12.5cm×9.0cm×7.5cm,上附输尿管,长9.8cm,直径0.5-1cm。肾盂处可见一大小9.5cm×7.5cm×5.0cm的灰白灰褐色肿物,肿物距离肾脏背膜0.4cm,切面可见出血及坏死。
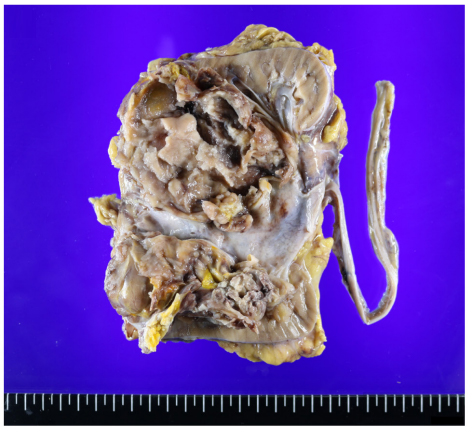
图2.大体标本。肿物切面灰白灰褐,局部可见坏死及出血。
组织学表现
低倍镜下,肿瘤细胞弥漫分布,侵犯肾脏背膜,肿瘤细胞由纤维条束分隔,局部可见囊性改变及出血坏死。高倍镜下,细胞核呈圆形、卵圆形、梭形、肾形,大小较均匀,肿瘤细胞胞质稀少,核质比高,染色质细腻,核仁不明显。肿瘤细胞间见明显的树枝状血管网,可见大量核分裂。
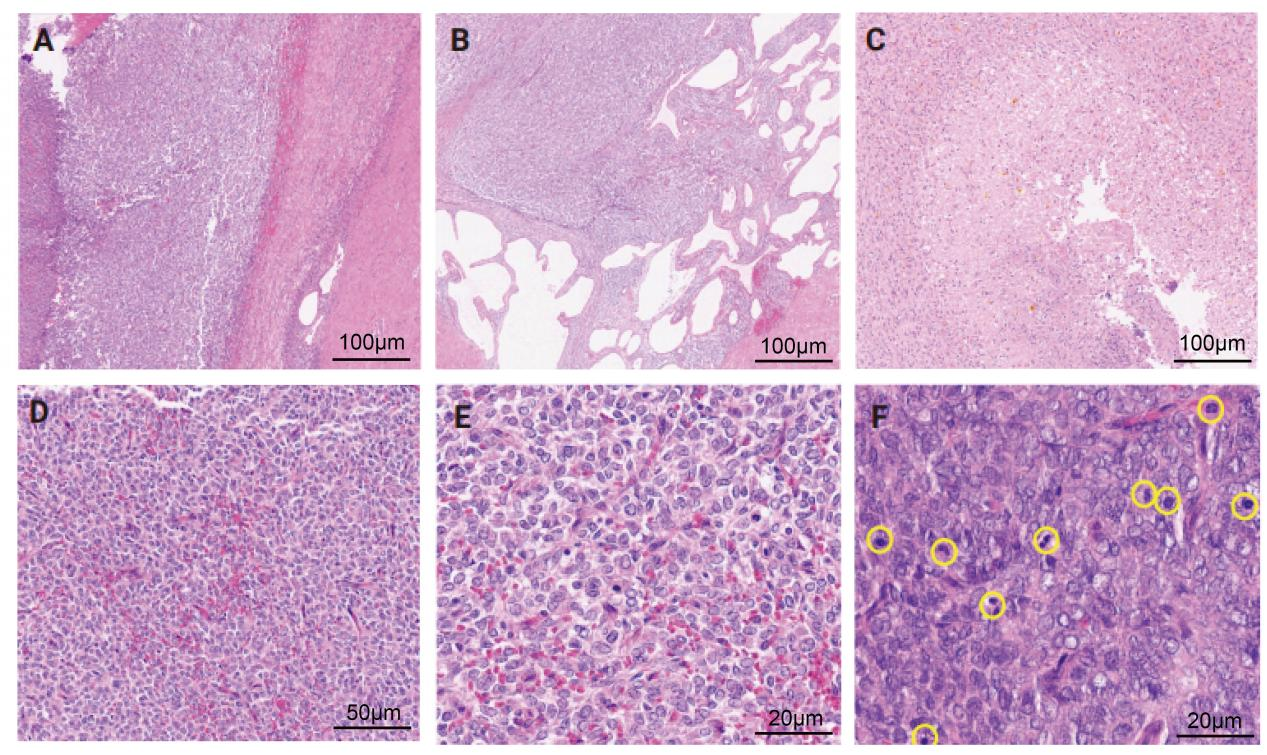 图3.组织学形态特点。(A)实性片状生长模式,可见纤维隔膜分隔。(B)部分区域囊状改变。(C)可见坏死。(D)可见分支血管。(E)肿瘤细胞呈圆形至椭圆形,核囊泡,核膜不规则,核仁不明显,细胞质透明至嗜酸性。(F)高倍视野中,核分裂明显(圆圈标记)。
图3.组织学形态特点。(A)实性片状生长模式,可见纤维隔膜分隔。(B)部分区域囊状改变。(C)可见坏死。(D)可见分支血管。(E)肿瘤细胞呈圆形至椭圆形,核囊泡,核膜不规则,核仁不明显,细胞质透明至嗜酸性。(F)高倍视野中,核分裂明显(圆圈标记)。
免疫组化改变
CKP(-),Vimentin(+),RCC(-),PAX-8(-),HMB45(-),S-100(-),Melan-A(-),ER(-),PR(-),CD10(-),WT-1(-),NKX2.2(-),SS18-SSX(-),SMA(-),Desmin(-),CD56(+),CD99(部分+),Cyclin D1(+),BCOR(弥漫+),Ki-67(增殖指数约为80%)。
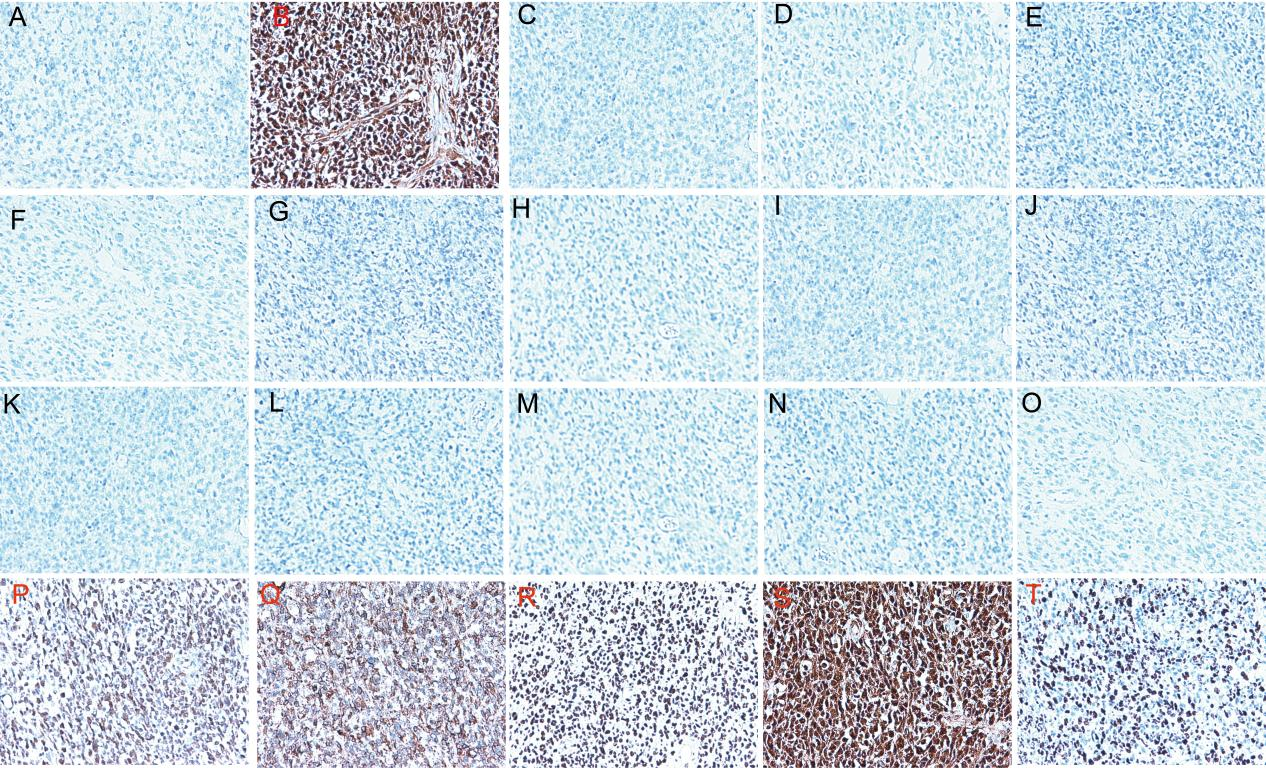 图4.免疫组化结果。(A)CKP;(B)Vimentin;(C)RCC;(D)PAX-8;(E)HMB45;(F)S-100;(G)Melan-A;(H)ER;(I)PR;(J)CD10;(K)WT-1;(L)NKX2.2;(M)SS18-SSX;(N)WT-1;(N)SMA;(O)desmin;(P)CD99;(Q)CD56;(R)Cyclin D1;(S)BCOR;(T)Ki-67.
图4.免疫组化结果。(A)CKP;(B)Vimentin;(C)RCC;(D)PAX-8;(E)HMB45;(F)S-100;(G)Melan-A;(H)ER;(I)PR;(J)CD10;(K)WT-1;(L)NKX2.2;(M)SS18-SSX;(N)WT-1;(N)SMA;(O)desmin;(P)CD99;(Q)CD56;(R)Cyclin D1;(S)BCOR;(T)Ki-67.
分子检测结果
FISH检测提示BCOR断裂阳性,二代测序检测结果显示BCOR::CNNB3基因融合阳性。
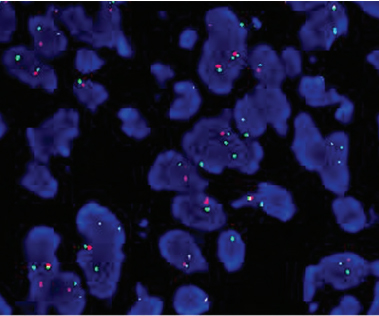
图5.BCOR分离探针FISH检测: BCOR基因发生断裂。FISH法检测BCOR基因分离探针:>20%肿瘤细胞见红绿分离信号,表现为2绿1红,且红绿信号距离大于2个信号大小为阳性。
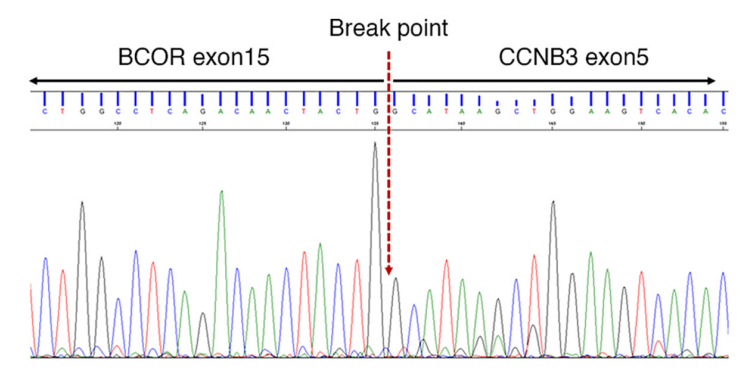 图6.Sanger测序法显示BCOR基因第15外显子与CCNB3基因第5外显子存在相同的融合点。
图6.Sanger测序法显示BCOR基因第15外显子与CCNB3基因第5外显子存在相同的融合点。
最终诊断
(左侧肾脏)伴有BCOR-CNNB3 融合阳性肉瘤。肾脏背膜、肾周脂肪、肾盂肾窦可见瘤组织累及。输尿管切缘、脉管切缘未见瘤组织累及。【AJCC分期:pT3aNxMx】
患者治疗及随访
患者术后行尤因肉瘤方案化疗(异环磷酰胺、依托泊苷和环磷酰胺、多柔比星、长春新碱交替化疗),化疗每2~3周一次,合计10疗程及局部放疗; 截至2025年6月,患者无复发及转移。
疾病概述
BCOR重排肉瘤是新近认识的独立疾病实体,2012年由Pierron等采用RNA测序在594例小圆细胞肉瘤中发现有24例BCOR-CCNB3融合肉瘤,并经RT-PCR验证。随后陆续有文献报道BCOR可以与MAML3、ZC3H7B、KMT2D、CIITA等基因发生融合。目前,将BCOR发生基因融合的肉瘤统称为BCOR重排肉瘤,其中以BCOR-CCNB3融合肉瘤(BCS)最为常见。
临床特点
BCS好发于青少年及青年,发病年龄2~60岁,平均17岁,中位年龄15岁。该肉瘤常见于男性; 多发于骨组织,好发部位包括下肢、骨盆及脊柱区域,另也可发生于胸壁、腹壁、锁骨、肋骨、眉弓、肩膀、上颚及肾脏等部位。肿瘤最大径3~27cm,平均最大径11.7cm,中位最大径11cm。
病理学特点
BCS是一种未分化小圆细胞肉瘤,可由不同比例的圆形、卵圆形及梭形细胞组成,也可以圆形细胞或梭形细胞中的任何一种为主,呈片状、漩涡状、束状排列,可由高细胞密度区和低细胞密度区混合组成,肿瘤细胞核大小较一致,染色质细腻,核仁不明显,间质可见丰富的树枝状毛细血管,也可有多少不等的黏液样变或胶原样组织。坏死较常见,可为局灶性或地图状; 可见核分裂象(1~25个/10HPF)。复发和转移病例肿瘤细胞密度增加和细胞多形性明显。
免疫组化对该肿瘤的诊断有一定的提示作用。抗体BCOR 的免疫组化染色对BCOR重排肉瘤高度敏感,细胞核呈弥漫强表达,但BCOR也可在滑膜肉瘤中表达。BCS还可表达CCNB3、SATB2、TLE1、PAX7、Cyclin D1及CD99,但SATB2和TLE1也可在滑膜肉瘤中表达,CD99和PAX7在BCOR重排肉瘤中表达不稳定,强度不如Ewing肉瘤,SATB2还可在骨肉瘤中表达。文献报道Ki-67增殖指数表达不一(10%~80%),可见该肿瘤的增殖活性具有异质性。联合免疫组化检测BCOR、SATB2、Cyclin D1对BCS有诊断价值,但最终诊断仍需进行分子检测。
分子检测的优缺点
二代测序能够检测已知和未知的基因改变,但操作复杂,成本高昂。RT-PCR需要特定的引物,并且只能检测出已知的基因重排。FISH技术目前比较成熟且应用广泛,FISH分离探针具有操作简便、筛选覆盖范围广、成本低的优点,可检测出各种类型基因融合的BCOR重排肉瘤,但无法检测出与BCOR发生融合的伙伴基因。FISH融合探针可以检测出BCOR的融合伙伴,但一次只能检测一种融合方式,而BCOR可与多种基因发生融合(CCNB3、MAML3、ZC3H7B、KMT2D、CIITA等) ,可能需检测多次才得到阳性结果。
鉴别诊断
(1)Ewing肉瘤
细胞形态较单一,片状排列; BCOR重排肉瘤细胞形态更加多样,可呈圆形、卵圆形及短梭形。Ewing 肉瘤CD99细胞膜强阳性,NKX2.2强阳性,而BCOR重排肉瘤中NKX2.2阴性。Ewing肉瘤可检测EWSR1与其它基因的融合,BCS以BCOR基因改变为特征。
(2)CIC重排肉瘤
肿瘤细胞异型性更大,部分区呈上皮样,核不规则,核仁明显。免疫组化标记WT1和ETV4均阳性,而在 BCOR重排肉瘤中均阴性。另外,FISH或PCR检测也可资鉴别。
(3)胚胎性横纹肌肉瘤
该肿瘤多数可见特征性的横纹肌样细胞,免疫组化标记 MyoG、MyoD1、desmin、SMA 均阳性,BCS中肌源性标记阴性。
(4)单向型滑膜肉瘤
肿瘤细胞也为梭形细胞或卵圆形细胞,BCOR、TLE1和SATB2在滑膜肉瘤和BCS重排肉瘤中均可阳性,CK、EMA及S-100在滑膜肉瘤阳性率较高,在BCOR重排肉瘤仅有少数阳性或阴性。FISH检测SS18或BCOR融合基因可资鉴别。
治疗及预后
BCS的治疗方法主要有手术切除、放、化疗,必要时辅以免疫治疗。目前,多数BCS使用Ewing肉瘤化疗方案。文献报道BCS的5年和10年生存率分别为75%和56%,治疗疗效优于尤因肉瘤(5年生存率为54% ) ,但两者预后差异无统计学意义。BCS预后优于CIC重排肉瘤。
参考文献
[1]Pierron G, Tirode F, Lucchesi C, et al. A new subtype of bonesarcoma defined by BCOR-CCNB3 gene fusion[ J]. Nat Genet,2012,44:461-466.
[2]Kao YC, Owosho AA, Sung YS, et al. BCOR-CCNB3 fusion positive sarcomas: A clinicopathologic and molecular analysis of 36 cases with comparison to morphologic spectrum and clinical behavior of other round cell sarcomas[ J]. Am J Surg Pathol,
2018,42(5):604-605.
[3]Cai Z, Duncan D, Li R, et al. BCOR-CCNB3 sarcoma with prominent rhabdoid cells mimicking rhabdomyoblasts: Expanding the morphologic spectrum of BCOR-CCNB3 sarcoma [ J]. Int J Surg Pathol, 2021,29(8):915-919
[4]Kao YC, Sung YS, Zhang L, et al. BCOR overexpression Is a highly sensitive marker in round cell sarcomas with BCOR genetic abnormalities [J]. Am J Surg Pathol,2016,40:1670-1678.



















共0条评论