[导读] 编译整理:强子
其他图例展示
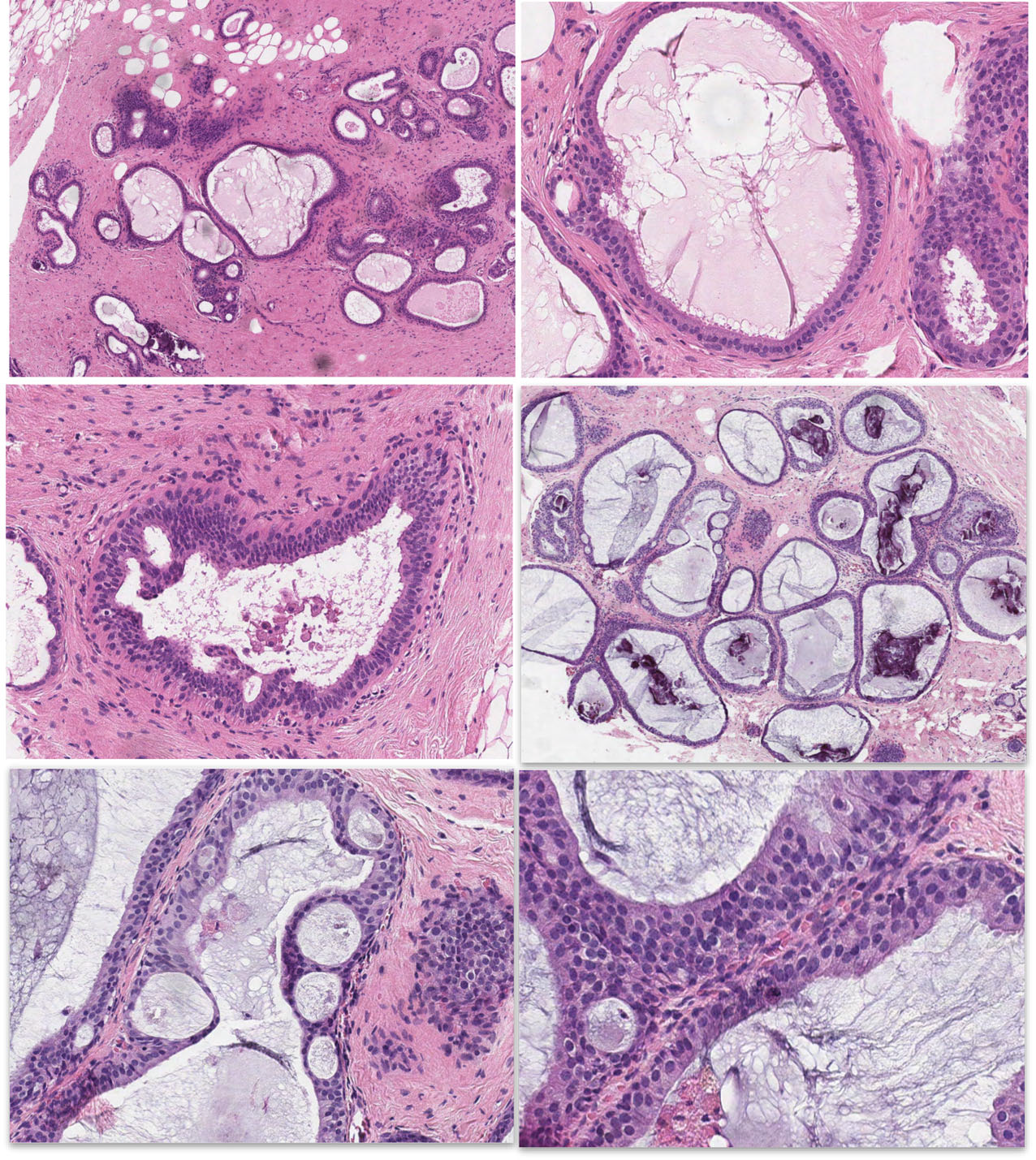 图4.第一组病例,参与者意见完全一致:
图4.第一组病例,参与者意见完全一致:
A-C,100%一致判定为无非典型:(A)结构混杂,主要为腺腔轮廓不规则腺腔轮廓;(B)导管内衬相对一致的、位于基底的圆形细胞核,有复层表现,相邻小叶可见部分核增大及极性丧失。(C)单个导管腔隙僵硬,可见早期搭桥结构,并非典型罗马桥结构中细胞无极向、朝向腺腔内的表现。
D-F,100%一致判定为非典型:(D)均匀的僵硬结构,伴黏液及微钙化,范围超过2.3mm。(E)局灶僵硬的打孔样腔隙,周围可见流水型、逐渐变窄的搭桥,并非罗马桥的表现。(F)细胞核圆形、均一,复层表现的区域极性丧失。
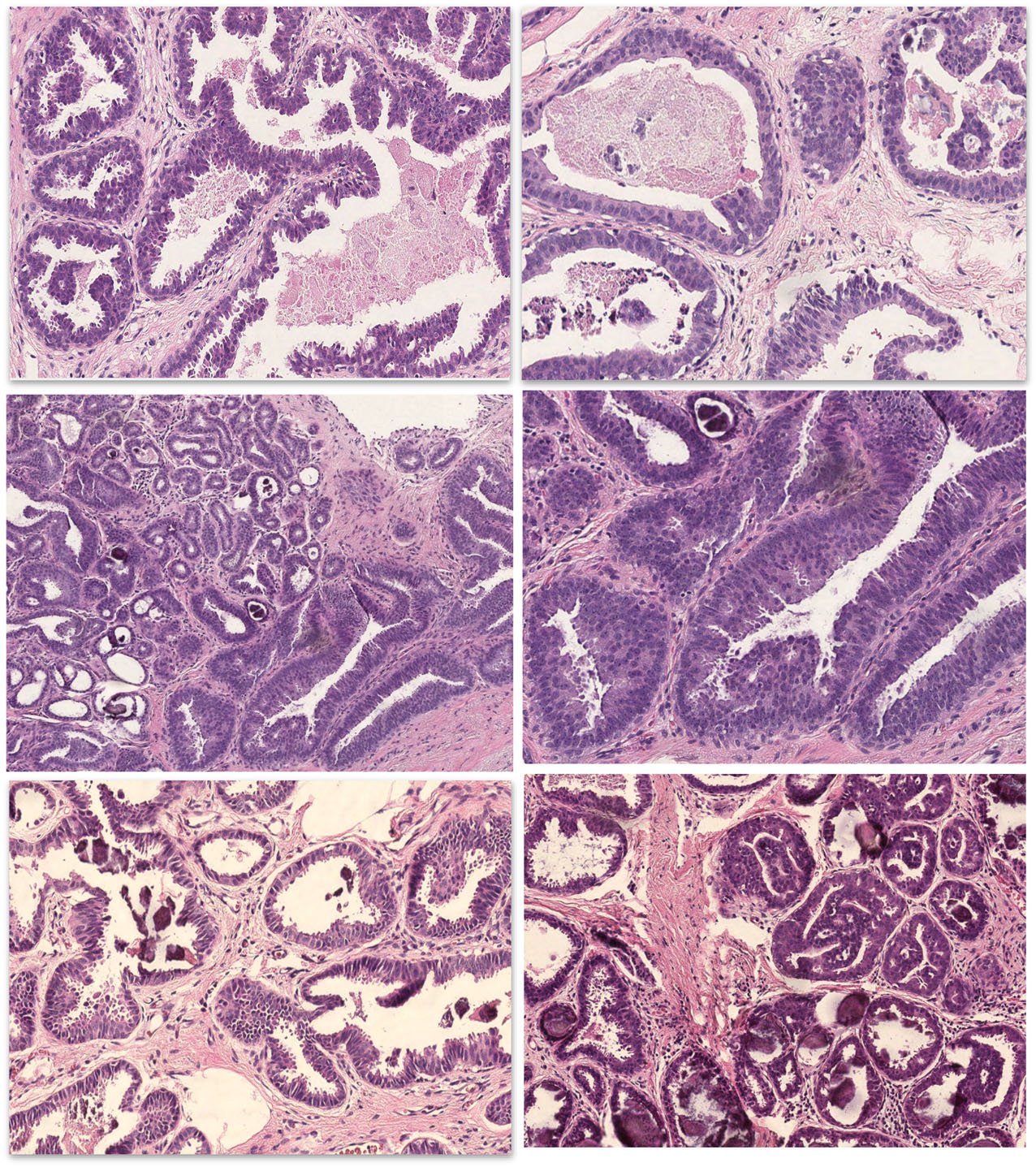 图5.第二组病例,参与者>70%意见一致:
图5.第二组病例,参与者>70%意见一致:
(A、B)本例部分区域(左图)有柱状细胞增生,细胞核拉长、复层,并可见微乳头状结构,管腔轮廓不规则;另一区域(右图)则为细胞核更具异型性的圆形表现,轮廓更为僵硬,失去极向性,且顶端无胞质分泌性凸起现象(apical snouting)。
(C、D)本例可见伴钙化的柱状细胞改变及增生,左图示低倍即可见深染表现;高倍镜下,导管衬覆细胞的核为圆形、卵圆形,位于基底,有细小、但显著可见的核仁,呈复层表现及结节状凸起,结构未见显著复杂表现。
(E、F)左图病例,大部分专家诊断为交界性、倾向于有非典型。其导管不规则扩张,但无轮廓僵硬或结构复杂表现,只是部分专家描述有微乳头状结构(箭头所示);内衬上皮复层表现,细胞核有“令人担心”的增大,且失去极向性;右图病例的右侧为柱状细胞增生表现,左侧为非典型区域,具体为非典型导管增生/非典型导管内上皮增生,后者为融合表现、而是打孔状的腔隙;不过,细胞核圆形,有明确的非典型、并有极向丧失。
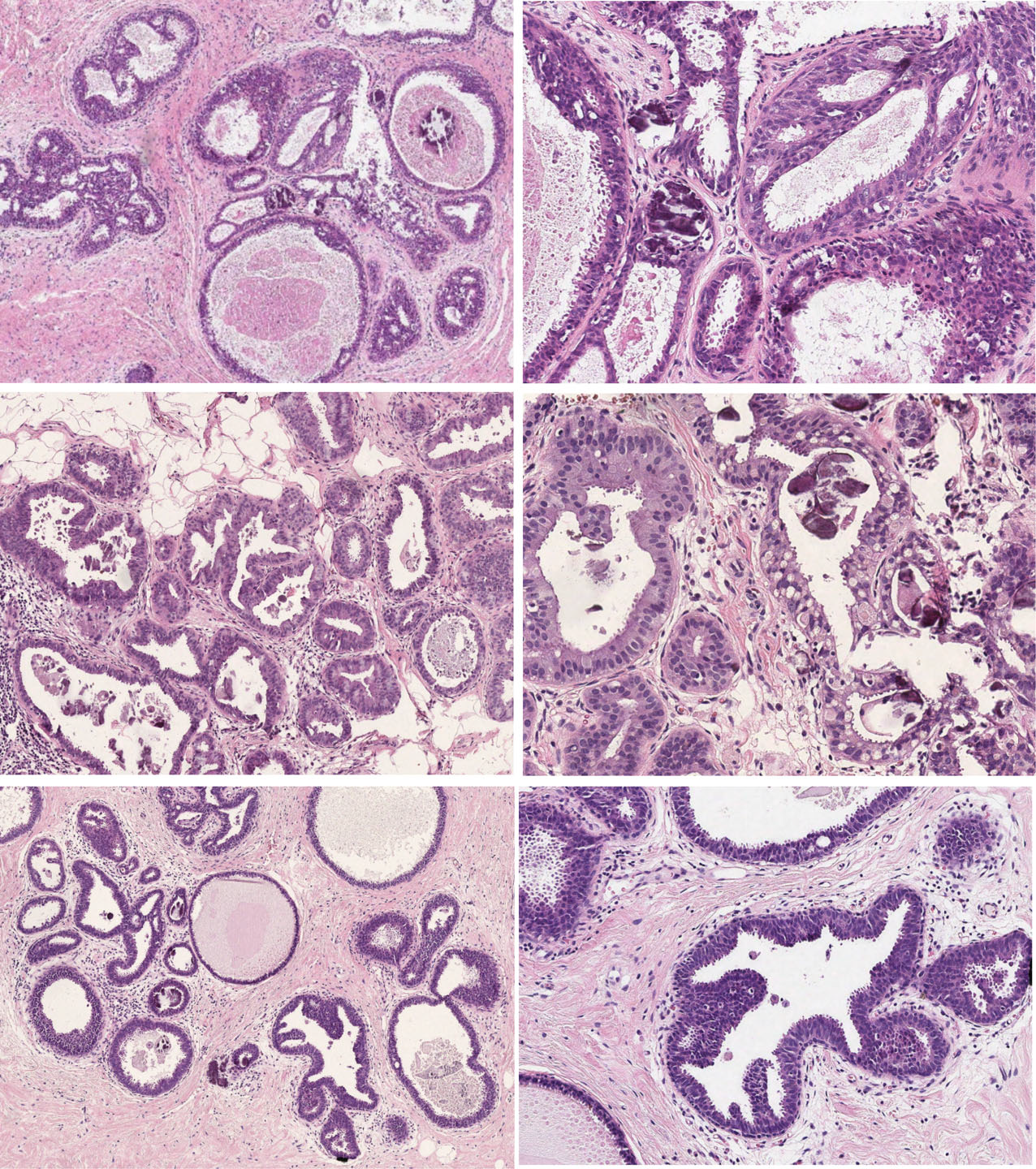 图6.第三组病例,诊断一致率最低。
图6.第三组病例,诊断一致率最低。
(A、B)本例可见局灶扩张的导管,轮廓圆形、不规则,结构复杂;倾向于诊断非典型的病理专家主要是着眼于右图左上方更为僵硬的腔隙、极向性缺失,且细胞核增大程度超出了低级别非典型的预期(右图箭头所示)。
(C、D)本例可见终末导管小叶单位轮廓不规则,伴复层及钙化;细胞立方状至柱状,细胞核圆形、卵圆形,胞质中等量;右图示局灶极向丧失、且胞质内有空泡。倾向于诊断非典型的病理专家主要着眼于有早期的微乳头(箭头所示)、细胞核增大、更为显著的慢性炎症(局灶位于小叶间,左图星号所示)。其他病理专家则考虑可能为早期大汗腺改变,且提出胞质丰富、无均匀分布的形态单一细胞核、无结构非典型,这些足以诊断为无非典型。
(E、F)本例可见终末导管小叶单位扩张,结构主要呈圆形、伴复杂结构,后者表现为增生、凸起的微乳头状和搭桥。将其诊断为非典型的病理专家主要是根据这些增生、凸起,他们将其视为真正的微乳头,加之有显著的极向丧失、细胞核增大、细胞核大小不一、圆形表现。其他病理专家则认为这些特征尚不满足真正微乳头的诊断,应符合柱状细胞增生,并强调细胞核重叠,明确不足以诊断为平坦型上皮非典型、也不足以诊断为非典型导管上皮增生。
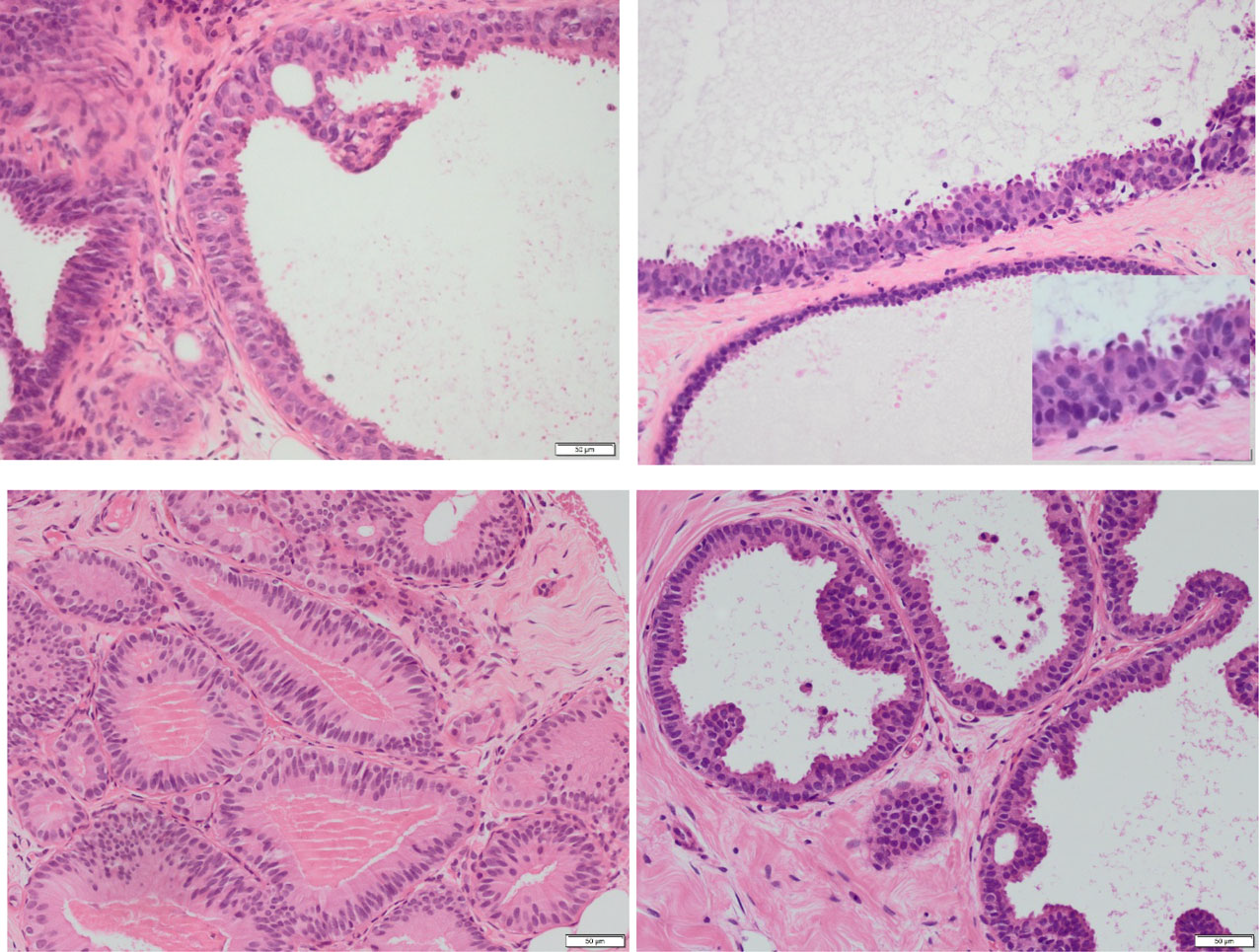 图7.难以归类的柱状细胞病变示例。
图7.难以归类的柱状细胞病变示例。
(A) 意见分歧(部分认为非典型,部分认为无非典型)。扩张导管衬覆复层排列的体积小的细胞,伴结构紊乱及细胞核重叠,相邻导管呈现柱状细胞增生。可见早期打孔样腔隙,搭桥的细胞形成有角度、但两端渐细的梁状结构。细胞核呈空泡状,伴轻度轮廓不规则,偶见针尖状核仁。
(B-D) 多数支持非典型诊断:
(B) 两处僵直扩张的导管:一处衬覆单层、小的立方细胞,细胞核圆形;另一处内衬细胞的核较大但仍呈圆形、重叠排列,局部结构紊乱及极性丧失(插图所示)。可见胞质顶端凸起及早期簇状结构,但无微乳头、梁状或搭桥结构。多数意见认为应判定为非典型(粗针穿刺活检分级B3)。
(C) 衬覆柱状上皮的导管腔及小叶,细胞显著复层化但无明显重叠。细胞核呈卵圆或圆形,染色质平滑、细胞核轮廓规则,核仁不明显。胞质丰富且呈致密嗜酸性。腔缘无胞质顶端凸起,管腔内含致密嗜酸性物质且无核碎片。
(D) 柱状细胞,细胞核呈卵圆至圆形,染色质平滑、细胞核轮廓规则且核仁不明显。呈现轻度结构改变,具体为局灶性凸起、搭桥及早期棒状结构),背景无复层化排列。
——全文完——
往期回顾:

















共0条评论