[导读] 作者:甘肃省人民医院病理科 陈旭
临床概要
20岁男性患者,无明显诱因的连续性全腹部疼痛6小时,于我院急诊科就诊,行CT检查提示:脾脏增大并实质不均匀强化,合并脾脏包膜下血肿,多考虑弥漫性血管瘤伴局部脾脏梗死,并脾脏破裂出血。遂行急诊脾脏切除术治疗。
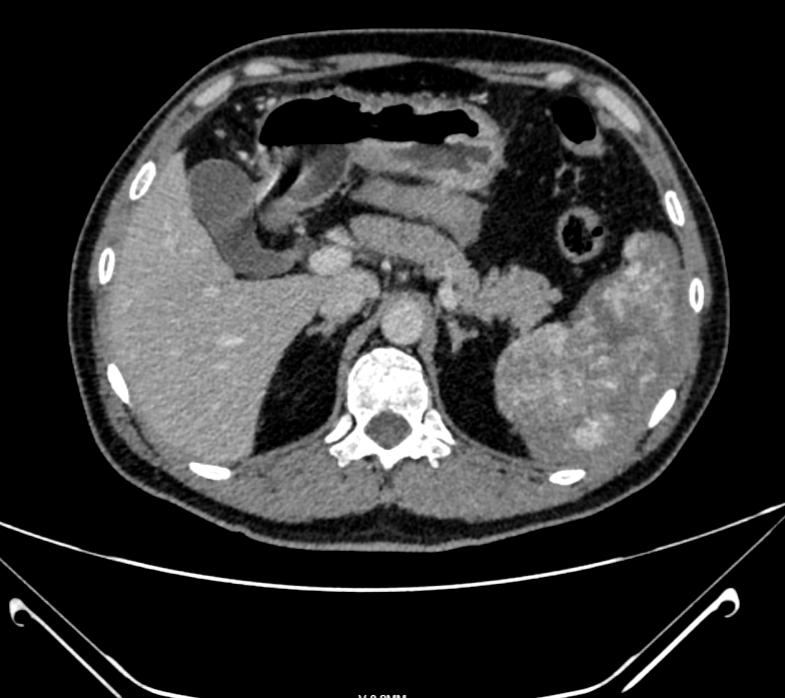 图1.患者影像学资料。增强CT显示,脾脏增大并实质不均匀强化。
图1.患者影像学资料。增强CT显示,脾脏增大并实质不均匀强化。
大体观察
脾脏切除标本一个,大小12×10×6cm,被膜面可见一长3cm的破口,脾脏切面可见一灰黄灰褐结节, 大小3.0×2.4cm,余切面灰红实性、质软。
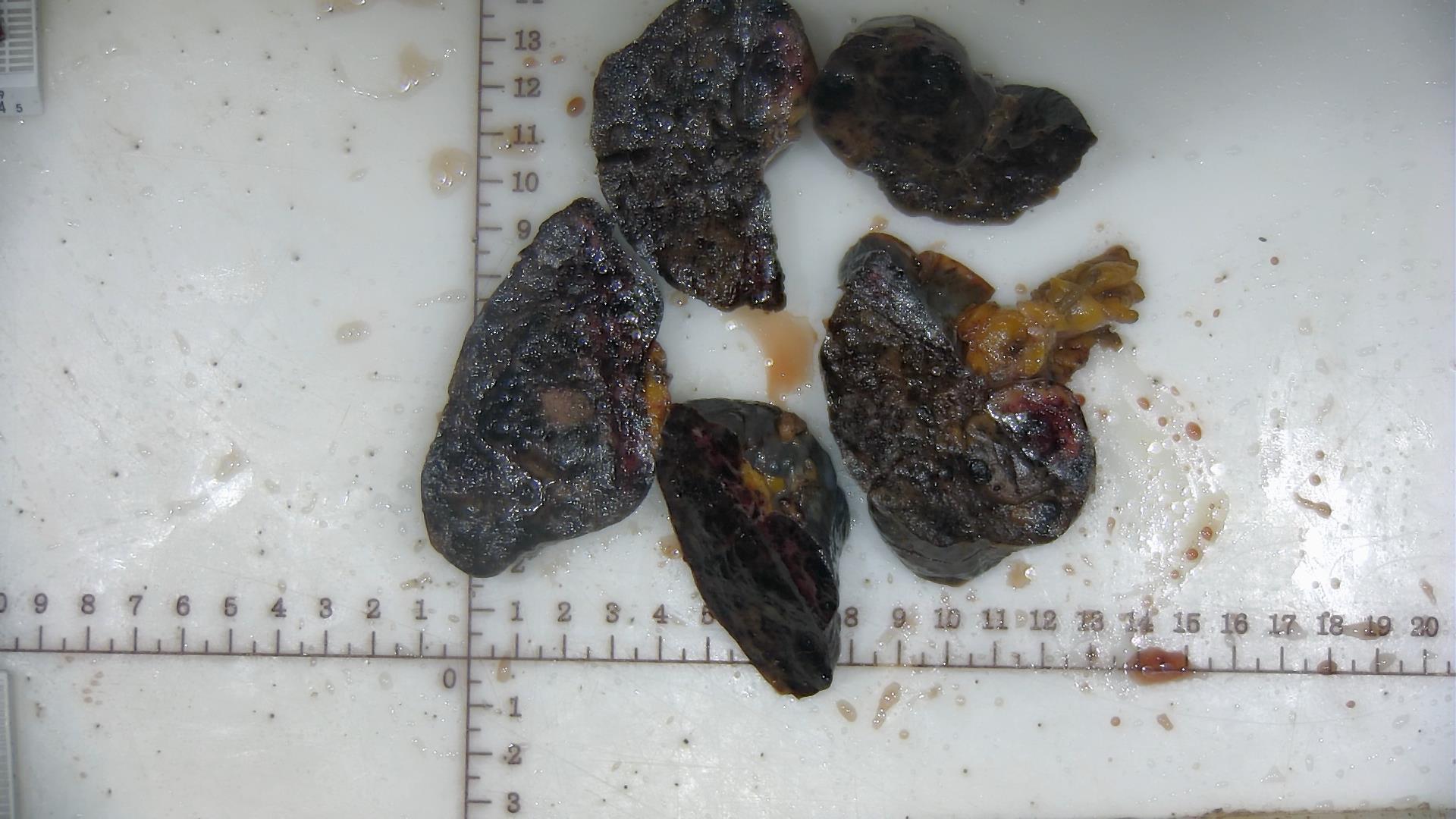 图2.患者脾脏切除标本。可见出血破裂区域(蓝色箭头所示)及结节区域(红色箭头所示)。
图2.患者脾脏切除标本。可见出血破裂区域(蓝色箭头所示)及结节区域(红色箭头所示)。
镜下所见
低倍镜下,脾脏正常结构破坏,可见大量出血区域及细胞密集区域。高倍镜下,肿瘤细胞呈上皮样,胞质丰富,排列成片状、巢状、条索状,穿插浸润性生长。部分肿瘤细胞胞质内可见空泡,部分空泡内可见红细胞,局部见分化良好的血管腔样结构,细胞异型性轻微,核分裂象大于7个/HPF。
 图3.组织病理改变。(A)低倍镜下,可见出血及细胞密集区域(10X)0;(B)肿瘤细胞呈上皮样,胞质丰富,排列成片状、巢状、条索状,穿插浸润性生长(20X);(C)局部见分化良好的血管腔样结构(20X);(D)部分肿瘤细胞胞质内可见空泡,部分空泡内可见红细胞,细胞异型性轻微,核分裂象大于7个/HPF(40X)。
图3.组织病理改变。(A)低倍镜下,可见出血及细胞密集区域(10X)0;(B)肿瘤细胞呈上皮样,胞质丰富,排列成片状、巢状、条索状,穿插浸润性生长(20X);(C)局部见分化良好的血管腔样结构(20X);(D)部分肿瘤细胞胞质内可见空泡,部分空泡内可见红细胞,细胞异型性轻微,核分裂象大于7个/HPF(40X)。
免疫组化结果(肿瘤细胞表达)
CKP(-),AACT(-),CD8(-),D2-40(-),Fli-1(部分+),CD31(+),CD34(+),ERG(+),CAMTA1(+),Ki-67(增殖指数约为10%)。
 图4.免疫组化染色结果(×20)。(A)CKP;(B)AACT;(C)Fli-1;(D)CD31;(E)CD34;(F)ERG;(G)CAMTA1;(H)D2-40;(I)Ki-67。
图4.免疫组化染色结果(×20)。(A)CKP;(B)AACT;(C)Fli-1;(D)CD31;(E)CD34;(F)ERG;(G)CAMTA1;(H)D2-40;(I)Ki-67。
分子检查结果:WWWTR1-CAMTA1基因融合阳性。
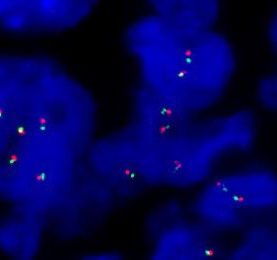
图5.FISH检测提示WWWTR1-CAMTA1基因融合阳性。红色为WWWTR1探针,绿色为CAMTA1探针,黄色为WWWTR1-CAMTA1基因融合(黄色箭头标记)。
最终诊断:(脾脏)上皮样血管内皮瘤,伴WWWTR1-CAMTA1基因融合型。
患者随访5年,无复发。
疾病研究历史
上皮样血管内皮瘤(epithelioid hemangioendothelioma,EHE)是一种罕见的血管源性肿瘤,EHE最初是在肺内发现的,1975年,Dail和Liebow首次将其描述为血管内细支气管肺泡瘤(intravascular bronchioloalveolar tumor,IVBAT)。1978年,Corrin等在结节内的肿瘤细胞中发现了Weibel-Palade小体,证明肿瘤细胞来自内皮细胞分化的谱系,随后Weldon-Linne等通过电子显微镜证实了EHE细胞是有分化能力的内皮细胞,并通过免疫组化法发现了Ⅷ因子相关抗原,证实了其血管内皮来源。Weiss和Ezinge于1982年首次提出“上皮样血管内皮瘤”一词,并描述这种起源于血管内皮的肿瘤介于血管瘤和血管肉瘤的病理特征之间。2015年,世界卫生组织(WHO)肿瘤分类明确将EHE归类为具有潜在转移能力的低至中级别恶性血管肿瘤。
临床表现
EHE常见于软组织和内脏器官,常见部位依次为肝脏、肺、四肢、头颈、躯干和纵隔,其他如脾、淋巴结、腮腺、甲状腺、鼻咽等部位也可发生EHE。50%-76%的EHE患者无临床症状;通常情况下,皮肤软组织原发的EHE无明显的性别差异,而肺和肝脏原发的EHE以女性多见。EHE多表现为孤立、单发、大小不等质韧肿块,可伴疼痛肿胀。约25%的肝EHE患者无明显症状,部分患者可见非特异性症状,如体重减轻、发烧、疲劳等。
组织学及免疫组化特点
显微镜下,肿瘤细胞呈浸润性条索样或巢状排列,细胞质稍嗜酸性,部分细胞质内可见空泡(即原始形成的血管腔),是EHE的特征性表现;间质呈黏液样,可伴有囊变、出血、硬化和骨化;尽管一般并无细胞核的显著异型性,但部分病变中的肿瘤细胞可呈高级别形态或实性血管肉瘤样;YAP-TFE3基因融合亚型的患者多伴有形态明确的血管管腔结构,且细胞质更为丰富,呈亮嗜酸性、轻到中度的异型性。
免疫组化,肿瘤细胞表达血管内皮标记F8、ERG,CD34和CD31阳性率分别为94%和86%,CK阴性,Ki-67的增殖指数低。86%的病例CAMTA1有特异性表达,可与其他血管源性肿瘤鉴别。
分子遗传学改变
因其反复发生t(1;3)易位,遗传学上约90%病例可见特征性的WWTR1-CAMTA1基因融合。约10%的EHE患者存在YAP1-TFE3融合基因。
鉴别诊断
(1)上皮样血管瘤(epithelioid hemangioma,EH)
由增生的形态良好的上皮样血管伴数量不等的嗜酸性粒细胞和淋巴细胞组成,常呈小叶状分布,由胞质嗜伊红色的上皮样内皮细胞呈墓碑样衬覆血管腔,但是瘤细胞无YAP1-TFE3基因融合,1/3的EH出现FOS 重排,尤其在细胞性EH和骨内病变中更多见。
(2)假肌源性血管内皮瘤(pseudomyogenic hemangioendothelioma,PMHE)
胖梭形细胞呈片状和松散束状排列,并有大量嗜酸性胞质,部分核染色质呈空泡状,核分裂象罕见,纤维性间质内常伴有中性粒细胞浸润,部分病例间质可有黏液变性,可出现小灶坏死,肿瘤细胞CD34阴性,分子遗传学研究发现PMHE存在ACTB-FOSB融合基因,FOSB是诊断PMHE的一种高度敏感的标志物。
(3)上皮样血管肉瘤
通常表现出明显的细胞异型性、核多形性、活跃的核分裂活性,尤其是病理性核分裂,凝固性坏死,在血管分化不明显的情况下,出血背景和肿瘤内中性粒细胞是有价值的形态学特征。
(4)上皮样肉瘤(epithelioid sarcoma,ES)
多形性的上皮样细胞和梭形细胞均显示嗜酸性胞质,细胞核泡状增大,核仁突出,空泡细胞可能与 EHE的胞质内空泡相混淆,但CK(AE1/AE3)和EMA阳性,SMARCB1/INI1蛋白在ES中表达缺失具有特征性。
(5)转移性癌
常表现出更多的细胞异型性和核分裂活性,肿瘤细胞通常较强表达细胞角蛋白,而不表达内皮标志物。
治疗
对于单灶或局限性肿瘤,手术切除是首选方法。放疗对于术后切缘阳性且存在局部复发风险的EHE患者有一定疗效,推荐采用30次总剂量60 Gy的辅助放疗方案。对于无法手术的广泛进展期EHE,细胞毒性药物、靶向治疗药物和生物反应(免疫)调节剂等均有报道,但多为个案、小样本或回顾性分析。化疗药物的种类多样,卡铂、顺铂、长春新碱、紫杉类、吉西他滨、多柔比星、依托泊苷、丝裂霉素C、环磷酰胺、表柔比星等均有报道,最常用的仍是紫杉类、铂类药物,但总体疗效有限。靶向治疗药物分为抗血管生成药物、多靶点靶向药物两大类,其中抗血管生成药物贝伐珠单抗、重组人血管内皮抑制素,多与化疗药物联合应用,用于一线治疗后进展的EHE患者的治疗。
预后
EHE患者的预后差异较大,与部位、疾病阶段等多种因素关系密切。Sardaro总结了EHE患者预后不良的因素,包括男性、年龄≥55岁、肺部病变、多器官受累、疾病进展、胸膜侵犯和胸腔积液,合并严重呼吸系统症状(呼吸困难、咳嗽、胸痛、咯血和肺泡出血)、体重减轻和贫血患者的预后也更差;此外,组织学上,具有梭形瘤细胞、纤维蛋白性胸膜病变或胸膜外肿瘤细胞增生等表现出更差的预后。
参考文献
1. Wu X, Li BL, Zheng CJ, et al. Clinical characteristics of epithelioid hemangioendothelioma: a single- center retrospective study[J]. Eur J Med Res, 2019, 24(1): 16.
2. Dail DH, Liebow AA. Intravascular bronchioalveolar tumor[J]. Am J Pathol, 1975, 78(1): 25.
3. Corrin B, Manners B, Millard M, et al. Histogenesis of the so- called "intravascular bronchioloalveolar tumour"[J]. J Pathol, 1979, 128(3): 163-167.
4. Weldon-Linne CM, Victor TA, Christ ML, et al. Angiogenic nature of the "intravascular bronchioloalveolar tumor" of the lung: an electron microscopic study[J]. Arch Pathol Lab Med, 1981, 105(4): 174-179.
5. Weiss SW, Enzinger FM. Epithelioid hemangioendothelioma: a vascular tumor often mistaken for a carcinoma[J].Cancer, 1982, 50(5): 970-981.
6. Errani C, Zhang L, Sung YS, et al. A novel WWTR1-CAMTA1 gene fusion is a consistent abnormality in epithelioid hemangioendothelioma of different anatomic sites[J]. Genes Chromosomes Cancer, 2011, 50(8): 644-653.
7. Puls F,Niblett A,Clarke J,et al. YAP1-TFE3 epithelioid hemangioendothelioma: a case without vasoformation and a new transcript variant[J].Virchows Arch,2015,466( 4) : 473 -478.
8. Rosenbaum E,Jadeja B,Xu B,et al. Prognostic stratification of clinical and molecular epithelioid hemangioendothelioma subsets[J]. Mod Pathol,2020,33( 4) : 591-602.
9. Frezza AM, Ravi V, Lo Vullo S, et al. Systemic therapies in advanced epithelioid haemangioendothelioma: s retrospective international case series from the World Sarcoma
Network and a review of literature[J]. Cancer Med, 2021,10(8): 2645-2659.


















共0条评论