[导读] 编译:张波
摘要 伴有极向反转的乳头状肾肿瘤(Papillary renal neoplasm with reverse polarity,PRNRP)是最近提出的肾脏肿瘤。其预后明显好于乳头状肾细胞癌(papillary renal cell carcinoma,PRCC),且常伴有KRAS错义突变。本研究比较14例PRNRP和10例PRCC1型(PRCC1)和PRCC2型(PRCC2)临床病理、组织形态学、免疫组化和分子生物学特征。使用下一代测序(NGS)对6例PRNRP、3例PRCC1和4例PRCC2进行了全外显子组测序。对其余8例PRNRP患者采用聚合酶链式反应(PCR)测序法进行KRAS基因突变检测。结果显示,所有PRNRP病例均为pT1N0M0,无一例复发或肿瘤相关死亡。免疫组化结果显示,PRNRP中CK7、EMA、PAX8和GATA3呈弥漫性染色,而CD10、CD15和AMACR呈弱染色或阴性。在14例PRNRP患者中,NGS和PCR检测到11例KRAS错义突变,但在PRCC1和PRCC2中未检测到致病性KRAS突变。NGS分析显示PRNRP中的肿瘤突变负荷低于PRCC。PRNRP也未显示包括7号和17号特异性染色体拷贝数异常等。总之,本研究认为PRNRP是一个不同于PRCC的肿瘤实体。
1前言
乳头状肾细胞癌(PRCC)是肾细胞癌(RCC)的第二大常见表型。1997年,Delahunt和Eble首次将PRCC分为两大类,PRCC 1型(PRCC1)和PRCC 2型(PRCC2)。这一分类后来作了调整。PRCC1的特征是核级别低,嗜碱性或透明细胞质少,核不重叠。相比之下,PRCC2经常显示高级别细胞核呈假复层排列,并具有丰富的嗜酸性细胞质。这两种肿瘤显示出不同的免疫组织化学特征,并且每种肿瘤都具有特征性的染色体变异,例如,PRCC 1中7号和17号染色体拷贝数增加。2016年,癌症基因组图谱(TCGA)研究小组发现,PRCC1与MET突变相关,而PRCC2是具有各种遗传改变的异质性肿瘤类型,如CDKN2A沉默,SETD2突变,TFE3融合,NRF2eARE2通路组分表达增加和CpG岛甲基化。这项研究表明,这两种肿瘤在分子遗传学上表现是不同的。
偶然间,发现了具有介于PRCC 1和PRCC 2之间特征的某种类型的肾肿瘤。这些肿瘤细胞核低级别,胞浆丰富嗜酸性,细胞核单层线状排列于乳头表面,无假分层排列及核重叠。在多项研究中,该肿瘤被称为“嗜酸细胞样型PRCC”或“嗜酸细胞型PRCC”。在一些报告中,该肿瘤被描述为具有7号或17号染色体三体或Y染色体缺失。从这些结果来看,近20年来,“嗜酸细胞型PRCC”一直被认为是PRCC的一种变异实体。该肿瘤在WHO蓝皮书中也被称为“嗜酸细胞性PRCC”。2017年,Saleeb等人将PRCC细分为4型。其中,一个肿瘤亚群“PRCC,4型/嗜酸细胞低度变异体”显示出与嗜酸细胞型PRCC相似的形态学模式,并以特异性GATA 3免疫反应性为特征。
2019年,Al-Obaidy等人首次使用术语“伴有极向反转的乳头状肾肿瘤”(PRNRP),并提出应将其与PRCC 1和PRCC 2区分开来。他们将PRNRP描述为一种具有稀疏分支乳头或罕见的管状结构和嗜酸性肿瘤细胞,具有位于乳头表面顶部的低(ISUP)级细胞核,较少见泡沫状组织细胞簇和砂粒体。此外,同年,Al-Obaidy等报道PRNRP常见KRAS基因突变。随后,其他研究组基于该肿瘤极其惰性的生物学行为,改用“乳头状肾肿瘤”,而不是“乳头状肾细胞癌”。一些研究者也报道了KRAS基因频繁突变的遗传学分析。
尽管先后发表了一些关于PRNRP的论文,但由于PRNRP的罕见性,其许多特征仍不清楚。本研究利用全外显子组测序技术,从临床病理特征、组织形态学、免疫组化和分子生物学角度对PRNRP和PRCC 1/PRCC 2进行比较分析,并进一步展开对PRNRP的认识。
2材料与方法
2.1.患者和样本
从五家医院手术切除的肾癌标本中,共2820例福尔马林固定石蜡包埋标本,收集163例肾癌标本,检出14例PRNRP。同时选取PRCC1和PRCC2各10例典型病例作为对照组。PRCC1的定义是低核级别(ISUP/WHO核级别1或2),胞浆稀少嗜碱性,核不重叠。PRCC2的定义是高级别核(ISUP/WHO核2级或3级)和丰富的嗜酸性细胞质,核重叠。组织学回顾基于苏木精(HE)染色的光镜检查,以及三位病理学家独立盲法评估HE切片。
对患者的临床特征,包括有无透析,手术时的年龄,性别,病理TNM分期(第八版; T1 a-T 4,NX,N 0或N1,M0或M1),以及PRNRP的组织学特征进行了检查。
2.2.免疫组织化学分析
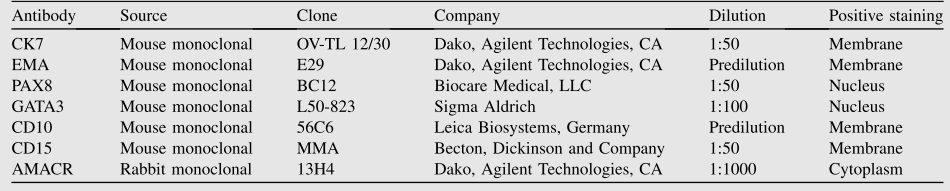
使用4 mm厚的FFPE肿瘤组织切片进行CK7、EMA、CD10、CD15、AMACR、PAX 8和GATA 3的免疫组织化学分析。除CD15染色外,切片均采用聚氧乙烯脱水山梨糖醇单月桂酸酯(CK7)、柠檬酸钠(EMA,CD10)、乙二胺四乙酸(AMACR)或抗原修复液(PAX8和GATA 3)进行预处理。一级单克隆抗体和这些染色模式列于表1中。结果根据肿瘤比例评分(TPS)确定,定义TPS >50%为阳性。
表1.关于一抗的详细信息
2.3.下一代测序和数据分析
对于PRNRP和PRCC之间的遗传比较,通过下一代测序(NGS)进行肿瘤和正常肾脏DNA的全外显子组测序。所选病例为6例PRNRP病例、3例PRCC 1病例和4例PRCC 2病例,所有病例均在2013年后进行了手术切除。根据制造商的说明书,使用固相可逆固定法(FormaPure DNA试剂盒; Beckman Coulter)从10 mm厚的石蜡包埋组织中分别提取来自肿瘤和正常肾的基因组DNA。使用FastQC 0.11.7版(Babraham Bioinformatics,UK)评价DNA的质量和数量,并使用Cell Innovator Inc.的Trimmomatic 0.38版进行修剪。使用SureSelect XT(Agilent Technologies)通过随机DNA片段化和扩增制备测序文库。富集的DNA在NovaSeq 6000(Illumina,Inc)上测序。委托Macrogen Inc进行文库构建和DNA测序。将序列数据与hgl 9/GRCh 37人参考基因组进行比对。Samtools 1.9和bcftools 1.9用于变体调用和读段映射。
通过去除从配对的正常肾组织中获得的突变数据,更准确地鉴定了体细胞单核苷酸变体(SNV)和小插入和缺失(indels)。选择包括错义和无义(终止获得)突变的非同义SNV以及可能影响基因剪接的SNV(剪接变体)。使用Ensembl变体效应预测器(VEP)91.0版注释这些体细胞改变。挑选VEP分类为“致病性”和“可能致病性”的突变,然后使用Integrative Genomics Viewer手动策划。
使用VarScan 2.3.8版计算每个病例的肿瘤突变负荷(TMB)。参考癌症体细胞突变目录数据库、常见dbSNP数据库、ExAC数据库和体细胞-种系/接合性算法,过滤出常见和种系变体。随后,确定具有肿瘤变体等位基因分数(VAF)> 20%、正常VAF<5%和体细胞P<0.07的高置信度变体的子集。此外,使用Revigo(http://revigo.irb.hr/)进行基因本体(GO)分析和使用CNVkit(https://www.example.com en/stable/)进行拷贝数改变(CNA)分析。由Cell Innovator Inc进行TMB计算、GO分析和CNA分析。
2.4.通过聚合酶链反应进行KRAS突变分析
通过聚合酶链反应(PCR)测序对其余未接受NGS的PRNRP病例进行KRAS突变分析。为此,与NGS相同地提取基因组DNA。使用以下引物检查KRAS外显子2的突变热点:正向5´-GGTACTGGTGGAGTATTTGATAG 3´和反向5´-CTGTATCGTCAAGGCACTCTTG-3´。PCR反应在热循环仪(Tgradient; Biometra,德国)中进行。然后,使用FastGene Gel/PCR Extraction Kit(Nippon Genetics Co,Japan)纯化扩增的PCR产物,并且还使用ABI 3500 xl遗传分析仪(Applied Biosystems,Foster City,CA)通过直接测序进行评价。使用FinchTV 1.4.0分析测序结果。
2.5.统计分析
使用JMP统计发现软件(版本14.0; SAS,Cary,NC)进行统计分析。采用Wilcoxon检验对PRNRP和PRCC之间的差异进行比较。显著性定义为P < 0.05。使用KaplaneMeier方法通过使用Wilcoxon检验比较KaplaneMeier曲线来分析总生存期(OS)。OS定义为从手术至末次随访或因原发性肾肿瘤死亡的时间。
3结果
3.1.临床病理特征
14例PRNRP病例(病例1-14)的临床特征见表2。在14例病例中,有3例进行了血液透析。患者中位年龄为68.1岁(范围:47 e82); 6例患者(42.9%)为男性,8例患者(57.1%)为女性。所有病例均无临床症状,均为影像学检查偶然发现。肿瘤大小为1.0 ~ 5.0 cm,根据第八版TNM分期系统,除1例外,所有肿瘤均为pT 1aN 0 M0(仅例8为pT 1bN 0 M0)。
术后随访期间,PRNRP病例无复发、转移或肿瘤相关死亡。
PRNRP的组织形态学特征总结于表2中,并显示于图1AeF中。如前所述,所有病例均表现为乳头状结构为主(图1A),并有丰富的嗜酸性细胞质和圆形级别低的空泡状核,核仁不明显(图1B)。肿瘤细胞位于乳头表面,单层排列(图1B)。在两个病例中(病例5和7),肿瘤细胞局灶性地具有透明的胞浆(图1C)。在9个肿瘤中偶见纤维血管轴心的间质水肿(图1D)。在3例病例中,间质中有少量泡沫状组织细胞(图1E)。10例肿瘤有纤维包膜(图1F),但无包膜外侵犯。14例肿瘤均无砂粒体、微血管浸润或肿瘤坏死。PRNRP的这些病理学特征不类似于典型的PRCC1(图1G)或PRCC2(图1H)。
表2伴有极向反转的乳头状肾肿瘤临床病理总结
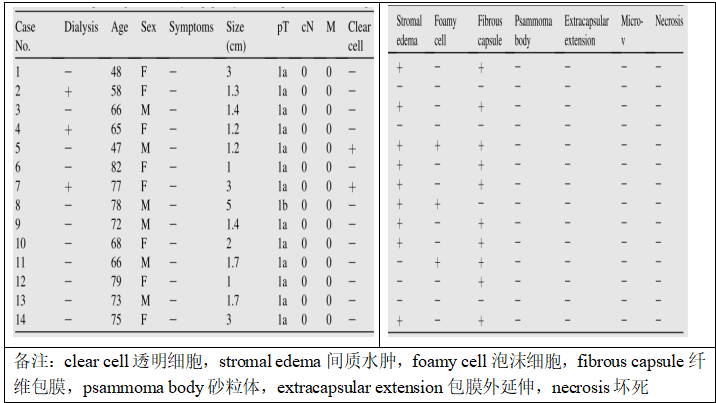
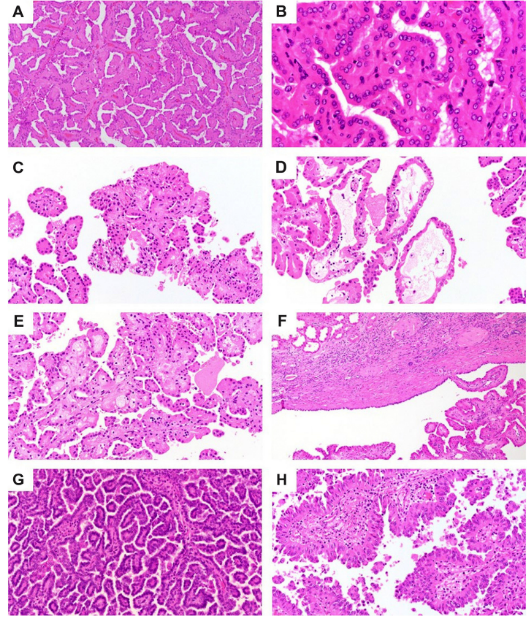
图1 PRNRP和PRCC的组织学特征。PRNRP显示主要为乳头状结构(A),并具有丰富的嗜酸性细胞质和圆形低级别空泡状核,核仁不明显,位于乳头的表面,无核假复层(B)。PRNRP局灶性含有透明细胞质(C)。纤维血管轴心偶见间质水肿(D)。在基质中观察到少量泡沫状组织细胞(E)。PRNRP有纤维包膜,但无包膜外延伸(F)。PRCC 1的特征是低核级别、嗜碱性细胞质和不重叠的核(G)。PRCC2的特征在于高级别细胞核的假复层和丰富的嗜酸性细胞质(H)。
表3伴有极向反转的乳头状肾肿瘤的免疫组化和KRAS突变分析结果
3.2.免疫组化结果
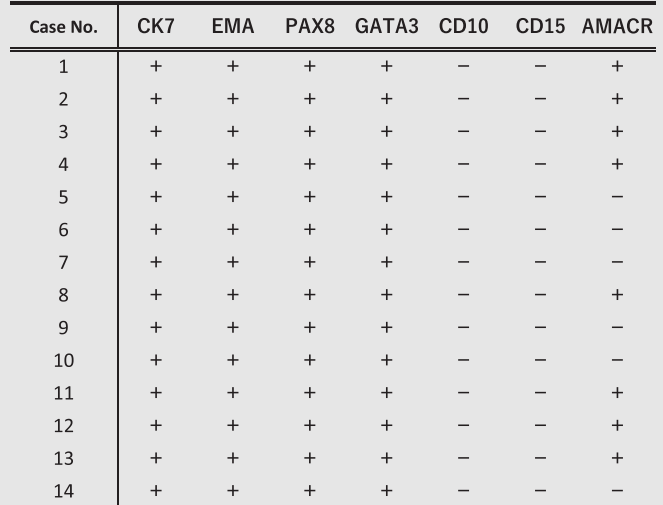
PRNRP的免疫组织化学结果总结见表3和图2A-D。所有肿瘤均表现出CK 7(图2A)、EMA和PAX 8的弥漫性和强染色。GATA 3显示弥漫性和中度至强染色(图2B)。相比之下,14例中的13例完全为CD 10阴性,第14例显示局灶性CD 10染色(病例6;图2C)。CD 15始终为阴性。14例中的8例显示弥漫性AMACR染色,尽管肿瘤细胞的强度弱于非肿瘤区域的肾小管(图2D)。
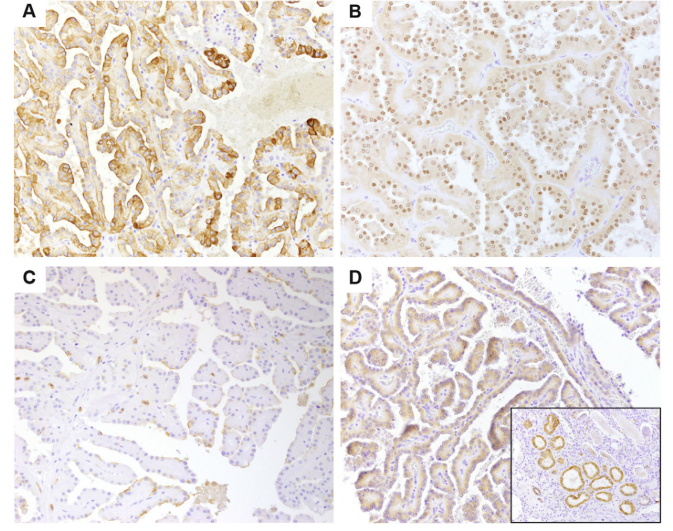
图2 PRNRP的免疫组化图谱。肿瘤细胞对CK7(A)和GATA 3(B)呈弥漫性阳性,但对CD 10(C)呈阴性或局灶性阳性。与正常肾小管(D,插图)相比,AMACR显示弱反应(D)。
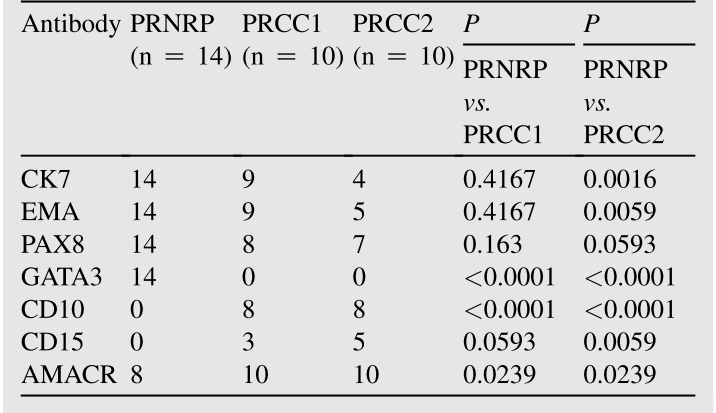
PRNRP和PRCC 1/PRCC 2之间的比较总结在表4中。PRNRP和PRCC 2之间CK 7、EMA和CD 15存在显著差异。此外,在PRNRP和PRCC 1之间以及PRNRP和PRCC 2之间观察到GATA 3、CD 10和AMACR的显著差异。
表4伴有极向反转的乳头状肾肿瘤(PRNRP)与乳头状肾细胞癌(PRCC)的免疫组化特征比较。
3.3.PRNRP与PRCC遗传分析比较
通过全外显子组测序检测的致病基因突变如图3所示。NGS发现6例PRNRP中有4例存在KRAS错义突变。下面列出了详细的KRAS突变类型。在PRNRP中发现的其他突变包括BRIP1无义突变(c.2392C > T,p.Arg798Ter)、RAD 50无义突变(c.3229C > T,p.Arg1077Ter)和BRCA 2无义突变(c.2677C > T,p.Gln893Ter)。PRCC 1中1例发生MET错义突变(c.3334C > T,p.His1112Tyr)。PRCC 2中1例存在NF 2无义突变(c.169C > T,p.Arg57Ter),2例存在SET D2无义突变(c.4792C > T,p.Arg1598Ter和c.4774C > T,p.Arg1592Ter)。此外,PRNRP和PRCC 1/PRCC 2没有共同的基因改变。
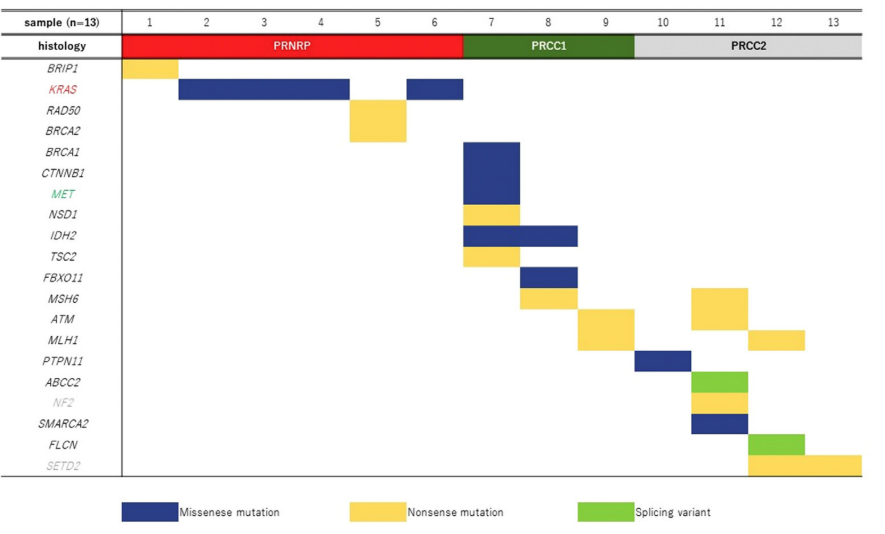
图3 6例PRNRP、3例PRCC1和4例PRCC2病例的下一代测序结果。在6例PRNRP病例中的4例中检测到KRAS错义突变,而在PRCC1和PRCC2中没有KRAS突变。
PRNRP中富集的术语与O-聚糖加工、化学刺激的检测、蛋白定位、钙依赖性细胞粘附和单次受精相关。PRCC 1和PRCC 2中也观察到前两组,但每个肿瘤中的个体富集项不同。
3.4.PRNRP和PRCC之间的TMB分析
计算每个肿瘤的TMB。在PRNRP中,每兆碱基对(/MB)的突变范围为1.7至30.7(平均值:6.9)。在6例病例中的5例中,TMB小于3.3个突变/MB(范围1.7-3.3),而缺乏KRAS突变的第6例病例(病例13)具有30.7个突变/MB。PRNRP的TMB显著低于PRCC 1(26.5-204.2,平均值:101.7个突变/MB)和PRCC 2(6.2-150.3,平均值:64.2个/MB;图4)。
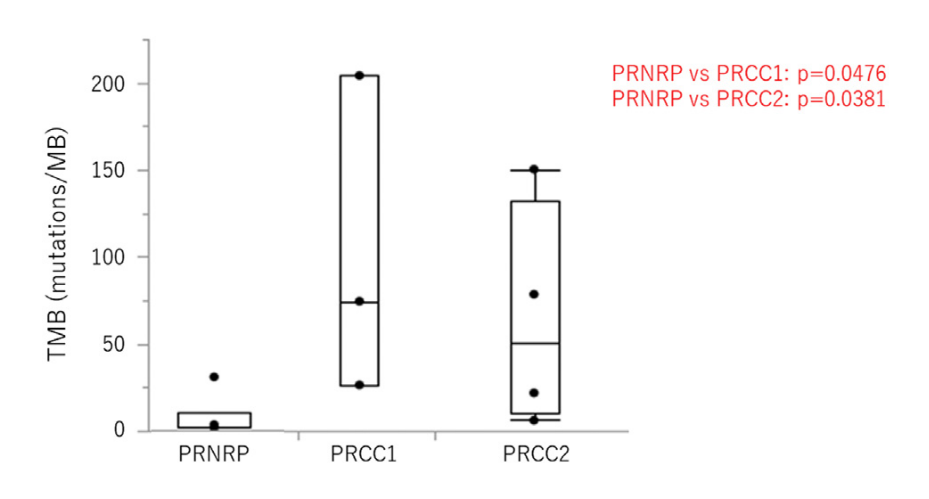
图4 PRNRP和PRCC之间的TMB比较。PRNRP的TMB显著低于PRCC1和PRCC2。
3.5.在PRNRP、PRCC 1和PRCC 2组中检测到的全基因组CNAs
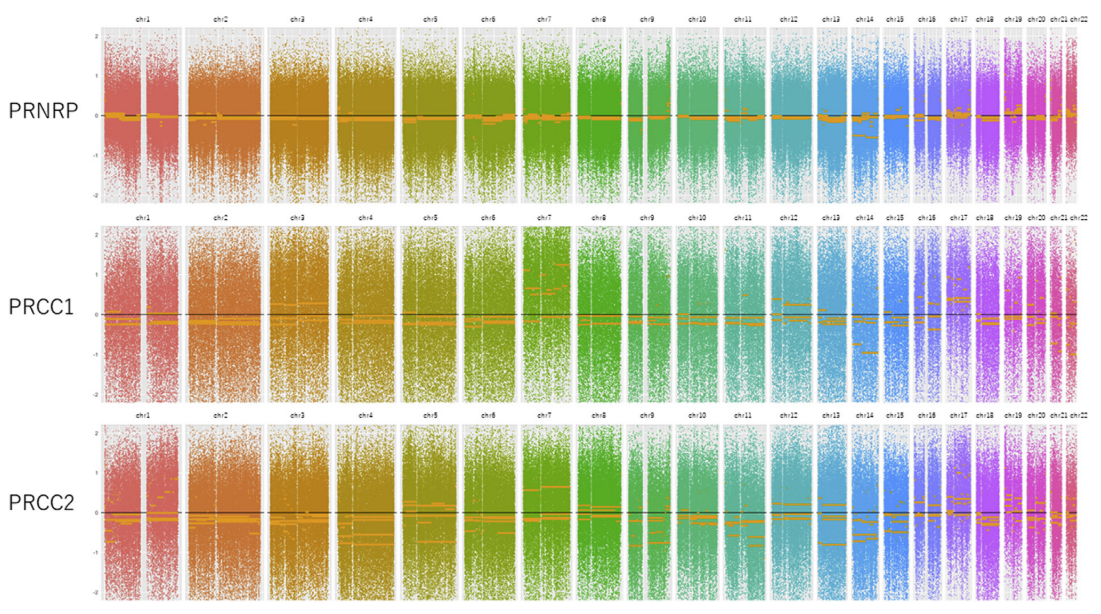
图5拷贝数改变的全基因组视图。所有染色体都是彩色编码的,轨迹由点组成,这些点是计算的拷贝数。PRNRP与PRCC1和PRCC2相比显示出一致的模式,并且缺乏特异性染色体异常,包括7号和17号染色体的获得。
图5中描述了每个肿瘤组(PRNRP、PRCC 1和PRCC 2)中的染色体CNAs。与PRCC1和PRCC2相比,PRNRP病例的6个样本显示出一致的模式。1例仅14号染色体丢失,其他PRNRP病例均未见明显染色体异常,包括7号和17号染色体的获得。在PRCC 1和PRCC 2中,7号和17号染色体的获得和14号染色体的丢失更为常见。PRCC 2例中4、5q、9、13、15号染色体局部缺失。
3.6.PRNRP中KRAS基因突变的评估
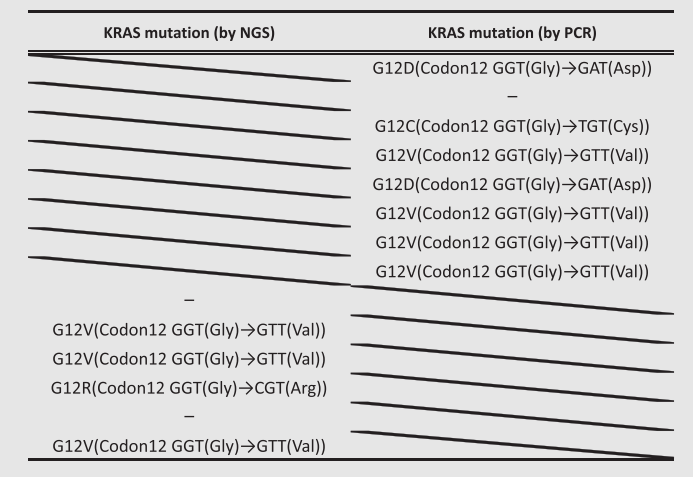
通过NGS检测的KRAS基因突变描述于图6中。其中3个涉及c.35G > T(p.Gly12Val和G12 V),另一个涉及c.34G > C(p.Gly12Arg和G12 R)。通过PCR测序分析的8例PRNRP病例中,有7例也检测到KRAS基因突变。这些KRAS突变类型为G12 V(4例)、G12 D(2例)和G12 C(1例;图7)。14例病例中共有11例(78.6%)含有KRAS外显子2错义突变(表3)。

图6在四个PRNRP病例中鉴定的KRAS错义突变的Integrative Genomics Viewer快照。3例显示p.Gly12Val(G12V),1例显示p.Gly12Arg(G12R)。
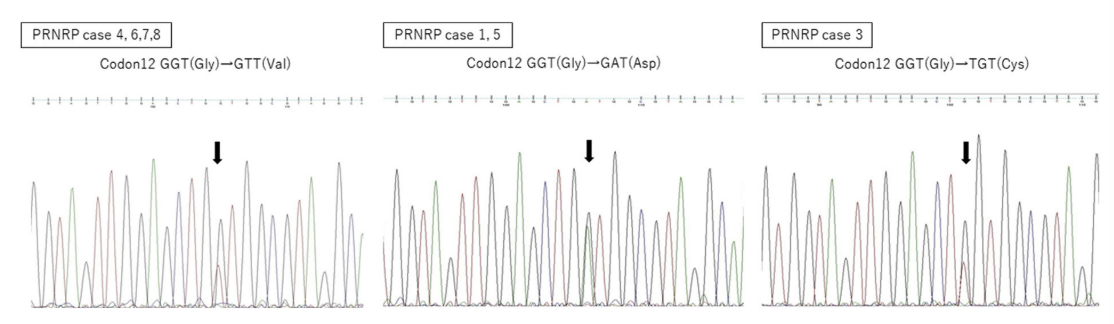
图7 PRNRP中KRAS热点突变的PCR测序。G12 V(4例)、G12 D(2例)和G12 C(1例)。
4.讨论
Al-Obaidy等人首次使用“伴有极向反转的乳头状肾肿瘤”这一术语,在此之前这类肿瘤被描述为所谓的“嗜酸细胞型肾细胞癌”各种文章相继发表。在这些文章中,“嗜酸细胞型PRCC”被报道表现出广泛的形态、免疫组织化学特征和预后差异。例如,许多“嗜酸细胞型PRCC”的预后良好,而少数侵袭性病例,如伴有肉瘤样变和脑或骨转移的病例也有报道。然而,本研究回顾了这些文章,同时考虑到PRNRP及其模拟物的形态特征,并注意到这些文章中显示的几种肿瘤似乎不是纯粹的PRNRP,而是它的模拟物。在本研究中成功地排除了这些模拟物,并可以识别PRNRP的纯病例。
在163例肾乳头状肿瘤中发现14例PRNRP(8.6%)。在最近的文献中,已经报道了大约80例PRNRP病例,这表明PRNRP的罕见性。所有病例均为低TNM分期,随访结果显示预后良好,无复发、转移及肿瘤相关死亡。组织学上,PRNRP表现出统一的形态学模式,细胞学或结构多态性不明显。
PRNRP很少与泡沫状组织细胞和砂粒体相关,而通常在PRCC1和PRCC2中可观察到。许多PRNRP病例有纤维包膜,没有组织学发现提示具有高度恶性肿瘤的特征,如包膜外延伸、显微镜下血管浸润或肿瘤坏死。虽然嗜酸性细胞质的存在在组织学上与PRCC 2相似,但基于核特征,PRNRP被认为是低级别肿瘤,并提供了临床随访数据。根据这些结果和过去的文献,我们支持将该肿瘤命名为“乳头状肾肿瘤”而不是“乳头状肾细胞癌”。然而,由于随访时间有限,不能完全排除该肿瘤为低度恶性肿瘤的可能性。
免疫组织化学分析显示,所有PRNRP病例均有CK7、EMA和GATA3的弥漫性表达,而CD10、CD15和AMACR表达较少或弱于PRCC1和PRCC2。在以前的报道中,除了CK7、EMA和GATA3外,PRNRP还显示出弥漫性的LCAM表达。Tong等人的研究成果显示在远曲小管中发现了CK7、EMA、GATA3和L1CAM的染色,并推测PRNRP可能起源于远曲小管。作为近曲小管的标记物CD10、CD15和AMACR的阴性或局灶性表达,也支持这一假设。
NGS和PCR测序结果显示PRNRP中KRAS错义突变频率较高(11/14,78.6%),G12 V(7/11,63.6%)、G12 D(2/11,18.1%)、G12 C(1/11,9%)和G12 R(1/11,9%)。在先前的研究中,PRNRP病例中观察到热点密码子12处这四种KRAS突变,发生率为80%至90% 。相反,KRAS突变在RCC中很少检测到。只有Raspollini等人记录了一例具有KRAS突变的RCC病例。一些先前的研究报道透明细胞RCC、PRCC和嫌色细胞RCC缺乏KRAS突变。在TCGA数据集中,5个具有KRAS突变的肿瘤被登记为PRCC。Al-Obaidy等人,Kim等人,和Tong等独立地回顾了这些肿瘤,并得出结论,其中两个或三个肿瘤非常类似PRNRP。
PRNRP的TMB显著低于PRCC 1和PRCC 2。6例PRNRP中5例TMB<3.3/MB,而6例KRAS突变缺失者TMB<30.7/MB。在前面提到的TCGA分析中,三个疑似PRNRP并具有KRAS突变的肿瘤中的TMB也很低(≤20突变)。提示KRAS突变是PRNRP的主要基因之一。
PRNRP中观察到的其他体细胞突变如BRIP 1、RAD 50和BRCA 2中所有病例均未发现KRAS突变。这些基因在DNA修复中发挥重要作用,其中的种系突变与家族性卵巢癌和乳腺癌有关。Al-Obaidy等人还在两例PRNRP病例中发现了BRCA 2突变和基因重复。然而,考虑到PRNRP的TMB低,这些DNA修复基因的突变是否会导致肿瘤的发生是值得怀疑的。在PRNRP中未检测到在PRCC1或PRCC2中观察到的突变,包括MET、NF2和SETD2中的突变。GO富集分析也揭示了PRNRP和PRCC1/2的遗传差异。
PRNRP还表现出与PRCC 1和PRCC 2一致不同的染色体模式,这也支持PRNRP和PRCC之间的遗传差异。7号和17号染色体的获得被认为与PRNRP有关,但在这项研究中无法检测到这些特定的染色体异常。在过去的研究中,通过荧光原位杂交(FISH)观察到PRNRP中的7号和17号染色体三体。另一方面,在终末期肾病的非肿瘤性肾小管上皮中检测到这些染色体获得,并且以往的FISH分析可能不能反映肿瘤细胞中的真实CNAs。在1例PRNRP病例和一些PRCC病例中观察到的14号染色体缺失也可以在其他肾脏肿瘤中发现,例如透明细胞RCC、集合管癌或肾嗜酸细胞瘤。在透明细胞肾细胞癌中,14号染色体q缺失通过缺氧诱导因子1a信使RNA和蛋白质的减少与不良临床结局相关;然而,14号染色体缺失在其他肾肿瘤中的预后影响仍然未知。
PRNRP的生物学行为也可能与肾乳头状腺瘤不同。在形态学上,乳头状腺瘤的肿瘤细胞缺乏嗜碱性细胞质和低级别细胞核,免疫组化强烈表达AMACR ,这些特征类似于PRCC1而不是PRNRP。乳头状腺瘤的染色体畸变的特征是7号和17号染色体的三体性以及Y染色体的缺失,这在PRCC 1中可观察到。基于这些事实,乳头状腺瘤被认为是PRCC的前驱病变。与此相反,乳头状腺瘤中GATA 3表达或KRAS基因突变尚未得到全面研究,PRNRP与乳头状腺瘤的关系有待于进一步分析。
总之,PRNRP的特点是单一的形态模式。在免疫组化分析中,PRNRP显示远曲小管标记物而非近曲小管标记物的弥漫性表达。PRNRP与PRCC的区别在于KRAS突变频繁、TMB低和缺乏特异性染色体异常。根据这些结果,PRNRP应被分类为肾肿瘤的一个独特的子集,并被认为是不同于特别高级别的PRCC2。如果将来检测到进一步的证据,PRNRP可能会成为一个具有良性行为的独特实体。
点此下载原文献

























共0条评论