[导读] 编译:张波
摘要 B细胞发育轨迹由复杂遗传程序控制,并受多种转录因子严格调控。干扰素调节因子4(IRF4)调节从前B细胞发育和受体编辑到生殖中心形成、类别转换重组和浆细胞分化的关键点。IRF4的多效性能力由其“动力学控制”介导,由于IRF4 DNA结合亲和力的调节而激活不同的遗传程序允许不同的IRF4表达水平。IRF4与B细胞恶性肿瘤有关,在不同类型的前体和成熟B细胞瘤形成中既作为肿瘤抑制因子又作为肿瘤致癌基因。在此,本研究总结了IRF4功能的复杂性,涉及不同的DNA结合亲和力,多个IRF4特异性靶DNA基序,和与转录伙伴的相互作用。此外,还描述了IRF4在急性白血病和成熟性B细胞淋巴瘤形成中的独特作用,重点关注多发性骨髓瘤和慢性淋巴细胞白血病的发病机制和可能的治疗策略。
前言
IRF4是干扰素调节因子(IRF)家族转录因子中的一员,也称为Pip、LSIRF、ICSAT和MUM 1。它是位于6p25.3基因座的19.7-Kb基因。IRF家族成员(IRF 1至IRF 9)的特征在于由柔性接头连接的两个保守功能域:具有独特色氨酸五元组重复的N-末端螺旋-转角-螺旋DNA结合域(DBD)和在介导蛋白质-蛋白质相互作用中至关重要的C-末端干扰素活化域(IAD)。IRF4的DNA结合活性依赖于与多个配偶体形成同源或异源二聚体,从而增加DNA亲和力。与其他IRF蛋白不同,IRF4由于自身抑制构象而以低亲和力结合DNA,并且需要不同的配偶体来解除抑制机制并识别含有Ets-IRF复合元件(EICE)或AP 1-IRF共有元件的DNA序列。然而,在高浓度时,IRF4可能通过同源二聚化作用调节含有ISRE位点的基因,这种特性对浆细胞分化至关重要。
IRF4表达于免疫系统的细胞中,包括淋巴细胞、树突状细胞和巨噬细胞,在这些细胞中它可以调节多种功能,如增殖、凋亡和分化。IRF4是控制B细胞发育的几个阶段的必需因子,包括前B细胞发育、受体编辑、生发中心(GC)形成、类别转换重组(CSR)和浆细胞(PC)分化。IRF4生殖系缺失的小鼠在从未成熟到成熟B细胞的转变中显示出分化停滞,因此不能产生生殖中心B细胞和浆细胞的后代。IRF4缺陷小鼠表现出免疫球蛋白产生和抗体应答的损害。此外,据报道,T细胞的细胞毒性和抗肿瘤应答在IRF4缺陷的小鼠中受到影响。
调节功能的异质性是由于与包括PU1、E47、IRF8和STAT6在内的几种辅因子的交替相互作用以及在B细胞发育和成熟过程中的分级表达。在B细胞群中,IRF4具有在早期B细胞发育期间和在抗原结合后的生发中心反应期间在成熟B细胞中起作用的双相功能。IRF4控制免疫球蛋白基因座的顺序重排以产生功能性B细胞受体(BCR),该受体抑制前B细胞增殖并影响前B细胞在骨髓龛内的定位。此外,在整个生发中心形成和亲和力成熟的调节过程中,IRF4参与了信号的混合网络,所述信号在抗原与细胞凋亡或浆细胞分化结合时限决定成熟B细胞的细胞命运。
本综述总结了近年来关于IRF4在早期B细胞发育和成熟B细胞中的多效性功能的研究进展。然后,本文阐述了IRF4在急性白血病和成熟B细胞淋巴瘤中的独特作用,重点阐述了其在多发性骨髓瘤(MM)和慢性淋巴细胞白血病(CLL)中的生物学机制和可能的治疗策略。基于核酸的治疗方法,包括反义寡核苷酸(ASO),是有前途的治疗策略,提供了靶向转录因子(如IRF4)的潜力,这些转录因子已被证明是替代药物难以实现的。
IRF4与IRF8以冗余方式控制早期B细胞发育
在发育过程中,B细胞参与免疫球蛋白基因座的顺序重排。H链基因座在pro-B期重排,而L链基因座在pre-B期重排。在产生生产性重(H)链后,其与替代轻(L)链VpreB相互作用,在细胞表面上形成pre-BCR。pre-B细胞首先经历以高增殖率为特征的克隆扩增期,接着是静止期,在静止期细胞阻止其增殖并进行L链重排,从而产生IgM + B细胞。BCR随后在未成熟的B细胞表面表达,自身反应性细胞通过中枢耐受机制被淘汰。
IRF4参与早期B细胞发育。IRF4作用于pre-B细胞的两个关键阶段,负调节pre-B细胞扩增并促进L链重排和转录,直接与IG κ(k)和λ增强子结合。IRF4最初被发现是免疫球蛋白k轻链增强子中Ets转录因子PU.1的伴侣。IRF家族成员IRF 8也与PU. 1相互作用,并在早期B细胞发育中与IRF4冗余地起作用。IRF4和IRF8相互作用与IRF DNA结合位点的结合较弱,但通过与EICE家族相关的其他转录因子PU.1和Spi. B相互作用被募集到EICE。这些异源二聚体复合物涉及IG L链转录的控制。在缺乏IRF4和IRF 8的情况下,B细胞发育在pre-B细胞增殖阶段被阻止,不能下调pre-BCR。IRF4和IRF 8通过下调替代轻链基因的表达并同时促进常规轻链重排和转录来调节循环pre-B细胞和未成熟B细胞之间的转换。IRF4还与转录因子FOXO 1合作,重新激活对IgL链重组至关重要的Rag基因表达。
IRF4与其配偶体IRF 8一起通过诱导转录因子IKAROS和AIOLOS的表达来负控制pre-B细胞增殖。这些因子下调MYC,同时促进细胞周期抑制剂p27 KIP的表达。此外,IRF4通过限制IL-7受体信号传导来减弱pre-B细胞扩增。IRF4增加趋化因子受体CXCR 4的表达,促进循环pre-B细胞迁移至具有低水平IL-7的骨髓龛,以降低增殖信号。IL-7信号传导通过直接抑制轻链重排来抵消pre-B细胞分化。因此,pre-B细胞对具有低水平IL-7的骨髓龛的趋化性将与抑制其扩增和启动生产性轻链重排相关。IRF4-CXCR 4前馈环将参与B细胞迁移到富含CXCL 12的BM骨髓龛中,降低B细胞增殖MYC和STAT 5的介导物的表达,同时诱导IRF4表达和轻链重排。此外,IRF4在诱导pre-B细胞标志物CD 25、限制IL-7反应性和促进向CXCR 4迁移方面具有独特作用。
IRF4缺乏导致急性白血病转化
鉴于其作为限制pre-B细胞扩增和促进pre-B细胞分化的关键转录因子的作用,IRF4作为针对pre-B细胞转化的肿瘤抑制因子发挥作用。IRF4在某些骨髓和早期淋巴B细胞恶性肿瘤中以低水平表达。然而,IRF4 −/−小鼠不会产生pre-B急性淋巴细胞白血病(ALL),但IRF4缺陷会与BCR-ABL和MYC等癌基因合作促进小鼠模型中的白血病发生。特别是,IRF4缺陷加速小鼠BCR-ABL阳性B-ALL的进展,其强制上调抑制体外和体内转化,负调节细胞周期进展。在BCR-ABL酪氨酸激酶抑制剂治疗期间IRF4上调胚细胞中BCR-ABL癌基因转化。相应地,微阵列分析显示,在B-ALL患者中IRF4 mRNA水平较低。此外,MYC诱导的白血病在IRF4 ±缺陷小鼠中大大加速,表现出过度增殖的大细胞白血病pre-B细胞对凋亡的抗性。IRF4的缺失加速了抑制细胞周期进程的p27 KIP的丢失。
IRF4/IRF 8双缺陷小鼠在早期发生侵袭性慢性髓细胞性白血病样疾病,伴有粒细胞-单核细胞祖细胞扩增。然后,所有小鼠均死于B淋巴母细胞白血病/淋巴瘤。从pre-B细胞向未成熟B细胞转变的部分阻断是PU.1/IRF4缺陷小鼠的特征。值得注意的是,所有PU.1/IRF4和约50%的PU.1/IRF 8双缺陷小鼠均发生了pre-B ALL并伴有肿瘤抑制基因IKAROS、Blnk和Spi-B的表达降低。IKAROS和Spi-B表达的恢复可降低白血病细胞生长。最近,Das Gupta及其同事描述了随着年龄的增长,IRF4 −/−小鼠自发出现pre-B白血病,显示克隆的preB-I单核细胞浸润骨髓,肺和肝脏。在健康的IRF4 −/−小鼠中已经检测到扩大的pre-B细胞区室,这是由于对IL-7的无限制增殖,表明存在易受永生化影响的前白血病群体。由于白血病前期细胞的不受控制的生长和活化诱导的脱氨酶(AID)诱导,在某些情况下可能会出现第二个获得性遗传改变,以促进白血病发展。研究发现IL 7 JAK-STAT信号传导被JAK 1和JAK 3基因中的突变改变。此外,oncomir microRNA-125 B b在包括急性髓性白血病(AML)和B-ALL几种类型的白血病中上调并抑制IRF4表达,同时诱导造血祖细胞以及骨髓和B细胞肿瘤的发生。
IRF4参与浆细胞分化
在抗原接合后,活化的成熟B细胞产生GC,其中经历PC的亲和力成熟、同种型转换和终末分化。GC是在次级淋巴组织内产生的瞬时滤泡结构,以在抗原接合时产生T细胞依赖性B细胞活化。一个复杂的信号通路网络混合在一起,控制GC内部的关键过程。IRF4和IRF8是已知以非冗余方式控制GC形成、CSR、体细胞超突变(SHM)和浆细胞分化的因子。GC B细胞的产生和浆细胞的发育和分化是由BCL 6和BLIMP 1的相互负反馈调节的基因表达的交替程序协调的过程。PC分化主要受锌指转录因子BLIMP1调节,并由内质网的巨大扩张和蛋白质合成增加组成。此外,BLIMP1通过降低BCL 6和AID表达减少GC程序,并抑制PAX5的表达,导致XBP1的去抑制,其可诱导许多编码分泌器的正确功能所必需的伴侣蛋白和酶的基因转录。此外,BLIMP1可调节重链前mRNA的加工机制以产生编码分泌的免疫球蛋白的转录物。
IRF4诱导BCL 6的表达,是启动GC所必需的,但不是维持GC所必需的。此外,IRF4是浆细胞产生所必需的,与转录抑制子BLIMP 1以协调方式作用,位于XBP 1上游(图1)。在生殖中心B细胞中条件性缺失IRF4的转基因小鼠不形成生殖后中心浆细胞。此外,IRF4缺陷型B细胞AID表达降低,并显示CSR受损。事实上,用CD 40和IL 4刺激诱导CSR的IRF4 −/−细胞由于AID表达水平低而不产生IgG 1+细胞。
然而,B细胞中IRF4浓度的波动是替代命运产生的基础,也称为“动力学控制模型”(图2)。根据该模型,BCR刺激后IRF4表达的速率调节AID表达的持续时间,导致CSR和SHM。无论IRF4在B细胞中的积累是否超过临界阈值,它都可以激活Prdm 1基因(编码BLIMP 1)促进浆细胞分化。增加的抗原亲和力可增强BCR介导的IRF4表达。高IRF4浓度,允许同源二聚化,导致DNA结合在干扰素序列反应基序(ISRE)丰富的基因参与PC分化。
CSR和PC分化的机制通过IRF4控制Aicda和Prdm 1基因(分别编码AID和BLIMP 1)表达的能力严格协调。IRF4以分级方式表达,较高浓度的IRF4诱导BLIMP 1表达和B细胞从GC程序向浆细胞的转变,而较低水平的IRF4通过诱导AID表达激活同种型转换/CSR和SHM 。全基因组分析表明,IRF4调节整个BLIMP 1依赖的浆细胞程序,并通过诱导AID参与同种型转换过程。IRF4以逐步的方式起作用,可以调节两种拮抗剂发育状态。当B细胞被LPS-或CD 40/IL 4刺激以促进B细胞活化时,IRF4表达在几次细胞分裂中被快速诱导,但是仅仅IRF4高表达亚群的出现与浆细胞程序相关。
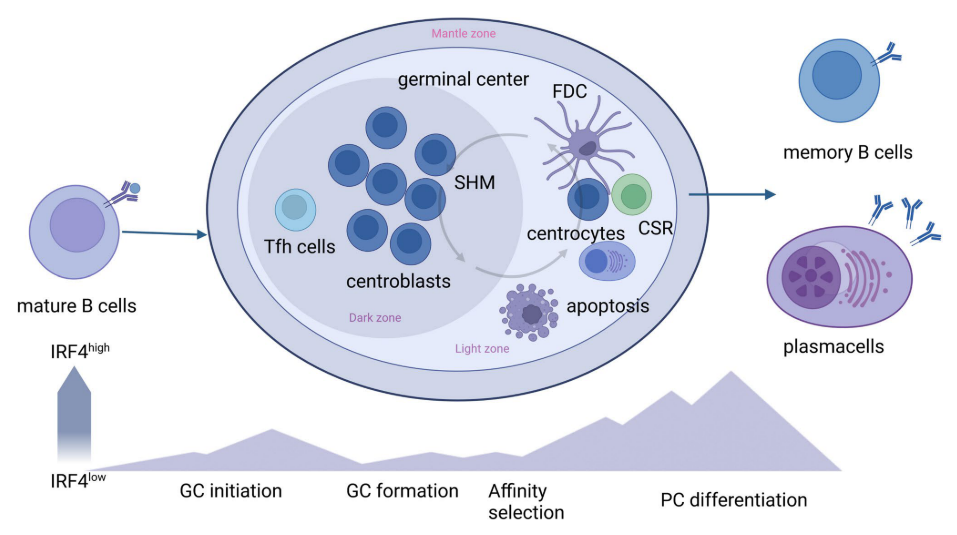
图1 IRF4在成熟B细胞中的分级表达。在抗原接合后,成熟的B细胞启动生发中心反应,其中增殖的中心母细胞由高表达水平的BCL 6、PAX 5和AID但低表达水平的IRF4调节。降低的IRF4水平也有利于通过调节CXCR 4表达将循环B细胞定位在暗区中。在抗原亲和力成熟后,IRF4水平逐渐增加,有利于类别转换重组(CSR)、B细胞向亮区的动员和浆细胞(PC)分化。高IRF4水平通过降低BCL 6和诱导BLIMP 1和XBP 1来激活PC转录程序。缩略语:SHM,体细胞超突变; CSR,类别转换重组; FDC,滤泡树突状细胞; PC,浆细胞; GC,生发中心; Tfh:滤泡辅助性T细胞。
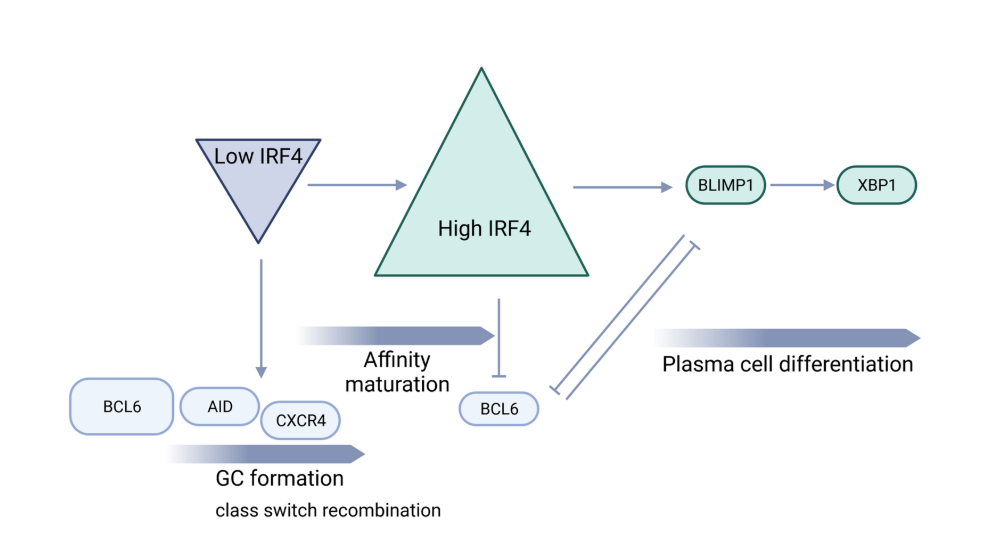
图2 IRF4“动力学控制模型”。生发中心内IRF4浓度的波动控制着生发中心反应与浆细胞分化的特定遗传程序的建立。低IRF4水平允许维持BCL 6、PAX 5、AID和CXCR 4的高表达,从而允许GC形成和类别转换重组。在亲和力成熟后,循环B细胞增加IRF4表达高于“开-关阈值”,这反过来诱导BCL 6下调以及BLIMP 1过表达,从而促进浆细胞分化。缩略语:GC,生发中心。
IRF4表达增加:多发性骨髓瘤和弥漫性大B细胞淋巴瘤对IRF4调节的遗传程序依赖
IRF4在MM细胞中高度表达,通常是激活突变或易位的结果。IRF4 mRNA表达是生存不良的独立风险因素,特别是在没有13 q缺失的病例中。约20%的病例具有染色体易位t(6;14)(p25;q32),其使免疫球蛋白重链基因座与IRF4并置。此外,在MM细胞中报告了IRF4基因DNA结合结构域的突变,特别是在复发性“热点”L116 R和K123 R中。然而,大多数MM在IRF4基因座中没有遗传病变,但仍然存在较多IRF4调节的异常遗传程序。据报道,通过运用功能丧失、基于RNA干扰的遗传筛选,IRF4抑制会干扰几种骨髓瘤细胞系的存活。MM细胞中的IRF4调节网络包括在健康浆细胞中静止的超过100个基因的上调,产生与抗原刺激的B细胞遗传程序更接近的异常转录谱。直接IRF4靶MYC、SCD、SQLE、CCNC和CDK 6在正常浆细胞中不高度表达,但在成熟B细胞中在抗原受体信号传导激活时被诱导。在MM细胞中由IRF4调节的多效性程序还包括影响代谢控制、膜生物发生、细胞周期进展和浆细胞分化基因。
IRF4一个值得注意的靶基因是MYC。IRF4与MYC启动子区结合诱导其表达。当MYC通过与其内含子区域相互作用上调IRF4时,产生了正向自动调节反馈回路。MM浆细胞中的MYC表达是不寻常的,正常浆细胞由于BLIMP 1的抑制而不表达MYC。据报道,BLIMP 1的另一种形式称为BLIMP 1 β,在MM细胞系中过表达。BLIMP 1 β是缺少前101个氨基末端残基的截短形式,显示抑制MYC的能力降低。BLIMP 1截短形式的表达可以解释BLIMP 1不能抑制MM细胞中的MYC。因此,MYC过表达促进B细胞活化并维持MM存活。此外,miR 125 b-5 p的强制表达促进IRF4下调及其下游效应物的损害,从而降低原代MM细胞和MM细胞系的生长。通过CRISP-Cas9介导缺失导致的IRF4缺失影响MM活力和增殖。此外,IRF4调节与细胞存活有关的基因(KLF2、BCMA、MYB和MYC)在IRF4缺失后下调,而促凋亡因子BCL 2修饰因子(BMF)和BCL 2L11(编码BIM)被上调。这意味着IRF4通过减少调节BCL 2的促凋亡因子的表达来影响MM凋亡细胞死亡。使用高风险MM疾病的患者来源的异种移植物模型(PDX),据报道IRF4在MM祖细胞中高度表达,并在诱导参与细胞周期进展的几种靶基因中具有活性。通过IRF4反义寡核苷酸(ASO)ION 251下调IRF4可减少肿瘤形成和骨髓瘤播散,根除骨髓瘤祖细胞,提高生存率和对骨髓瘤药物的敏感性。在复发性/难治性MM患者中进行的ION 251 I期临床试验(NCT 04398485)正在进行中。
弥漫性大B细胞淋巴瘤(DLBCL)是非霍奇金淋巴瘤最常见的亚型,其临床表现和生物学特性具有异质性。这种异质性取决于疾病起源的B细胞发育阶段(COO,起源细胞)和不同生物学途径的活性。基于与来源细胞相关的基因表达谱的DLBCL分类定义了2大类,即生发中心B细胞(GCB)样DLBCL和活化B细胞(ABC)样DLBCL,其中约15%的DLBCL属于“未分类”类别。最近,基于突变、拷贝数变异和结构变异的遗传分类将DLBCL分为七个遗传定义类别。
ABC-DLBCL的标志是异常NF-κB活化和IRF4过表达。与MM相似,ABC-DLBCL细胞通过激活BCR依赖性NF-κB级联反应依赖于IRF4以存活。然后,正反馈环允许异常BCR信号传导维持ABC-DLBCL中IRF4的过表达。来那度胺通过在IRF4下调过程中减少BCR依赖性NF-κ B活化来抑制ABC-DLBCL细胞增殖。因此,IRF4的敲低模拟来那度胺介导的NF-κB活性下调,而IRF4表达的强制诱导赋予对来那度胺的抗性。用伊鲁替尼抑制BCR信号传导与来那度胺协同作用以阻断IRF4并杀死ABC-DLBCL细胞。2020年,来那度胺与靶向细胞溶解性CD 19单克隆抗体塔法西他单抗联合治疗复发/难治性DLBCL获批。
第5版WHO分类将IRF4重排的大B细胞淋巴瘤(LBCL-IRF4)确认为确定性实体。尽管有GCB转录程序,但LBCL-IRF4的特征是IRF4和NF-kB相关基因(例如CARD 11、CD 79 B和MYD 88)突变、17 p13丢失和7号染色体增加。此外,在LBCL-IRF4中检测到IRF4的强表达,这可能有助于NF-κ B的活化。为了确定IRF4在该亚型淋巴瘤中的潜在功能作用,需要进一步研究。
IRF4表达减少:调节慢性淋巴细胞白血病细胞的活化和免疫逃逸
几项研究表明IRF4在CLL的发病机制中的可能作用(图3)。在来自英国的517名CLL患者和1438名英国1958年出生队列对照中进行的全基因组单核苷酸多态性(SNP)关联研究将IRF4确定为CLL的主要易感基因,鉴定3′非翻译区(UTR)内的rs 872071 SNP和rs 9378805 SNP 10-在IRF4基因3′UTR着丝粒区的1.5kb的突变体与CLL的发生风险有最强的相关性。这些发现通过两个内部验证队列得到证实。然后,在438例非西班牙裔白人CLL的独立队列中,验证了IRF4附近的rs 9378805和GRAMD 1B附近的rs735665与CLL风险相关。精细定位分析发现,定位到IRF4基因3 '-UTR中3-kb区域的4个SNP与CLL相关。值得注意的是,IRF4表达减少与危险等位基因相关,提示IRF4通过阻止记忆B细胞向PC的转变而有利于CLL的发展。
在1.2-2%的CLL患者中检测到IRF4的DNA结合结构域(DBD)中的复发性杂合体细胞突变,包括氨基酸序列(p.L116R,c.347T > G)第116位的亮氨酸被精氨酸取代。携带IRF4突变的患者具有未突变的免疫球蛋白重链可变基因(IGHV)状态,这与CLL的不良临床结局相关。通过下一代测序(NGS)进行的全基因组测序(WGS)和全外显子组测序(WES)研究报告了CLL患者中的复发性突变基因,包括频率范围为0.7%-1.6%的IRF4基因L116 R变体。值得注意的是,Puente等人报告了IRF4基因突变在CLL的新型预后驱动因素中,发现与首次治疗时间较短相关,与临床分期和免疫球蛋白突变状态无关。IRF4 L116 R突变似乎在治疗的CLL患者和经历Richter转化(RT)的CLL中积累。IRF4 L116 R突变见于11%曾经历RT的伊匹替尼复发患者。此外,Richter综合征患者源性肿瘤异种移植物模型的基因组表征揭示了突变谱中的L116 R IRF4突变。最近的一项研究表明,IRF4 L116 R突变具有功能活性,赋予CLL细胞增殖优势。IRF4基因的第116位亮氨酸位于其高度保守的DNA结合结构域,其被精氨酸取代可能影响IRF4的DNA结合性能。L116R突变决定了IRF4与所有DNA靶标(ISRE、EICE、AICE)的更稳健结合,表明了功能获得机制。需要额外的分析来确定IRF4 L116 R蛋白的特异性DNA结合特性以及这种错义变体在CLL转化中的致癌作用。
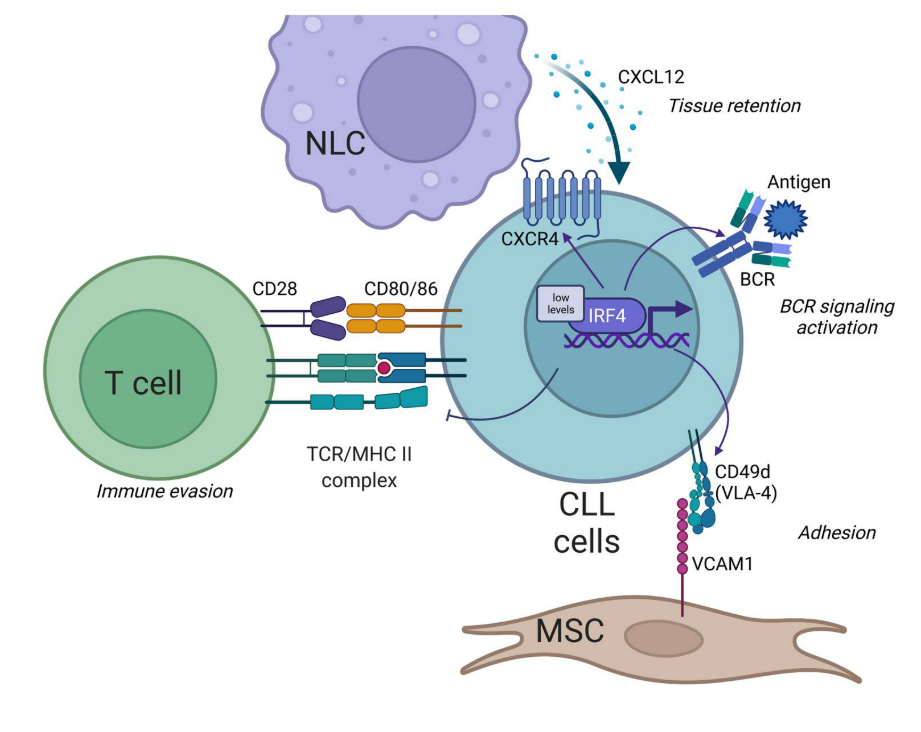
图3 IRF4在慢性淋巴细胞白血病(CLL)中的功能。与正常B细胞相比,CLL细胞显示IRF4的低表达。低IRF4水平促进参与CLL粘附和迁移的分子如VLA-4和CXCR 4的表达,从而控制白血病细胞定位在淋巴结内。此外,IRF4的表达减少通过调节IKAROS和SYK的表达来加强BCR信号传导。最后,CLL细胞和T细胞之间的相互作用由IRF4低表达调节,其降低CD 80和CD 86的表达,从而有利于免疫逃避。缩略语:CLL,慢性淋巴细胞白血病; NLC,护士样细胞; TCR,T细胞受体; MHC,主要组织相容性复合体; BCR,B细胞受体; MSC,间充质基质细胞。
IRF4 L116 R突变在未经治疗的CLL患者中很少见。在大多数CLL中,与健康个体相比,IRF4表达显著下调。此外,与IRF4高表达的CLL患者(79.4个月)相比,IRF4低表达的患者至首次治疗时间(51.3个月)显著缩短。IRF4表达降低的负面预后影响也在2个独立的CLL患者队列中得到验证。此外,据报道,低IRF4表达(通过免疫组织化学染色定义为MUM 1/IRF4阳性的CD 20 + B细胞少于20%)与CLL患者的晚期临床分期、弥漫性骨髓受累和首次治疗时间(TTFT)缩短相关。IRF4高表达在IGHV基因突变的CLL中更常见,结局更好。
CLL克隆的维持和进化依赖于白血病细胞定位于“增殖中心”内,依赖于BCR介导的细胞内级联反应的有效传递。阻断不同节点处的传输导致CLL存活的有效减少,并将细胞从保护性组织微环境中驱逐。缺乏IRF4的B细胞显示参与细胞迁移和归巢的基因富集,特别是VLA-4 。在携带12三体畸变的CLL细胞中,低水平的IRF4在IKAROS的整个调节过程中介导VLA-4表达。低IRF4水平通过诱导SYK表达和促进IKAROS蛋白的积累来加强BCR信号传导,IKAROS蛋白降低BCR负调节因子SHIP 1的表达。
在小鼠模型中也证明了低水平IRF4与CLL发展之间的因果关系。在New Zealand Black(NZB)IRF4 +/−小鼠模型中,CLL发育显著加速,IRF4 +/− CLL细胞对BCR刺激表现出高反应性。Shukla等人将B1细胞群扩增的Vh 11小鼠回交为IRF4缺陷小鼠,发现100%的IRF4 −/− Vh 11小鼠在10个月内发生CLL。在IRF4缺陷型TCL 1转基因小鼠中观察到CLL疾病进展增强,发现参与T细胞活化的基因(如MHC分子和CD 80和CD 86)严重下调。这项研究表明,IRF4参与调节CLL/T细胞相互作用。鼠CLL中IRF4的缺乏通过减少抗原经历的、潜在的肿瘤特异性T细胞的数量而有助于肿瘤免疫逃避,并且与更具侵袭性的疾病相关。
总体而言,IRF4水平降低似乎改善了CLL归巢至淋巴结隔室、BCR活化和肿瘤免疫逃避,但它也可能潜在地有助于分化停滞。然而,当CLL细胞获得IRF4突变时,很少发生在未经治疗的患者中,可能会激活不同的遗传程序,从而将轨迹赋予转化表型。需要进一步的研究来阐明IRF4在CLL细胞中功能的复杂性及其对CLL和Richter转化的贡献。
未来的思考
IRF4的表达动态影响着B细胞从早期发育到胚系形成、从中心母细胞向中心细胞的转变直至浆细胞分化的细胞命运。IRF4的流体行为是由与不同的DNA结合亲和力、多个IRF4特异性靶DNA基序以及与几种转录伴侣的复杂相互作用相关的复杂机制介导的。IRF4是B细胞恶性肿瘤中有亲和力的治疗靶标,特别是在MM和CLL中。涉及使用免疫调节药物(IMID)如来那度胺的经典策略或包含下一代IRF4反义寡核苷酸(ASO)的新方法,其采用介导IRF4 mRNA的RNA酶H依赖性降解的受限乙基残基,介导IRF4下调,干扰MM中的IRF4调节的转录程序和IRF4-MYC反馈环。IRF4在CLL中的过表达似乎干扰了由BCR活化和白血病细胞归巢到“增殖中心”内介导的存活信号,抵消了CLL进展和克隆进化的关键信号。在这种情况下,利用来那度胺对CLL细胞中IRF4的反向作用或测试全反式维甲酸(ATRA)以增加IRF4表达需要进一步研究。
















共0条评论