[导读] 编译:张波
CIC-重排肉瘤是一种罕见的高度侵袭性未分化小圆细胞肉瘤。CIC::DUX4是一种典型的CIC融合癌蛋白,与快速临床进展和化疗耐药相关,可致临床预后较差。最近研究已确定还有其他CIC融合体(CIC::NUTM 1,CIC::FOXO 4和CIC::LEUTX),它们在很大程度上保留了CIC结合特异性,但可利用C末端结合伴侣(NUTM 1,FOXO 4和LEUTX)潜在激活驱动肿瘤发生的转录程序。此外,最近开发研究CIC::DUX4肉瘤的临床前模型进一步推进了潜在生物学机制的理解,并揭示了可以转化为合理治疗的关键依赖性。本综述中,将重点介绍CIC-重排肉瘤分子生物学最新进展,并展望临床转化以改善患者预后。
前言
CIC-重排肉瘤是一种罕见的高度侵袭性未分化小圆细胞肉瘤。最常见的CIC重排蛋白是CIC和DUX4之间的融合。起初,世界卫生组织(WHO)将CIC::DUX4肉瘤(CDS)归类为“尤文肉瘤样”肿瘤,主要基于其与尤文肉瘤(ES)的形态相似性。因此,尽管CDS预后相对于ES更差,但其临床管理通常仍类似于ES。新数据表明,CIC::DUX4驱动肉瘤相比ES和其他小圆细胞肉瘤具有独特转录程序特征。此外,具有不同临床表现和结局,从而支持CDS是一个与ES不同的肿瘤实体。
本文主要综述CIC重排蛋白的分子特征,包括CIC::DUX4、CIC::NUTM 1、CIC::FOXO 4和CIC::LEUTX,重点介绍它们的融合结构、功能和转录靶点。此外,将报告已开发的临床前模型,以更好地了解CIC融合肉瘤背景下的癌蛋白以及治疗策略。从而比较和对比CIC融合的临床表现,强调解剖分布和临床结局。通过这些分子和临床观察,为针对这一未得到充分治疗的人类肉瘤子集开发共识疗法提供框架。
CIC融合的分子特征
CIC-重排肉瘤的转录调控机制
野生型(WT)CIC最初被发现是黑腹果蝇的高迁移率基团(HMG)盒转录阻遏物,在果蝇中其作为MAPK-ERK信号传导传感器来协调胚胎模式形成。最近通过质谱(MS)分析发现CIC在哺乳动物中具有转录抑制功能。MS分析描绘了在CIC转录靶位点与SIN 3-HDAC共阻抑物复合物的物理相互作用。这些研究还提示CIC-SIN 3/HDAC复合物和SWI/SNF募集至CIC DNA灶之间的机制。这些早期的研究共同表明CIC与SIN 3/HDAC和mSWI/SNF阻遏物复合物协同作用,在哺乳动物系统中转录沉默靶基因。在CIC DNA结合位点募集和阻遏物复合物装配后,CIC通过识别TGAATGAA样DNA基序沉默高度保守的MAPK-ERK靶基因。MAPK激活后,CIC通过ERK介导的降解被功能性抑制,导致MAPK-ERK应答基因的去抑制。CIC DNA结合和序列识别的潜在机制被认为是由其保守的HMG盒和C1结构域调节,这使其具有高度序列特异性。研究最多的CIC靶点包括转录因子PEA 3家族,即ETV 1、ETV 4和ETV 5。CIC的遗传缺失或功能性抑制在人类癌症如肺癌、胃癌、乳腺癌和结肠直肠癌多个亚组中去抑制ETV 1、ETV 4和/或ETV 5,导致肿瘤增殖增强、自我更新和侵袭/转移。
尽管CIC的主要功能是作为转录阻遏物,但因其具备融合癌蛋白激活能力,在2006年,首次描述了CIC失调在癌症中的作用。具体而言,Takuro中村及其同事使用体外和体内转化模型,对CIC重排(即CIC∷DUX 4融合癌蛋白)进行了功能表征。在结构上,CIC::DUX 4融合体几乎总是保留90%以上的天然CIC,包括HMG盒和C1结构域,并且由于易位t(4; 19)(q35; q13)或t(10; 19)(q26; q13)而与DUX 4的C末端反式激活结构域连接(图1)。通过这种融合,CIC的C末端被DUX 4反式激活结构域取代,DUX 4反式激活结构域与p300/CBP复合物相互作用。因此,可以合理地假设这些结构变化将SIN 3-HDAC和SWI/SNF阻遏物复合物的相互作用转变为p300/CBP显性相互作用,导致CIC靶基因的转录激活。因此,有理由认为CIC::DUX 4通过p300/CBP的保守DUX 4募集获得转录激活能力,其诱导组蛋白H3乙酰化以使靶基因激活。与此一致,本研究也观察到,在患者来源的CIC::DUX 4细胞系中,整体CIC::DUX 4结合与H3 K27 ac标记重叠,再次表明p300/CBP可能部分赋予活化能力。总之,CIC共同选择p300/CBP相关转录因子DUX 4的激活能力,以上调关键靶基因,包括PEA 3家族成员、细胞周期基因如CCND 2和CCNE 1,以及负性MAPK调节因子(包括DUSP 4和DUSP 6),驱动侵袭性未分化圆细胞肉瘤的恶性表型。这些结构-功能研究表明,CIC::DUX 4在很大程度上保留了CIC DNA结合特异性,同时部分通过DUX 4介导的p300/CBP募集将其天然阻遏物功能(SIN 3-HDAC和SWI/SNF)转化为有效的癌基因。
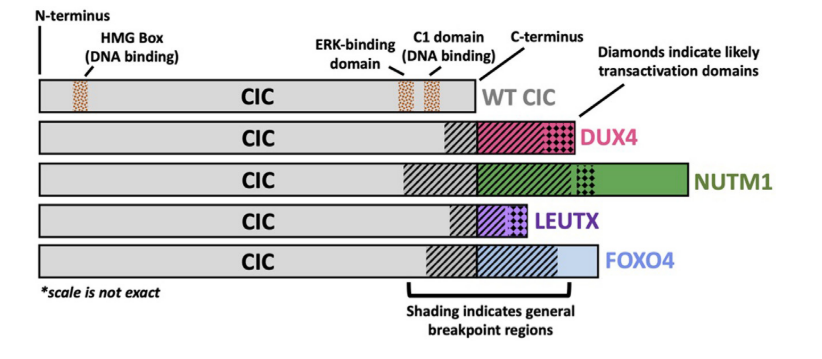
图1.CIC融合癌蛋白结构示意图。CIC融合癌蛋白结构示意图,突出了高度保守的野生型(WT)CIC区域,融合断裂点和C-末端结合配偶体具有变异性。CIC::DUX 4融合癌蛋白通过其HMGbox和C1结构域保留WT CIC DNA结合特异性,但通过DUX 4介导的p300募集到CIC结合位点获得转录激活能力。C-末端结合伴侣NUTM 1、LEUTX和FOXO 4先前已被报道与p300/CBP相互作用。
CIC融合癌蛋白的结合伴侣
自CIC::DUX 4首次发现以来,目前已报道了其他CIC融合体,包括CIC::NUTM 1、CIC::FOXO 4和CIC::LEUTX。在3' CIC断点中具有一些变异性的情况下,这些CIC融合体在很大程度上保留了大部分WT CIC,包括其HMG盒结构域,用另一种转录调节因子的组分取代CIC的C末端,所述转录调节因子包括NUT中线癌家族成员1(NUTM 1)、叉头盒O 4(FOXO 4)或亮氨酸二十同源盒(LEUTX)。有趣的是,这些CIC结合伴侣与p300/CBP相互作用是明确定义的发育调节转录因子。因此,可以合理地预期这些CIC重排蛋白可能以与CIC::DUX4融合癌蛋白类似的方式起作用。
CIC::NUTM1于2016年在中枢神经系统(CNS)原始神经外胚层肿瘤的分子分析中首次报告,其中2例患者携带CIC外显子16和NUTM1外显子4之间的融合。此后,其他研究发现NUTM1融合体在至少存在于另外一名CNS患者和20名肉瘤患者中,其中嵌合体发生在CIC外显子16、17、18和20与NUTM1外显子2、3、4、5和6之间(图1)。虽然阐明分子病理学的功能性研究有限,但非CIC::NUTM 1融合与NUTM 1中线癌有关,特别是BRD 4::NUTM 1融合,因为p300募集和随后的组蛋白乙酰化是致癌激活的假设机制。从结构上看,CIC::NUTM 1融合体保留了CIC HMG盒结构域,但与CIC::DUX4相反,CIC::NUTM 1融合体似乎并不普遍含有CIC C1结构域,而CIC C1结构域先前被认为与DNA结合和靶基因特异性结合有关。有趣的是,患者来源的CIC::DUX4和CIC::NUTM 1融合体的转录谱显示这两组有一些相似性,但在远端层次分支略有不同。这些发现表明,虽然CIC::DUX 4和CIC::NUTM 1可能共享转录靶点,但可能存在分子上区分这两种融合癌蛋白的关键。因此,更深入和更全面的分析可以揭示与每个融合唯一相关的关键分子差异。例如,CIC的C1结构域是否和/或在具有CIC融合体的情况下有助于靶基因特异性(CIC::DUX 4保留C1结构域; CIC::NUTM 1不保留C1结构域)。此外,这种比较可以突出CIC结合伴侣(包括DUX 4和NUTM 1)如何影响融合特异性靶基因调控之间的关键区别。旨在解决这些问题的未来比较研究是必要的,因为这些融合调节细胞转化的分子基础可能更好地了解患者的临床特征和治疗方法。
更罕见的CIC::FOXO 4融合共在4例患者中报告,其中3例患者的断裂点发生在CIC外显子19或20与FOXO 4外显子2或3之间(图1)。因此,与CIC::DUX 4融合体相似,CIC::FOXO 4癌蛋白在结构上共享CIC DNA结合元件(HMG盒和C1结构域),表明CIC DNA结合特异性和靶基因调控相对于CIC::DUX 4可能是保守的。虽然关于CIC∷FOXO 4融合癌蛋白的分子机制知之甚少,但已经在MLL重排的急性白血病(AFX∷MLL)和肺泡横纹肌肉瘤(PAX 3∷FOXO 1)中鉴定出了FOXO 4(也称为AFX)和FOXO 1(也称为FKHR)嵌合体。类似于DUX 4和NUTM 1,p300已被证明与FOXO家族的转录因子相互作用。FOXO 4不仅被描述为以过氧化物诱导的、氧化还原依赖性的方式与p300共免疫沉淀,而且最近还显示PAX 3::FOXO 1的激活结构域中的单个半胱氨酸对于p300/CBP向染色质募集具有重要作用。我们完全期望通过改进CIC::FOXO 4模型,将更好地理解CIC::FOXO 4融合的分子机制以及它们如何促进肉瘤发生。
在肉瘤和非肉瘤恶性肿瘤中已经鉴定出第四种CIC融合-CIC::LEUTX。已报道确定CIC::LEUTX嵌合体可发生在肾肉瘤、脊髓肉瘤、血管肉瘤、中枢神经系统胚胎性肿瘤和小儿型高级别神经上皮肿瘤的CIC外显子20和LEUTX外显子3之间(图1)。有趣的是,LEUTX是一种发育调控的转录因子,在早期人类胚胎发育中表达,但随后在体细胞组织中沉默。重要的是,DUX4,这是一个关键的早期胚胎基因组激活因子,可以转录上调LEUTX表达。此外,WT LEUTX已显示与p300/CBP介导的乙酰化作用物理上相互作用并依赖于p300/CBP介导的乙酰化作用来激活靶基因。值得注意的是,LEUTX通过其C末端的9个氨基酸的反式激活结构域与p300相互作用,该结构域在CIC∷LEUTX融合体中是保守的。因此,CIC::LEUTX融合癌蛋白可能在分子靶点和转录激活模式上与CIC::DUX4部分重叠。Sievers等人最近的一项研究利用DNA甲基化模式来区分存在CIC::LEUTX融合肉瘤与其他CIC重排(非CIC::LEUTX重排)中枢神经系统(CNS)肉瘤。分析显示携带CIC::LEUTX的CNS肿瘤被分成其自身的组群,其特征是具有与CIC重排的CNS肉瘤组群不同的儿童型高级别神经上皮组织学形态。与CIC::DUX4和CIC::NUTM 1肿瘤之间的比较一致,这些发现表明,虽然CIC::LEUTX融合可能与CIC::DUX4肿瘤有一些相似之处,但这些分子子集之间可能存在关键区别。进一步的研究显然是必要的,以进一步阐明共同和不同的机制之间的CIC融合。
CIC-重排肉瘤的临床前模型
人类细胞系
Tadashi Kondo及其同事于2017年建立了第一个广泛验证的CIC::DUX4患者源性细胞系。具体而言,CIC::DUX 4融合阳性软组织肿瘤来源于一名29岁女性患者,将其植入免疫缺陷小鼠中,免疫缺陷小鼠连续繁殖三次,以产生NCC-CDS 1-X1(第一次传代后产生的细胞系)和NCC-CDS 1-X3(第三次传代后产生的细胞系)。经Sanger测序证实,在读框内的CIC::DUX 4转录物将CIC外显子20与DUX 4外显子1融合,连接核苷酸序列为5′-GGGTGGAG-3′。最后,Kondo和他的同事利用从另一名CIC::DUX 4肉瘤(CDS)患者手术切除的肿瘤组织建立了NCC-CDS 2C 1患者来源细胞系,该肿瘤组织含有类似CIC::DUX 4融合转录物。此外,命名为Kitra-SRS的第三种细胞系是从源自患有转移性CDS的9岁女孩的软组织肿瘤产生的。Kitra-SRS细胞系是在切除原发性肿瘤后通过异种移植增殖产生。序列分析显示CIC外显子20与DUX 4外显子1融合,CIC与DUX 4连接处的5′-GGGTGG-3′核苷酸序列与NCC-CDS 1-X1和NCC-CDS 1-X3细胞相似。值得注意的是,所有这些上述模型在组织学上与原始切除的CDS肿瘤相似,并且KitraSRS荷瘤小鼠表现出肺转移,这概括出在其来源的宿主中观察到侵袭性疾病模式。
虽然在患者肿瘤中识别CIC::NUTM 1、CIC::FOXO 4和CIC::LEUTX融合的病例报告一直在增加,但尚未产生用于实验用途的患者来源的细胞系或异种移植物。
鼠模型
最近,Hendrickson等人设计了三种CIC::DUX4嵌合小鼠模型(Ch7CDS、Ai9CDS和TOPCDS),其在不存在Cre-重组酶的情况下发展了与肺和肝中假定的广泛转移相关的自发性CDS样肿瘤。作者推测CIC::DUX4融合是一种高度有效的致癌基因(类似于Kras),可导致自发性肿瘤形成。这些研究在很大程度上代表了原理验证实验,因为所有三种嵌合模型都在繁殖之前由于快速自发肿瘤形成而随后死亡。尽管存在这些局限性,作者还是能够生成重要的分子数据集,并研究小鼠中CIC::DUX4介导的基因激活的潜在机制。总的来说,他们的发现与人类CDS一致,因为他们证明了多个共享的转录靶点,包括已知的PEA3家族成员,这些成员部分与p300转录激活相关。一个与其他发现一致的有趣观察是CIC::DUX4定位并结合DNA上的GGAA基序序列。这些发现表明WT CIC和CIC::DUX4(以及其他CIC重排)可能通过非共有(非TGAATGAA样)样基序调节基因表达。未来的研究旨在确定和区分哪些基因是由CIC::DUX4在TGAATGAA和GGAA样DNA基序调控的,这是非常必要的。
通过小鼠胚胎间充质细胞(eMC)的CIC::DUX4转导,Yoshimoto等人产生了一种离体CDS小鼠模型,其再现了人CDS的组织学和临床特征。在该模型中,将表达CIC::DUX 4的eMCs移植到免疫缺陷裸鼠的皮下软组织中。在100%的潜伏期内,裸鼠迅速形成原发性肿瘤,平均潜伏期为24天。这些CIC::DUX 4肿瘤的连续移植导致28%的受体小鼠发生自发性肺转移。相关研究进一步鉴定了保守的人类CIC::DUX 4转录靶点,包括ETV 1、ETV 4和CCND 2。作者随后利用这种小鼠模型来测试治疗策略,并注意到使用阻断CCND 2CDK 4/6复合物的遗传和药理学方法抑制肿瘤生长。
CIC融合临床和病理特征
本研究CIC::DUX4确诊病例报告中,CDS诊断的中位年龄为29.5岁,范围为11-82岁,男女比例为14:18(表1)。通过病例研究分析的32例CDS患者中,有10例肿瘤主要位于下肢软组织,其中也较多发生在上肢软组织和肾脏以及盆腔区域(图2)。相比之下,CIC::NUTM 1肉瘤的中位年龄为15.5岁(范围为2-61岁),根据现有临床数据,男性与女性的发病率比例为8:6(表1)。有趣的是,CIC::NUTM 1肿瘤主要位于CNS,超过70%局限于脊柱(颈椎和胸椎水平)和脑(脑膜、脑实质肉瘤的颞枕区、侧脑室三角区、室间孔、顶叶),其他肿瘤很少见如肺和肾软组织。中枢神经系统趋向性与先前的报道一致。到目前为止,仅发表了4例关于CIC::FOXO 4融合病例报告,诊断的中位年龄为36.5岁(范围13-63岁),男女比例为3:1(表1)。在这些患者中,原发性肿瘤位于头皮,颈部和大腿(图2)。
尽管对CIC::LEUTX肉瘤相关的临床特征知之甚少,但最近一项描述儿童CNS肿瘤的研究发现9例CIC::LEUTX融合患者均发生在幕上室。中位发病年龄为7岁(范围2-19岁),以女性为主(男女比例为3:6)(表1)。一个患者亚组(n=6)的CIC::LEUTX患者的临床结局显示中位无进展生存期为13.5(8-16)个月,所有患者均出现复发。在15个月的随访期内,仅有1例患者死于该疾病。本研究中未获得治疗应答。另一项研究确定了另外2例CIC::LEUTX融合患者,其中1例位于中脑/丘脑,另1例位于左臀部并伴有肺转移。在中脑受累的患者中观察到对放疗和替莫唑胺的治疗反应,而在患有左臀部CIC::LEUTX肉瘤的肺转移患者中观察到化疗(AIM)反应。长期临床随访和病例数量较少使得难以概括这些观察结果,需要更多病例才能得出关于治疗反应和/或解剖分布的可靠结论。
表1.CIC融合临床病理学特征.
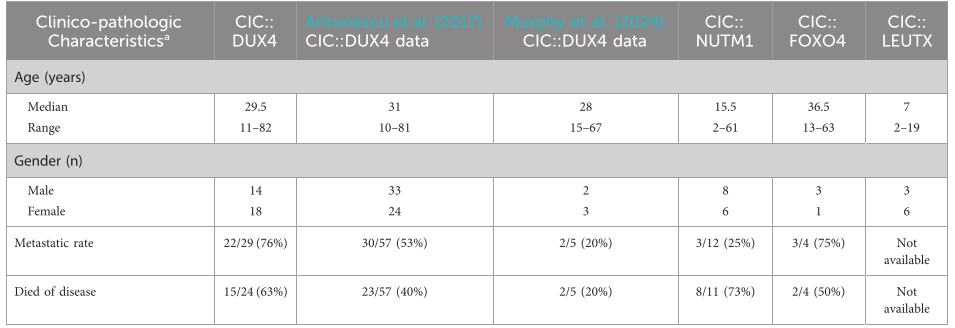
基于现有临床数据。通过PubMed,使用关键词(“CIC-DUX 4,病例报告”)、(“CIC-NUTM 1,病例报告”)、(“CIC-FOXO 4,病例报告”)和(“CIC-LEUTX,病例报告”),确定了CIC融合与定义的结合伴侣的临床病理学数据。除了个别病例报告外,还纳入了两项已发表的研究,这些研究专门确定了患者中的CIC::DUX 4融合并提供了临床数据。
在4例CIC-重排肉瘤中,病例报告中可用数据的汇总统计表明,CIC::DUX 4肉瘤与相对更具侵袭性的临床过程相关,转移率最高(76%;总数n=29),且好发于肺。携带CIC::FOXO 4融合的肉瘤患者的肺转移率也很高(75%;总n=4),而携带CIC::NUTM 1肿瘤的患者肺转移率最低(25%;总n=12),远处部位包括肺、甲状腺、骨和脑。尽管转移模式存在差异,但每个CIC重排队列(不包括CIC::LEUTX)中至少有一半的患者死于疾病(图1)。
治疗晚期人类CIC-重排肉瘤的当前和新兴策略
对于CIC-重排的肉瘤患者没有一致的治疗策略。因此,CIC-重排肉瘤的治疗与其他化疗敏感性更高的小圆细胞肉瘤(包括尤文肉瘤(ES))相似。本篇综述只针对CIC-融合肉瘤简要介绍基于新兴机制为基础的标准化疗方法。标准化疗方法包括长春新碱、多柔比星、环磷酰胺与异环磷酰胺和依托泊苷交替(VDC/IE)或多柔比星加异环磷酰胺与MESNA(AIM)(表2)。需要强调的是,这些治疗策略主要基于CIC::DUX4和ES之间的组织学相似性,而不是肿瘤对这些化疗方案的敏感性程度。
文献报道的4例CIC∷FOXO 4肉瘤患者中,有2例行手术切除、常规联合化疗(如:VDC/IE),或者使用激酶抑制剂(例如,临床试验卡博替尼)(表2)。尽管CIC∷NUTM 1在CIC-重排肉瘤中的转移率最低,只有2例发生转移性进展,但在病例报告中描述8/14例患者死于疾病,并且大多数患者在手术切除、化疗和放疗过程中死亡。其中1例患者专门遵循了6个周期VIDE(长春新碱、异环磷酰胺、多柔比星和依托泊苷)的ES化疗联合方案,但不幸的是仍继续进展。故阐明CIC::NUTM 1和CIC::FOXO 4肉瘤的分子发病机制并确定治疗靶点的功能研究是必要的。
CIC-重排肉瘤的靶向治疗机制
尽管CIC::DUX4融合是2006年发现的第一个CIC-重排肉瘤,但仍然没有足够的化疗方案用于CDS。最近的研究集中在理解CIC::DUX4融合癌蛋白的机制基础上,阐明了潜在的药物靶点(表2)。临床前研究确定CIC∷DUX4在分子上依赖于细胞周期介质CCNE1和WEE1,其中CCNE1被确定为CIC∷DUX4的直接转录靶点,其通过对CCNE/CDK2复合物的获得性依赖来驱动肿瘤生长和存活。CCNE/CDK2复合物的过度活化损害了G1/S转变并以相对融合特异性的方式赋予了对CDK2抑制剂的敏感性。为了防止S期DNA损伤的累积并随后防止过早的有丝分裂进入,CIC∷DUX 4肉瘤依赖于G2/M检查点激酶WEE 1来延迟有丝分裂进入并确保有丝分裂前适当的DNA修复和完整性。因此,在CIC∷DUX 4肿瘤异种移植模型中,adavosertib抑制WEE 1激酶可诱导肿瘤消退。这些临床前研究为开发针对CIC::DUX 4患者的基于CDK 2和WEE 1的临床试验提供了依据。为此,Blueprint Medicine正在通过其正在进行的临床试验NCT 05252416(表2),在CIC-重排肉瘤患者中测试其CDK 2抑制剂(BLU-222)。此外,基于上述临床前发现我们和其他人正在努力开发一种未来的WEE 1导向策略,以在CIC-重排肉瘤患者中进行测试。
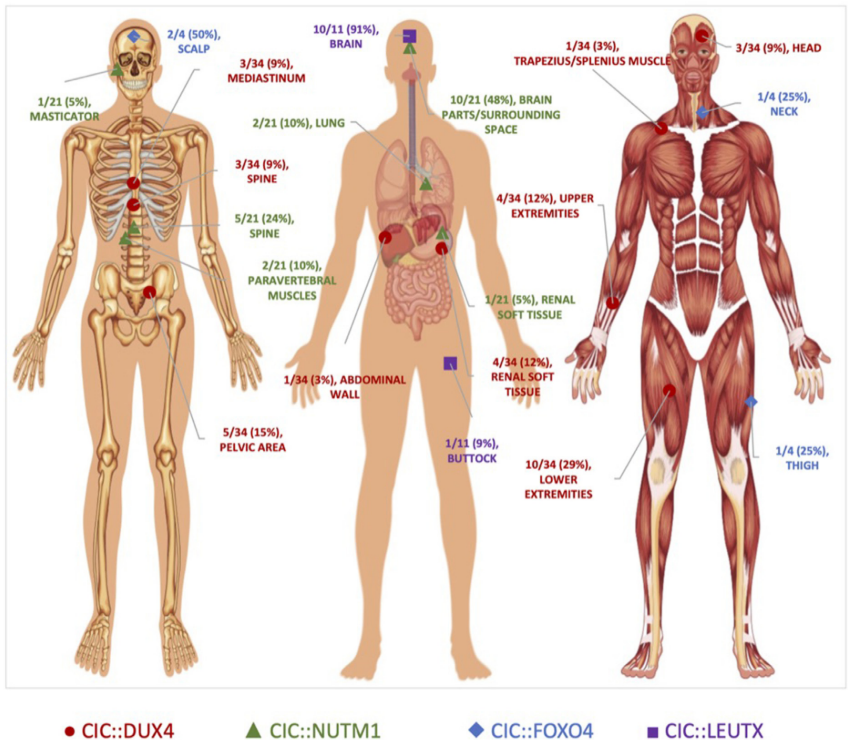
图2.CIC-重排原发性肿瘤的解剖定位。CIC::DUX 4(红色圆圈)肿瘤主要位于软组织中,CIC::NUTM 1(绿色三角形)肿瘤主要见于中枢神经系统,CIC::LEUTX(紫色方块)肿瘤主要局限于大脑,而CIC::FOXO 4(蓝色菱形)肿瘤散布在头皮、颈部和大腿。
通过Kitra-SRS CIC::DUX 4阳性细胞系的开发和研究鉴定了靶向CDS的另一种基于机制的方法已在上面讨论过。具体而言,Kitra-SRS细胞的分析揭示了胰岛素样生长因子1(IGF-1)/IGF 1受体(IGF-1 R)信号通路的自分泌激活(表2)。因此,用IGF-1 R抑制剂linsitinib抑制该途径,限制了IGF-1 R/ AKT信号传导,并在体外和体内减少了Kitra-SRS肿瘤生长。
表2.CIC-重排肉瘤尝试和建议的治疗方式
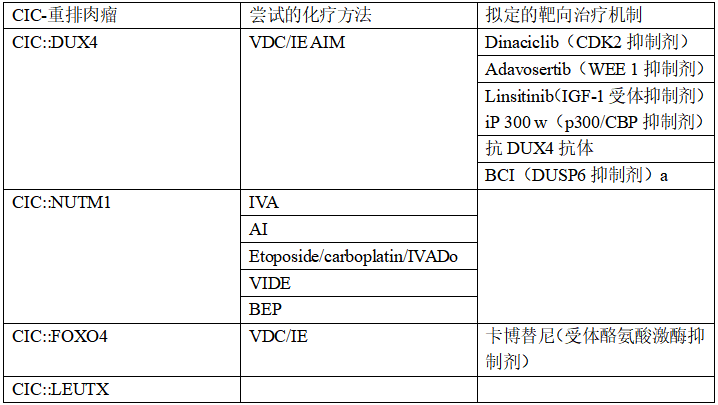
备注:基于机制的靶向治疗已经确定了主要在CIC::DUX4肉瘤中的潜在依赖性。对于CIC::NUTM 1和CIC::LEUTX融合,除了常规化疗外,几乎没有其他治疗方法,其中一种靶向治疗尝试用于CIC::FOXO 4患者。
·VDC/IE:长春新碱、多柔比星、环磷酰胺交替异环磷酰胺和依托泊苷。
· AIM:阿霉素、异环磷酰胺、MESNA。
· IVA+/−Do:异环磷酰胺、长春新碱、更生霉素、+/−阿霉素。
· VIDE:长春新碱、异环磷酰胺、阿霉素、依托泊苷。
· BEP:博来霉素、依托泊苷、顺铂。
a未用于临床。
由于MAPK-ERK信号传导导致野生型CIC降解,Lin等假设ERK的药理学激活可能潜在地导致CIC∷DUX 4癌蛋白的直接降解,该蛋白保留了高度保守的ERK结合域。通过一系列的生化和遗传学研究,他们证明了通过抑制DUSP 6磷酸酶激活ERK(使ERK去磷酸化以降低活性)可导致CIC∷DUX 4降解。此外,他们鉴定了CIC∷DUX 4在转录上上调DUSP 6以沉默ERK活性并维持肉瘤中CIC∷DUX 4癌蛋白的表达。DUSP 6抑制剂未在临床上使用,主要是由于在非CIC∷DUX 4肉瘤中激活ERK的潜在负面作用(表2)。
Bosnakovski及其同事确定了一种更广泛的靶向CIC::DUX4转录活性方法。利用WT DUX4(和CIC::DUX4)如何与p300相互作用的生物学见解,他们合理化了p300抑制可能克服CIC::DUX4肉瘤生长和存活。他们证明iP 300 w是一种有效的p300/CBP抑制剂,逆转了CIC::DUX 4相关的组蛋白H3乙酰化标记,并因此抑制了CIC::DUX 4转录活性,同时限制肿瘤生长(表2)。
最后,直接靶向CIC∷DUX 4融合癌蛋白组分的疗法正在出现。具体而言,靶向RNAi分子(TRiM)被用于在面肩肱型肌营养不良症中拦截DUX 4(NCT 06131983)。被设计成靶向包括融合癌蛋白的细胞内新抗原的细胞穿透抗体也处于早期开发中,并且在不久的将来可能具有临床意义。由于WTDUX 4在成体体细胞组织中通常沉默,因此,在CIC∷DUX 4融合的情况下,可以有效靶向DUX 4的基于RNAi的技术和/或细胞穿透抗体可以开辟另一种治疗途径,该途径旨在选择性靶向人肉瘤中的CIC∷DUX 4癌蛋白(表2)。
总之,希望未来和正在进行的旨在识别和利用CIC::DUX4肉瘤中关键依赖性的研究将适用于其他CIC-重排肉瘤,以改善目前没有治疗选择患者的结局。
讨论
CIC::DUX 4首先在未分化小圆细胞肉瘤中被识别,这些肉瘤缺乏表征ES的传统EWSR 1融合。改进的模型系统加上更先进的分析研究,使我们能够更深入地了解CIC::DUX 4介导的肿瘤发生的生物学基础。此外,增强的测序技术和病理分层导致发现更多CIC重排蛋白,包括CIC::NUTM 1、CIC::FOXO 4和CIC::LEUTX。在结构水平上,这些融合体共享WT CIC的很大一部分,包括其DNA结合结构域和靶基因特异性。早期的数据表明,发育调节的C-末端结合伴侣(DUX 4,NUTM 1,FOXO 4和LEUTX)可能通过募集p300/CBP复合物来赋予激活能力。然而,需要进一步的研究来验证这一假设。尽管它们在融合结构上具有共性,但我们预期CIC融合类型之间的转录和可能的功能差异,这通过比较CIC::DUX 4与CIC::NUTM 1和/或CIC::LEUTX肿瘤的上述转录研究得到支持。这些细微的分子差异可能有助于深入了解区分患者CIC重排的关键差异,包括解剖向性,转移潜力和对治疗反应等。
临床前细胞模型和动物模型的发展不仅进一步剖析了CIC::DUX 4的分子和功能机制,而且还进一步剖析了新识别的CIC::NUTM 1、CIC::FOXO 4和CIC::LEUTX嵌合体的分子和功能机制,这将为改善这些患者的治疗策略提供见解。我们赞赏旨在开发新的患者源性模型的罕见肿瘤项目,例如CIC-重排肉瘤细胞系,这些细胞系可以与科学界分享,通过机械研究来提高对其理解。
由于其罕见性,针对CIC::DUX 4肉瘤的新治疗策略的开发仍然有限。通过对CIC::DUX 4生物学的深入机制剖析,已经确定了临床前靶点,这些靶点需要临床验证,以完善CIC-重排肉瘤患者的治疗模式。鼓励临床研究者在国家或国际层面上共同努力,在正在进行的和/或未来的基于机制的临床试验中招募CIC-重排肉瘤患者。
另一个需要克服的重要障碍是在临床领域中,要求肉瘤群体进行统一的分类,以将CIC-重排肉瘤与其它小圆细胞肉瘤如ES区分开。考虑到CIC融合患者在临床上经常面临缺乏治疗共识和错误的治疗策略,目前利用国家癌症研究所(NCI)赞助的临床试验网络(ETCTN)在美国各地参与中心可以合作进行早期试验,靶向CIC-重排肉瘤与NCIIND药物,如WEE1抑制剂。总之,科学界和临床界之间的合作是至关重要的,从而可以将这种致命的肉瘤亚型进行治疗干预。

















共0条评论