[导读] 编译:张波
[摘要]目的 CIC-重排肉瘤(CRS)是临床上侵袭性未分化圆细胞肉瘤(URCS),通常由CICS::DUX4融合基因驱动。由于DUX4的重复性和融合断点的可变性,分子检测可能会遗漏CIC::DUX4融合。免疫组织化学(IHC)染色已被研究作为CIC::DUX4融合替代物。本研究目的是评估DUX4 IHC在CRS及其在非CRS圆形细胞或上皮样肿瘤中的表达情况。方法和结果 包括经分子学证实的CRS病例(n=48)和非CRS病例(n=105)。CRS病例包括35例女性和13例男性,年龄范围从<1岁~67岁(中位数=41岁)。在分子学证实的非CRS病例中,研究了尤文肉瘤(n=38)、腺泡状横纹肌肉瘤(n=18)、促结缔组织增生性小圆细胞肿瘤(n=12)和滑膜肉瘤(n=5),以及非间叶性肿瘤如SMARCA 4/SMARCB 1缺陷型肿瘤(n=5)、原发灶不明的癌(n=3)和淋巴造血系统肿瘤(n=4)这些非CRS病例中C-末端DUX 4表达情况。当>50%肿瘤细胞检测到强核阳性表达时,DUX 4 IHC被认为阳性。作为CRS诊断替代性标记物,DUX 4 IHC的灵敏度和特异性分别为98%和100%。仅1例存在CIC::FOXO 4融合CRS病例DUX 4 IHC阴性。结论DUX4 IHC是CIC::DUX4融合存在的高度敏感和特异性替代标志物,其在CRS诊断中具有较好的实用价值。
前言
未分化圆细胞肉瘤(URCS)是一类恶性间叶细胞源性肿瘤,其组织学特征无法仅根据瘤细胞形态进行明确诊断。特征是圆形/卵圆形瘤细胞,具有较高核质比,以不同的结构模式排列。该组肿瘤包括相对常见的尤文肉瘤和促结缔组织增生性小圆细胞瘤,以及罕见的融合定义实体,如CIC-重排肉瘤(CRS)、BCOR遗传变异肉瘤和存在融合涉及EWSR 1和非ETS家族基因如NFATC 2和PATZ 1的圆细胞肉瘤。
CRS是URCS一种类型,其特征在于涉及位于19号染色体上的Capicua转录抑制基因(CIC)的重排,该基因编码CIC蛋白,CIC蛋白是一种高度保守的肽,可通过抑制PEA 3亚家族转录因子(如ETV 1)、ETV 4和ETV5的转录而充当肿瘤抑制物。与CRS相关的最常见的遗传变异是位于19号染色体上的CIC和双同源框4(DUX 4)之间的基因融合。位于4号染色体上或位于10号染色体上的双同源框4样(DUX 4L)融合最常发生在CIC外显子20和DUX 4外显子1之间,位于D4Z4重复内,D4Z4重复是存在于4 q35和10 q26上的同源串联重复单元的亚端粒阵列。
与尤文肉瘤和其他URCS相比,CRS的预后更差,并且治疗方法也有不同。因此,将CRS与其组织学相似的肿瘤进行适当区分至关重要。然而,缺乏金标准形态学或免疫表型特征构成了该肿瘤诊断的挑战性。此外,荧光原位杂交(FISH)分离试验由于可能的隐蔽插入超过检测下限证明其存在大量假阴性结果。实时聚合酶链反应(RT-PCR)在CRS诊断后处理中的适用性可能会因每个基因中外显子-外显子断点位置的变异性而变得复杂,特别是对于DUX 4伴侣基因。最后,由于DUX 4基因上的高度重复序列,依赖融合发现算法的下一代测序(NGS)方法可能会过滤掉CIC::DUX 4融合发现。因此,技术组合对于CRS的精确诊断至关重要。
CRS的免疫组织化学(IHC)表型先前已进行过研究,证明WT-1、CD 99、FLI-1和ERG存在不确定性表达。核WT-1免疫组织化学是一种缺乏特异性及敏感性较低的标记物。ETV 4尽管偶尔可以在其他URCS如尤文肉瘤中检测到,但已被评估为CRS的潜在IHC或RNA显色原位杂交标记物,显示出有较好的灵敏度和特异性。DUX4 IHC作为CIC::DUX4基因融合诊断CRS的替代物的性能之前也进行了研究,显示出完美的灵敏度和特异性,尽管仅限于非常有限的病例数量。本研究旨在进一步评估DUX4 IHC在CRS诊断检查中的性能,以及在来自两个不同实验室的大型病例队列中研究其在非CRS圆细胞肿瘤中的表达情况。
方法
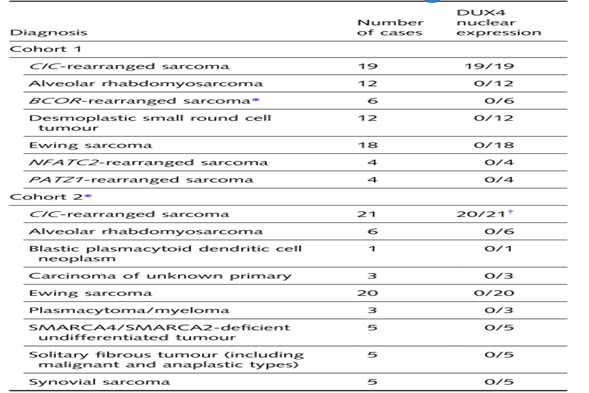
研究对象分为两组队列,将来自捷克共和国比尔森的Biopticka实验室数据库中1993年~2024年诊断的各种圆细胞肉瘤病例,如CRS、腺泡状横纹肌肉瘤、EWSR 1::PATZ 1重排肉瘤等设为队列1;来自俄亥俄州克利夫兰的克利夫兰诊所机构数据库中2014年~2024年的病例归为队列2,入选标准包括CRS及非CRS病例,两组队列均进行DUX4免疫组织化学染色。复核病例中发现的包括经分子学证实的CRS病例(n=48)和非CRS病例(n=105)。CRS病例包括35例女性和13例男性,年龄范围从<1岁~67岁(中位数=41岁)。在分子学证实的非CRS病例中,研究了尤文肉瘤(n=38)、腺泡状横纹肌肉瘤(n=18)、促结缔组织增生性小圆细胞肿瘤(n=12)和滑膜肉瘤(n=5),以及非间叶性肿瘤如SMARCA 4/SMARCB 1缺陷型肿瘤(n=5)、原发灶不明的癌(n=3)和淋巴造血系统肿瘤(n=4)这些非CRS病例中C-末端DUX 4表达情况。回顾性分析后,采用DUX4抗体对病例进行染色。当>50%肿瘤细胞检测到强核阳性表达时,DUX 4 IHC被认为阳性,未染色或仅细胞质染色被认为是DUX4免疫反应性阴性(表1)。运用NGS及FISH进行分子遗传学分析。两组队列病理学报告中记录了其他免疫组织化学标记物、辅助检查、患者年龄、性别和肿瘤位置相关的临床数据。
表1.两组队列中DUX4免疫组化在CIC-重排肉瘤和非CIC重排肿瘤中的表达情况
结果
CIC-重排肉瘤临床特征
队列1中19例CRS病例,包括12例女性和7例男性患者,年龄范围从<1岁至57岁(中位数=41岁)。此肿瘤最常累及四肢软组织(n=6)和躯干/骨盆轴(n=6)。队列2中确定了29例分子学证实的CRS病例,包括23例女性和6例男性患者,年龄范围为10~67岁(中位数=31 ± 15.6岁)。最常见的部位是四肢软组织(n=13),其次是躯干(n=7)。
组织形态学
在组织学上,CRS的特征是结构多样性和细胞形态比其他URCS更多样化。瘤细胞为实性巢片状具有高核质比的圆形细胞或在黏液样胶原基质中的梭形或上皮样细胞(图1A,B)。队列2的1例病例显示假腺泡模式(图1C)。常见地图状坏死(图1D)。在细胞学上,这些细胞含有圆形/卵圆形的核、染色质细腻和突出的核仁,并且显示出比其他URCS(如尤文肉瘤)更明显核的多形性(图1E,F)。
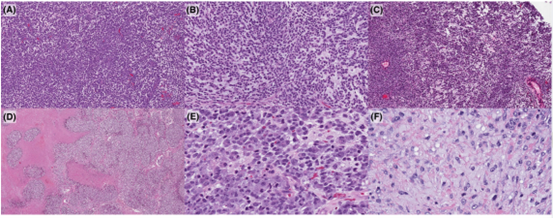
图1.CIC-重排肉瘤(CRS)的结构和细胞形态谱:实性巢状单一圆形细胞(A)、黏液样基质(B)、假腺泡型(C)和地图状坏死(D)。细胞形态学为上皮样细胞到梭形细胞(E、F),与其他URCS(如尤因肉瘤)相比具有更明显的多形性。
分子学发现
在队列1中,4例病例中使用CIC断裂探针通过FISH检测到CIC基因重排;另外15例病例中,靶向RNA测序作为独立方法或与FISH或甲基化谱联合进行显示CIC::DUX4在所有这些瘤细胞中融合。在队列2中,通过靶向RNA测序在28例病例中检测到CIC基因重排:27例病例显示CIC::DUX4融合,1例显示CIC::FOXO4融合。1例病例通过外部实验室进行的FISH分析证实了CIC基因重排。CIC::DUX4融合断裂点数据,最常见的外显子断裂点涉及CIC外显子20(NM_015125)和DUX4外显子1(NM_033178.4)(27/29,93%)。CIC 21和15外显子分别与DUX4外显子1融合各1例。
DUX4免疫组化表现
在CRS和非CRS病例中评价DUX 4核表达(表1)。队列1包括另外56例非CRS病例,如尤文肉瘤(18例)、腺泡状横纹肌肉瘤(12例)、促结缔组织增生性小圆细胞瘤(12例)和其他融合定义的实体肿瘤(表1),这些病例采用DUX 4 IHC进行回顾性染色。所有CRS(19/19)均表现出强且弥漫的核DUX 4表达(图2A-H),而非CRS病例中没有(0/56)表现出核表达。
在29例经分子学证实的CRS病例(队列2)中,21例进行了DUX4免疫组织化学染色,20例显示出强烈的弥漫性核DUX4表达。1例DUX4 IHC核染色阴性的CRS病例携带CIC::FOXO 4融合。

图2.来自两个独立机构的4个不同病例-队列1(A-D)和队列2(E-H)-证实了细胞核DUX 4表达。当该免疫组织化学标记物在细胞核中强而弥漫表达时,可作为CIC ∷ DUX 4融合的替代物。
在队列2的48例非CRS病例中,有3例上皮来源肿瘤(6%)、4例血液淋巴造血系统肿瘤(8%)和41例间叶源性(85%)肿瘤,包括26例小圆细胞肿瘤(表1),没有(0/48例)显示DUX 4的核染色。43例病例(89.6%)显示非特异性斑驳状至弥漫性胞质染色,5例病例(10.4%)完全DUX 4阴性 (图3A-J)。未鉴定出具有真正局灶性核DUX 4染色的病例。
结合两个队列数据表达情况,DUX 4 IHC诊断CRS伴CIC重排的敏感性和特异性分别为98%(39/40)和100%(104/104)。

图3.A-J,非CRS病例中的DUX 4表达:A,B,子宫内膜间质肉瘤病例中HE以及胞质DUX 4表达; C,D,上皮样肉瘤病例中HE以及胞质DUX 4表达; E,F,黑素瘤病例中HE以及胞质DUX 4表达; G,H,未分化癌HE以及细胞质DUX 4表达; I,J,弥漫性大B细胞淋巴瘤HE以及DUX 4表达完全缺失。
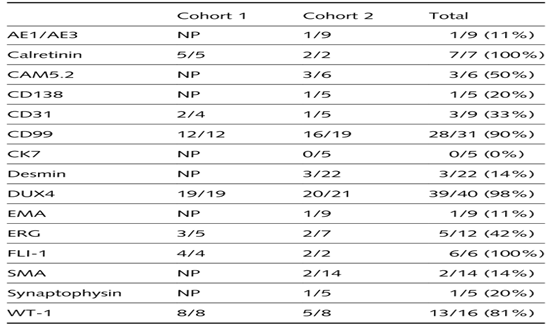
表2.CRS中表达的DUX4和其他免疫组化标记物情况
其他免疫标记物表达情况
两个队列的CRS病例中检查了其他免疫组织化学标志物(表2)。队列1中,CD 99(12/12;大部分为斑驳状)、WT-1(8/8)和FLI-1(4/4)在所有CRS病例中表达,而ERG表达占比分别为(3/5)60%和CD 31(2/4)50%。队列2中,在分子学证实的CRS病例中,CD 99(16/19)、WT-1(6/6)、FLI-1(2/2)和CAM 5.2(3/6)在≥50%的CRS病例中表达。
讨论
本研究报告了迄今为止最大规模的DUX4免疫组化在CRS中的诊断性能研究。在软组织病变诊断过程中,基于分子方法的广泛应用导致发现了大量融合定义的肿瘤实体,对于这类肿瘤的研究发现并证明了致癌蛋白作为致癌驱动因子的机制。基于这些致癌蛋白通常以显著高水平表达情况,证实免疫组织化学检测可以作为融合驱动肉瘤诊断的替代品,代表了一种比分子诊断更短周转时间更具成本效益的方法。这种免疫组化替代分子的检测方法已经证实的肿瘤还包括孤立性纤维性肿瘤STAT6 表达作为NAB 2::STAT 6基因融合的替代物,上皮样血管内皮瘤CAMTA 1表达提示WWTR 1::CAMTA 1基因融合,滑膜肉瘤SS 18-SSX 表达可替代SS 18::SSX 1/2/ 4基因融合和黏液样脂肪肉瘤DDIT 3表达代表具有FUS/EWSR 1::DDIT 3基因融合。
通过靶向嵌合蛋白中保守区域DUX 4抗体检测到CIC::DUX 4核表达,据此推断DUX 4抗体可以用作CIC基因重排的替代物。经研究证实,CRS的部分肿瘤实体细胞核DUX 4 I表达与CIC::DUX 4基因融合体之间存在完美相关性。此外,通过基因表达谱鉴定下游靶标,如ETV 4和WT-1也存在可识别的弥漫核表达情况,与DUX 4表达相似,具有90%敏感性和95%特异性。
本研究分析了DUX 4在两个不同实验室两组队列中具有CIC基因重排的CRS表达情况。在40例CRS病例中,1例细胞核DUX 4表达阴性的病例存在CIC::FOXO 4重排,表明该标记物对检测CIC::DUX 4融合具有特异性。由于CRS病例可能存在CIC重排,涉及DUX 4以外的多种基因伴侣,包括FOXO 4、NUTM 1、LEUTX等,以上这些替代融合伴侣在CIC肉瘤中是罕见的(约5%),故DUX 4表达缺失并不完全排除CRS可能。在没有DUX 4核反应性表达情况下,如果CRS仍然在鉴别诊断中,建议进行分子检测CIC基因重排存在可能。
有趣的是,在本研究中,CRS的一个子集表现出至少部分表达血管标记物,如ERG,CD31和FLI1。这一发现提示,CRS内具有血管分化特征的肿瘤实体是否应被归类为另一独特类型或变异性血管肉瘤。此种情况也可以应用DUX4 IHC表达情况进一步综合评估。
鉴于CIC和DUX4重排具有多种可变的外显子断裂点特性,应使用靶向CIC和DUX4不同探针来解释这种基因融合异质性。本研究中也存在此种CRS分子检测漏诊提示。例如,来自队列2中病例29免疫组化表现出强烈和弥漫性DUX 4表达,但最初使用靶向基因组不包括覆盖CIC外显子15断裂点的探针,当运用包括该外显子扩展的NGS面板时最终确认存在CIC::DUX 4融合。这突出提示C-末端DUX 4 IHC在诊断CIC::DUX 4肉瘤中的实用性价值。
与纤维瘤病中β--catenin 免疫组化评估类似,CIC-重排肉瘤阳性病例务必为DUX 4细胞核而不是细胞质表达。偶尔,DUX 4显著细胞质表达时可能被误认为核染色,这是由于切片不同平面所致。因此,为具有更好判断重复性,只有DUX 4核强而弥漫表达才应被认为是阳性。
由于DUX4 敏感性和特异性,特别是在有限活检病例中,诊断CRS已在一些病理中心无需分子确认。本研究实践中也已开始根据临床和组织病理学结果(包括通过IHC检测细胞核DUX4表达情况)对CRS进行诊断,而不使用分子检测。其局限性之一是,当强烈怀疑CRS时,将DUX4 IHC作为诊断检查方法会产生选择性偏倚。这种选择性偏倚可能导致该标记物的灵敏度和特异性的潜在提升。在未来的研究中,对该标志物的敏感性和特异性将进一步独立验证。
本研究未针对DUX 4 潜在缺陷在携带IGH::DUX 4或ERG::DUX 4融合的B细胞前体急性淋巴细胞白血病亚群中可能表达进行研究。在这类白血病中,融合基因失去DUX 4 3´端,最终在嵌合蛋白中DUX 4 C末端。由于本研究中用于检测DUX 4的抗体针为该蛋白的C末端,因此在这些白血病中其表达不显阳性。然而,靶向DUX 4的N-末端的不同克隆可以在DUX 4融合的白血病中阳性表达。因此,在选择和解释DUX 4抗体克隆时必须采取谨慎。
由于CRS为融合驱动性肿瘤,所以异常致癌蛋白或其下游靶标可以作为CIC基因重排的替代物。目前证据表明,从CIC和DUX 4之间融合衍生的嵌合蛋白除了保留大部分CIC蛋白结构域之外,还保留了DUX 4 C-末端结构域,所以CIC::DUX 4融合致癌蛋白驱动定位在DUX 4核。此外,CIC的C1和HMG基序以及DUX4的活化结构域保留在嵌合蛋白中,维持CIC的DNA结合能力。这最终导致DUX 4的核定位和CIC::DUX 4蛋白的矛盾致癌活性,其中它们相互作用并激活CIC结合基因靶点,例如PEA基因家族成员通过细胞周期蛋白E途径诱导细胞周期进程,并通过IGFR 1的过表达诱导细胞生长和迁移。
总之,本研究证明DUX4 IHC由于其较好的灵敏度和特异性,可用作CIC::DUX4融合基因存在的替代标志物。


















共0条评论