[导读] 译者:慧海拾穗
【前言】睾丸核蛋白(NUT)癌是一种低分化、高度侵袭性肿瘤,最初发现于青少年和年轻人的中线结构,其特征是t(15;19)易位导致NUT中线癌家族成员1(NUTM1)基因(15q14)重排,该基因也称为NUT基因。随后有大量NUT癌病例报道,年龄范围0-80岁,无明显性别差异。中线结构以外也可能发生,如大脑、甲状腺、唾液腺、胰腺和肾脏。基因组分析显示,大多数NUT癌含有BRD4::NUTM1融合(70%至80%),而其他不太常见的融合包括BRD3::NUTMl(15%)、NSD3::NUTMA1(6%)、ZNF家族成员(ZNF532和ZNF592)::NUTM1(2%)和未鉴定的伴侣基因(7%)。越来越多的证据表明,NUTM1重排不是NUT癌所特有。NUTM1重排已在一组具有非溴结构域伴侣、不同临床背景和组织病理学特征的异质性肿瘤中被发现。这些NUTM1重排肿瘤包括皮肤肿瘤、血液系统恶性肿瘤(婴儿和儿童急性淋巴细胞白血病),以及部分具有独特发病途径的未分化高级肉瘤,称为NUTM1重排肉瘤。由于缺乏特定的细胞系谱系,NUTM1重排肉瘤在很大程度上仍未得到充分认识。
【结果】NUTM1重排肉瘤8例,其中男2例、女6例;年龄24-64岁(平均年龄51岁、中位年龄56岁);发病部位包括结肠2例、空肠1例、腹腔2例、食管1例、肺1例、眼眶下软组织1例;诊断时远处转移6例;肿瘤大小1-10.5cm,平均6cm;组织学特征:4例由原始小圆细胞至上皮样细胞、混有多少不等梭形细胞组成;3例仅由小圆细胞至上皮样细胞组成;1例主要由高级别梭形细胞组成;肿瘤细胞呈实性片状、巢状或交叉束状排列;核分裂像1-15个/10HPF;其他形态学可见横纹肌样或核明显弯曲。免疫表型:NUT蛋白100%(8/8)核弥漫强阳性、AE1/AE3阳性(2/8例)、CK18阳性(1/8例)、CD99阳性(3/8例)、NKX2.2阳性(2/8例)、CyclinD1阳性(2/8例)、BCOR阳性(2/8例)、S-100阳性(1/8例)、TLE1阳性(1/8例)、Syn阳性(1/8例)。二代测序MXD4::NUTM1(3/7例)、MXI1::NUTM1(3/7例)、MGA::NUTM1(1/7例),另一例存在FISH检测NUTM1基因重排阳性(伙伴基因不明,组织有限未做RNA测序)。随访4-24月,1例在8.5月时复发,4例在诊断后的5月、10月、11月和24月时转移,3例无复发和转移表现。
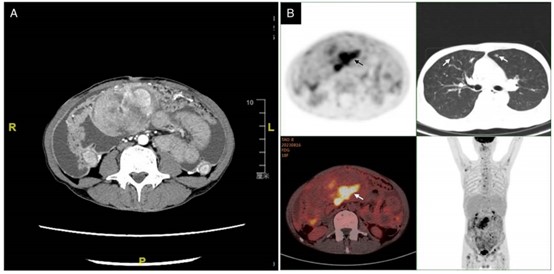
图1.术前影像学检查。CT显示,起源于肠道的腹部不均匀肿块边界不清(A)。PET-CT扫描显示腹部、肺部(白色箭头)和骨骼存在多发性转移性疾病(B)。

图2.发生于空肠累及肠壁,中心区域显示广泛的玻璃样变(A)。食管肿瘤固有肌层弥漫性浸润(B)。1例出现黏膜受累(C)。3例出现腹部播散(D)。肿瘤累及眶下区软组织(E)。肺部肿瘤的原发灶表现为相对局限的结节(插图,CT扫描)(F)。

图3.组织学特征。结肠肉瘤由小圆细胞、上皮样细胞和梭形细胞混合而成(A)。食管肉瘤仅由原始的小蓝圆细胞组成,类似于未分化的小圆细胞肉瘤(B)。空肠肉瘤由上皮样细胞巢组成,核呈圆形空泡状,核仁明显(C)。横纹肌样肿瘤细胞通常表现出黏附性生长模式(D)。原发性肺肿瘤中的肿瘤细胞显示出明显的核卷曲(E)。单一的梭形细胞呈束状排列,类似于单相型滑膜肉瘤(F)。
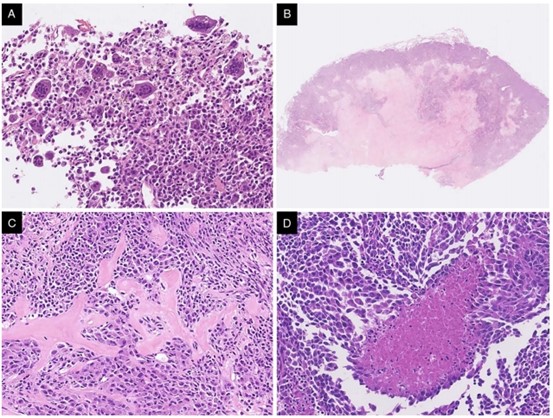
图4.组织学特征。肺肉瘤显示局灶存在破骨细胞样多核巨细胞(A)。同一肿瘤的特征是明显的中央透明带(B),间质有“石棉样”纤维(C)。一例结肠肉瘤有局灶坏死(D)。
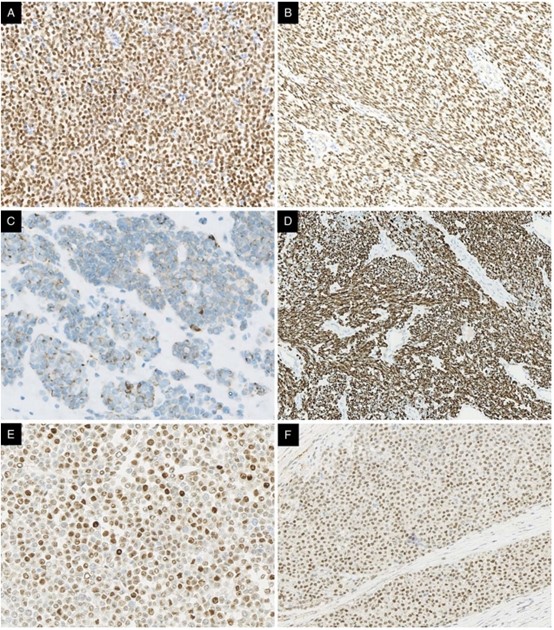
图5.免疫组织化学染色。所有肿瘤在圆细胞肉瘤(A)和梭形细胞肉瘤(B)中均显示弥漫强NUT核染色。细胞角蛋白在2例肿瘤中相对局灶和较弱表达(C)。2例肿瘤均显示结蛋白(D)、细胞周期蛋白D1(E)和BCOR(F)的异常染色,这可能是诊断的陷阱。
【讨论】 NUTM1重排肿瘤包括一组具有不同临床和病理特征但共享NUTM1易位的异质性肿瘤。其中,NUTM1重排肉瘤代表了一种新兴实体,值得作为NUTM1重排肿瘤家族中的一种独特肿瘤类型将其分开。除1例重复报告外,2例后来重新分类为NUT癌,以及具有不同发病机制的CIC::NUTM1融合阳性肉瘤,迄今为止,英文文献中已报道了约30例NUTM1重排肉瘤,其中大多数是病例报道或病例较少。在这项研究中,我们介绍了8例发生在不同软组织和内脏器官的NUTM1重排肉瘤的经验。包括目前报道共有38例具有组织病理学资料和免疫表型。总之,患者发病年龄在3至78岁之间(中位年龄:47.5岁;平均年龄:42岁),无明显性别差异(女性18例、男性20例)。12例肿瘤(31.6%)发生在躯体软组织中,其中6例发生在四肢(大腿3例、足2例和上臂1例),4例发生在腹部/骨盆软组织,2例发生在头颈部(眼眶和头皮)。11例(28.9%)发生在胃肠道,其中7例发生在结肠/盲肠/回盲部,2例发生在胃,食管和空肠各1例。7例(18.4%)发生在胸部,其中4例发生在肺部,3例发生在胸部和胸膜。4例(10.5%)发生在泌尿生殖道(膀胱2例、卵巢和阴茎各1例),2例(5.3%)发生在中枢神经系统(顶叶和硬脑膜)。
NUTM1重排肉瘤的组织学表现不一,显示出纯的或原始小圆细胞、上皮样细胞到横纹肌样细胞和梭形细胞混合,在病例内和病例之间差异很大。38例中,梭形细胞肉瘤14例(36.8%),原始小圆细胞至上皮样细胞14例(36.8%),梭形、小圆细胞和上皮样细胞混合型10例(26.3%)。如我们的病例所示,原始的小圆细胞胞质稀少,核呈圆形至卵圆形,染色质深,没有或有小核仁,让人联想到未分化小圆细胞肿瘤或淋巴造血肿瘤。上皮样细胞形态学肿瘤的特征是多边形细胞含有丰富的细胞质,核圆形位于中央,核仁突出。横纹肌样征细胞10例(26.3%),细胞比例可高达90%。小圆细胞和上皮样细胞呈片状、大小不等的巢状、小梁状或单行状排列。梭形细胞形态比较一致,多形性很小,含有少量嗜酸性胞质和小核仁。瘤细胞通常呈交叉或束状排列,经常显示鱼骨样结构,类似于纤维肉瘤或单相型滑膜肉瘤。虽然大多数肿瘤表现为高级别形态,但也有少数病例表现为低级别或中等级别的组织学形态。核分裂像范围为1至>10个/10 HPF(中位数:4至5个/10 HPF)。8例(21%)出现不同程度的坏死。值得注意的是,15例(39.5%)存在不同数量的瘤内玻璃样变区域,5例出现石棉样纤维或胶原菊形团。9例(23.7%)具有黏液样基质。其他特征包括散在的多核肿瘤巨细胞、破骨细胞样多核巨细胞和菊形团形成。
在NUT癌中,NUT免疫组织化学已被证明具有100%的特异性和87%的敏感性。在NUTM1重排肉瘤中,91.4%病例(32/35)不同程度和强度的表达NUT蛋白。虽然大多数病例在>75%的肿瘤细胞中显示出均匀的核染色模式,但也有少数病例显示出弱阳性或多灶弱阳性。3例NUT蛋白阴性表达。推测转录后机制可能是NUT免疫组织化学假阴性的原因。11例(28.9%)表达角蛋白(包括AE1/AE3、CK18和CAM5.2),大多数病例细胞呈局灶或罕见细胞阳性染色,2例细胞呈相对弥漫阳性(>50%的细胞)。一个有趣的发现是4例表达BCOR,这可能导致考虑BCOR基因改变的肉瘤。3例BCOR阳性NUTM1重排肉瘤携带MGA::NUTM1融合,1例携带MXD4::NUTMA1融合。此外,还有2例表达MUC4,这可能会与低度恶性纤维黏液样肉瘤或硬化性上皮样纤维肉瘤相混淆。其他抗体表达不一,包括CD99、NKX2.2、desmin、突触素(Syn)、神经元特异性烯醇化酶(NSE)、胶质纤维酸性蛋白(GFAP)、神经丝蛋白(NF)、S100、cyclinD1、FLI1、TLE1、NKX2.3、CD56、ERG、SMA、calponin、bcl-2、CD34、p63、ER和PR被认为是非特异性的。除了一例下颌骨肿瘤表达MYC外,NUTM1重排肉瘤通常不表达对NUT癌发生至关重要的蛋白MYC、TP63或SOX2。
在分子水平上,NUTM1重排肉瘤中NUTM1的伴侣主要涉及MYC拮抗剂MAX二聚化(MAD)基因家族的成员。最常见的是MGA(13/35,37.1%)和MXD4(10/35,28.6%)。不太常见的是MXI1(或MXD2)(6/35,17.1%)和MXD1(1/35,2.9%)。其他罕见的伴侣基因包括BRD4(2/35,5.7%)、BRD3(1/35,2.9%)、BCORL1(1/35、2.9%)和ZNF53::NUTM1(1/35)。3例病例的融合伴侣未知。报道的MGA::NUTM1肉瘤发生于软组织(大腿、脚、骨盆、头颈部)、胸部(肺、胸部和胸膜)和硬脑膜。MXD4::NUTM1肉瘤好发于胃肠道(结肠和空肠),其次是泌尿生殖道(阴茎和卵巢)和腹部。有6例MXI1(MXD2)::NUTM1肉瘤,分别发生在食管、胃食管交界处、横结肠、膀胱和腹部(n=2)。一例胃肉瘤存在MXD1::NUTM1融合。BCORL1::NUTM1肉瘤表现为一名45岁男性上臂肌肉内病变。肿瘤具有梭形和上皮样细胞形态,伴有玻璃样变基质和局灶菊形团形成,NUT蛋白呈假阴性反应,但NUTM1 mRNA表达显著,表明存在转录后修饰。BRD3::NUTM1和BRD4::NUTM1肉瘤分别发生在61岁男性的大腿、3岁男孩的顶叶和10岁男孩的髂骨。ZNF53::NUTM1肉瘤发生于一名21岁女性下颌骨。值得注意的是,一小部分未分化的圆细胞肉瘤含有CIC::NUTM1融合。这些肿瘤的转录组特征与CIC::DUX4和CIC::FOXO4肉瘤相似,在临床和组织学上与NUTM1重排肉瘤不同。CIC::NUTM1肉瘤更适合归类为CIC重排肉瘤的分子变异型。
NUTM1重排肉瘤的鉴别诊断在很大程度上取决于组织学模式和病变部位。主要由原始小圆细胞组成的肿瘤应与USRCS(特别是尤文氏肉瘤、BCOR改变肉瘤和CIC重排肉瘤)、淋巴造血肿瘤和分化较差的神经内分泌癌区分开来。具有未分化上皮样至横纹肌样形态的肿瘤需要与NUT癌、未分化癌、SMARCB1(INI1)缺陷或SMARCA4缺陷癌/未分化肿瘤、上皮样胃肠道间质瘤、恶性胃肠神经外胚层肿瘤、硬化性上皮样纤维肉瘤和骨外骨肉瘤进行鉴别。对于高级别梭形细胞肉瘤,鉴别诊断主要涉及非特指型高级别梭形细胞肉瘤(high-grade spindle cell sarcoma, not otherwise specified)、肉瘤样癌、单形性滑膜肉瘤、恶性周围神经鞘瘤、纤维肉瘤和骨外黏液样软骨肉瘤。低级别梭形肿瘤还应包括低度恶性纤维黏液样肉瘤,因为少数NUTM1重排肉瘤也表达MUC4,并伴有基质黏液样改变。梭形细胞和上皮样细胞混合的肿瘤,特别是玻璃样变基质的肿瘤,应与肌上皮肿瘤进行鉴别。相关的鉴别诊断在之前的报道中已有详细描述。鉴于NUTM1重排肉瘤缺乏特定的细胞系谱系,建议在诊断具有原始小圆、上皮样到高级梭形细胞形态的未分化肿瘤时,免疫组化应选择包含NUT在内的蛋白检测。我们对2例病例的初步DNA甲基化分析表明,NUTM1重排肉瘤的甲基化谱不同于NUT癌、尤文肉瘤、BCOR改变肉瘤、CIC重排肉瘤和未分化梭形和圆细胞肉瘤。然而,需要更多的病例来验证基于DNA的甲基化分类对未分化肉瘤病变的潜在作用。
与NUT癌的高度侵袭性行为相反,无论分子亚群和解剖部位如何,NUTM1重排肉瘤的临床病程在病例之间差异很大,从快速致死(3个月)到长期生存期(15年)不等。然而,该肿瘤的特点是高转移率和肿瘤相关死亡率。在34例有临床资料的病例中,21例(61.8%)有转移性疾病,包括11例多发性转移。值得注意的是,13名患者在初次就诊时就有转移。转移性部位包括淋巴结、肝脏、肺和腹腔/腹膜腔,其次是软组织、脑、胸膜和脾脏。5名患者(14.7%)出现局部复发。9名患者(26.5%)在诊断后3个月至7年内(中位数:13个月)死于该疾病。然而,包括我们报道的病例,一些病例的临床随访时间相对较短。有必要积累更多的足够随访时间的病例,以进一步评估这种罕见肿瘤的生物学行为。应该指出的是,肿瘤分级似乎对预后没有影响,因为低级别肿瘤也会在短时间内发展为多个转移灶。
MAD::NUTM1的致癌作用尚未完全阐明。虽然新型BET抑制剂可能有益于携带BRD::NUTM1融合的患者,但它们可能对涉及MAD家族基因的NUTM1重排肉瘤患者无效。目前,多模式治疗仍然是NUTM1重排肉瘤的合理治疗方法。进一步的研究对于揭示潜在的分子机制和开发NUTM1或MAD靶点的潜在抑制剂以对抗该疾病至关重要。
总之,NUTM1重排肉瘤是NUTM1重排肿瘤家族中的一个新兴实体。考虑到诊断和治疗因素,识别NUTM1重排肉瘤非常重要。大多数实验室都可以获得NUT抗体,当处理具有单一小圆、上皮样细胞和梭形细胞形态的未分化肿瘤时,建议使用NUT抗体。尽管对常规使用的抗体进行了广泛的免疫组织化学研究,但这些表型仍难以分类。基于DNA的甲基化分析可能有助于对具有重叠免疫表型的未分化肉瘤进行表观遗传学分类。
点此下载原文献
[1]Expanding the Spectrum of NUTM1-Rearranged Sarcoma : A Clinicopathologic and Molecular Genetic Study of 8 Cases


















共0条评论