摘要
目的:原发性纵隔生殖细胞肿瘤(PMGCT)罕见,活检小样本可能诊断困难。本研究试图研发一种诊断程序,使用免疫组化染色,重点是新的标记物和等臂染色体12 p [i(12 p)]的分子分析。方法与结果:对32例纵隔肿瘤石蜡包埋组织进行SALL 4)、LIN 28、OCT 3/4、D2-40、CD 117)、SOX 17、SOX 2、CD30、β-hCG、GATA 3、FOXA 2、GPC 3、AFP、TdT、NUT和pCK染色。采用RT-PCR检测i(12 p)的分子情况。包括15例精原细胞瘤,7例畸胎瘤,1例卵黄囊瘤,1例绒毛膜癌和7例混合型PMGCT。不同实体肿瘤具有不同的免疫组化染色模式:OCT 3/4,D2-40,CD 117和TdT用于诊断精原细胞瘤; OCT 3/4和SOX 2用于提示胚胎性癌; FOXA 2,GPC 3和AFP用于诊断卵黄囊瘤;和β-hCG和GATA 3用于提示绒毛膜癌。成熟畸胎瘤上皮成分中的PCK染色阳性,SALL 4、SOX 2、GATA 3、D2-40和FOXA 2局部染色阳性。此外,诊断出1例类似PMGCT的NUT癌,显示出SOX 2强的核染色和NUT斑点状核染色。27例PMGCT中24例(89%)检测到i(12 p)。结论:活检小样本明确诊断PMGCT非常重要,除了形态学特征之外,通常还需要3-4种抗体组合来鉴定正确的组织学亚型。i(12p)分子检测也是提示生殖细胞来源的重要指标。
结果
32例(3女29男)原发性纵隔肿瘤,年龄9 ~ 69岁,平均34.25岁。共18例SEM(56.3%),其中3例为混合型PMGCT,EC混合比例较小(分别约为5%和15%);7例成熟TER(21.9%)(2例青春期前和5例青春期后);2例CC(6.3%),其中1例为混合型PMGCT,EC混合比例较小(约5%);1例YST(3.2%)。此外,还检测到3例混合型PMGCT(9.4%),由两种以上亚型组成(表1)。此外,1例最初考虑PMGCT被证明是NUT癌。被研究肿瘤的免疫组织化学染色表达模式总结见(表2)。
表1.原发性纵隔肿瘤的组织学亚型及其12 p [i(12 p)]染色体情况

CC:绒毛膜癌; EC,胚胎癌; mTER,成熟畸胎瘤; NSGCT,非精原细胞瘤性生殖细胞肿瘤; PMGCT,原发性纵隔生殖细胞肿瘤; SEM,精原细胞瘤; YST,卵黄囊瘤;Mixed PMGCT混合型生殖细胞肿瘤;NUT carcinoma,NUT癌。
*由于技术问题,定量实时聚合酶链反应在某些情况下不可行。
表2.原发性纵隔生殖细胞肿瘤成分的免疫组织化学染色模式[n(%)]
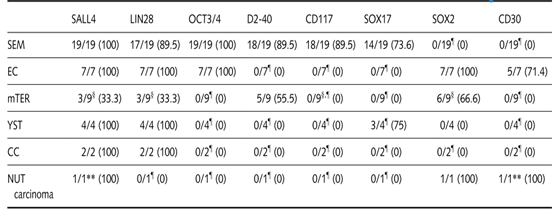
* 由于技术问题,并非所有病例都能染色。†点状膜或核周染色。‡16例阳性病例中4例为单个细胞表达。§仅在一些上皮结构中有阳性。¶在肠分化组织(例如胰腺腺泡和肠粘膜)中FOXA 2阳性。** 仅在一小部分肿瘤细胞中呈阳性。
组织学和免疫组织化学特征
原发性纵隔精原细胞瘤(SEM)
SEM由中等大小的多边形细胞组成,具有片状或索状生长模式。纤细的纤维间隔将肿瘤细胞分成小叶。肿瘤细胞边界清晰,透明至淡染或轻度嗜酸性细胞质,以及偏心细胞核,具有一个或多个突出的核仁(图1A)。19例中有6例(31.6%)可见非坏死性肉芽肿性炎症,包括上皮样组织细胞和罕见的朗汉斯型多核巨细胞(图1B),可检测到淋巴细胞浸润和小面积坏死。
在所有情况下,几乎所有SEM细胞均显示出强的细胞核SALL 4染色(图1C)和弱的细胞质LIN 28染色(图1D)。OCT 3/4显示出强核染色(图1 E),D2-40显示出强膜染色(图1F)。CD 117显示较弱的膜染色。在19例病例中的14例(73%)中,大多数肿瘤细胞显示出比OCT 3/4稍弱的SOX 17核染色(图1G)。在14例(73%)中,存在PCK的点状染色(图1H)。此外,有5例(26.3%)有单个β-HCG阳性合体滋养层细胞(图1 I)。此外,19例SEM成分中有16例(84.2%)显示TdT染色阳性,12例样本(63.2%)的细胞核染色较强(图1 J)。
原发性纵隔胚胎性癌(EC)
混合型PMGCT中EC细胞检出率为87.5%。本研究中只有1例(12.5%)通过组织形态学直接诊断为EC,瘤细胞胞质淡染、细胞核中等大小、核突出仁,排列呈腺样或柱状结构。其他病例均通过免疫组化确诊,OCT 3/4(100%)、SOX 2(100%)和CD 30(71.4%)呈阳性(图1 K,L)。在混合型PMGCT中分别有5%、15%和20%的肿瘤细胞发现了该三种抗体标志物组合阳性(表1)。所有病例瘤细胞也表达SALL 4(100%)和LIN 28(100%)。
原发性纵隔卵黄囊瘤(YST)
本研究检测到1例单纯原发性纵隔YST和3例混合原发性纵隔YST(表1)。混合YST为微囊和内胚窦模式,而纯YST主要表现为实性生长模式,只有小微囊区。实性区域被纤维间隔和嗜酸性基底膜分割(图2A、B),伴有局灶性坏死。肿瘤细胞呈立方形至多边形,胞质稀少。细胞核呈卵圆形,核膜不规则,含有一个或多个显著的嗜酸性核仁和病理性核分裂。此外,实性模式YST含有一些散在的瘤巨细胞和单个多核肿瘤细胞。
所有四种情况下的YST组分对干细胞标志物SALL 4(100%)(图2C)和LIN 28(100%)呈阳性。此外,所有四种情况下的每个细胞都显示出F0XA 2的强核染色(100%)和GPC 3的胞质染色(100%)(图2D,E)和PCK(100%)。实性模式的YST含有非常少的AFP阳性细胞(图2F),而所有混合型PMGCT中的YST组分显示出强烈的AFP阳性细胞(图2F)。YST中所有类型的细胞均为β-hCG阴性。此外,其中一种混合型PMGCT中的YST组分70%的肿瘤细胞中显示出GATA 3的强核染色,在约50%的肿瘤细胞中显示出SOX 17的弥漫染色。
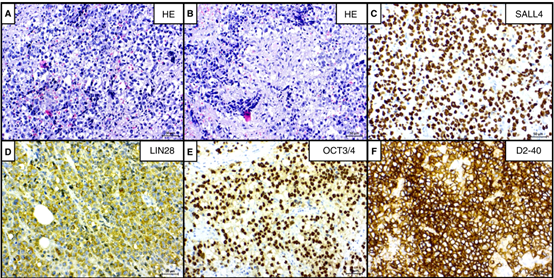

图1.原发性纵隔精原细胞瘤(SEM)。A,中等大小的肿瘤细胞,细胞质稀少,核明显偏心。B,显著的淋巴细胞浸润和肉芽肿性炎症,伴上皮样细胞肉芽肿形成。C、D,SALL 4强核染色和LIN 28阳性。E、F,OCT3/4和D2-40阳性。G,SOX 17阳性。H,纵隔SEM细胞中CK的点状阳性。I,β-hCG阳性。J,SEM细胞中的强核TdT染色。K,L,SOX 2和CD 30的散在单细胞染色,类似胚胎癌细胞。

图2.原发性纵隔卵黄囊瘤(YST)。A、B,YST伴实性生长模式和纤维间隔,以及重度异型性和多核瘤巨细胞。C,所有大小的肿瘤细胞显示SALL 4染色。D、E,几乎所有肿瘤细胞显示FOXA 2染色和GPC染色。F,实体生长模式的YST下,仅少数肿瘤细胞呈AFP单细胞阳性。
原发性纵隔CC
2例纵隔CC(一种纯CC,一种与EC混合)均显示丛状或实体生长模式,由三种不同的细胞类型组成,包括细胞滋养细胞、中间滋养细胞和合体滋养细胞(图3A)。合体滋养细胞为巨细胞,多形核,深染,胞浆浓嗜酸性,位于滋养细胞之间,多角形,核圆形,核仁突出。所有细胞类型均显示出强的核SALL 4染色,但仅在一些细胞滋养细胞中显示出较弱的细胞质LIN 28染色(图3B、C)。β-hCG在所有肿瘤细胞中显示阳性,GATA 3在大多数细胞中显示强核染色,并且PCK在所有肿瘤细胞中显示强阳性(100%)(图3D-F)。在1例病例中,仅在部分细胞中观察到GPC 3染色。
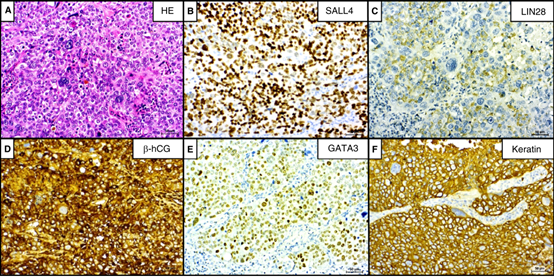
图3.原发性纵隔绒毛膜癌(CC)。A,瘤细胞实性片状,细纤维间隔分割,由细胞滋养细胞、中间滋养细胞和合体滋养细胞组成。B,核SALL 4强染色。C,除中间滋养细胞和合体滋养细胞外,一些细胞滋养细胞中存在弱的LIN 28染色。D,β-hCG在所有细胞类型中均检测到,尤其在合体滋养细胞中。E,GATA 3在大多数细胞中呈核阳性表达。F,CC细胞显示出CK的强膜染色。
原发性纵隔TER
本研究检测到2例青春期前和5例青春期后成熟的TER,和2例混合型PMGCT具有成熟性畸胎瘤成分。在组织学上,所有病例均显示两个或三个胚层,包括表皮组织、真皮附属器、支气管粘膜、腺体和软骨、胃肠粘膜、平滑肌细胞和外分泌胰腺组织(图4A-D)。
成熟TER唯一的免疫组化标记物显示一致阳性是CK在上皮细胞表达。5/9例(55.5%)在胰腺腺泡或肠粘膜上皮细胞中观察到阳性细胞核FOXA 2染色。3/9病例(33.3%)在上皮中显示弱的细胞核SALL 4染色和弱的细胞质LIN 28染色(图4 E、F)。另外5/9病例(55.5%)在上皮结构和淋巴管中显示D2-40染色,并且6/9病例(66.6%)还在上皮结构中显示中度核S0X 2染色(图4G)。一些病例还显示GATA 3(22.2%)、β-hCG(11.1%)和GPC 3(44.4%)阳性(图4 H,I)。
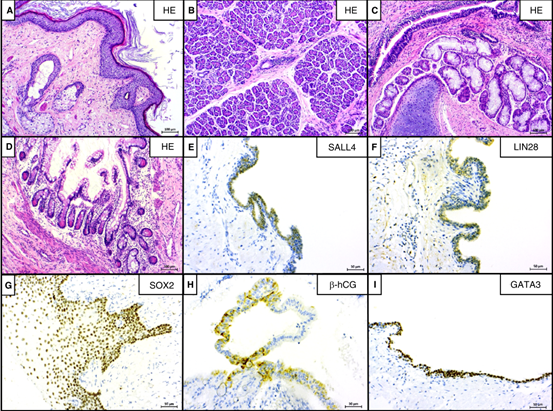
图4.原发性纵隔成熟畸胎瘤。A,表皮和真皮组织及真皮附件。B,胰腺组织及导管和腺泡。C、呼吸上皮、浆液粘液腺和透明软骨。D,肠上皮细胞、杯状细胞、Paneth细胞和上皮下淋巴细胞。E-H,一些上皮成分表达SALL 4(E)、LIN 28(F)、SOX 2(G)、β-hCG(H)和GATA 3呈阳性(I)。
纵隔NUT癌
肿瘤主要呈巢片状生长,可见纤维间隔,有明显的嗜中性粒细胞浸润和坏死区域。瘤细胞中等-较大,具有少量嗜碱或透明细胞质,核大、空泡状、核仁突出(图5A)。只有少数细胞显示SALL4染色(图5 B),而LIN 28为阴性。几乎所有的肿瘤细胞都显示出强的核SOX 2染色(图5C),而OCT 3/4完全阴性。由于这些结果,进行NUT染色,并且在>70%的肿瘤细胞中显示斑点状核染色(图5D)。大多数肿瘤细胞显示CK(图5E)、p40(图5 F)和p63(图5G)染色。这些结果表明是NUT癌。一些单细胞还显示出CD 30(图5 H)和β-hCG(图5 I)染色。
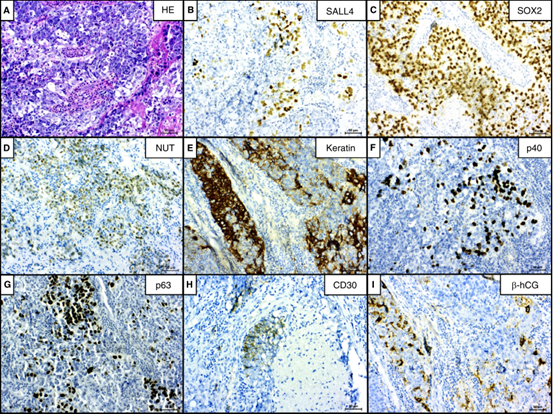
图5.纵隔NUT癌。A,中等大小肿瘤细胞的实性巢,胞质稀少而清晰,核仁突出,纤细的纤维分隔肿瘤细胞巢,可见明显的中性粒细胞浸润。B,一些肿瘤细胞强阳性表达的SALL 4。C,几乎所有肿瘤细胞强SOX 2核染色。D,约70%的肿瘤细胞斑驳表达核NUT染色,这是NUT癌的特征。E,部分强CK膜染色。F、G,多数肿瘤细胞核p40、p63染色阳性。H,肿瘤内的小灶显示CD 30膜染色。Ⅰ,少数细胞还表达β-hCG染色。
i(12 p)定量PCR检测
28/32例(87.5%)进行了i(12 p)定量PCR检测。由于组织量不足,4例无法进行研究。24/27例(89%)检测到i(12 p)(表1)。i(12 p)阴性病例包括3例PMGCT(1例SEM和2例青春期前纵隔TER)和NUT癌。
PMGCT的诊断程序
纵隔肿瘤性病变患者血清肿瘤标志物AFP或人β-hCG水平显著升高表明存在PMGCT。如果需要活检才能做出正确诊断,形态学特征可存在单纯或混合型PMGCT的诊断。在具有严重坏死区域或烧灼假象的活检中,诊断可能很困难。因此,常常需要不同的标记物组合来检测不同的PMGCT亚型。通过修改Bremmer等人建立的免疫组织化学程序,研发了PMGCT的诊断程序。本研究增加了i(12 p)的诊断特征、形态学特征和分子研究,并专注于每种类型的更特异的免疫组织化学标记物,如纵隔肿瘤具有不确定的GCT样形态学特征时,则可通过SALL 4(或另外LIN 28)的免疫染色来确认为GCO。之后,在基本明确为PMGCT的情况下,应使用OCT 3/4染色来判定SEM或EC,再通过D2-40和SOX2进一步区分SEM和EC。如本研究所示,一些SEM含有类似EC细胞的SOX 2阳性细胞。在OCT 3/4阴性肿瘤中,FOXA 2、GPC 3和AFP染色可明确YST,β-hCG染色结合GATA 3染色可确认为CC。FOXA 2是最近描述的标记物,对于含有较少的YST成分高度特异。成熟的TER通常可以根据其典型形态学进行诊断。在疑难病例中,例如未成熟的TER或疑似SMT的肿瘤,i(12 p)的分子检测有助于确认GCO。
讨论
原发性纵隔肿瘤,包括胸腺瘤、胸腺癌、淋巴瘤、软组织肿瘤、神经源性肿瘤、甲状腺肿瘤、GCT或特殊实体(如NUT癌)非常罕见,因此必须与转移肿瘤区分开来。肿瘤的正确诊断对于精准治疗和预后非常重要。PMGCT的诊断通常是根据临床特征和血清标志物水平升高,但需要排除睾丸GCT转移所致。免疫组织化学染色通常是形态学特征不确定时,需要识别所有肿瘤成分或进行亚型分型。本研究改良创建PMGCT的诊断程序,包括形态学特征,免疫组织化学和分子分析。
PMGCTS的几种类型
纵隔SEM与睾丸SEM具有相同的形态学特征,但很少显示囊性改变。如果肉芽肿性炎症突出并隐藏SEM细胞,则可能导致肉芽肿性疾病如结节病或结核病的错误诊断。 SEM可以通过OCT 3/4和另一种标志物D2-40抗体阳性来证实,由于两者都具有类似精原细胞瘤GCT亚型,因此EC也对OCT 3/4呈阳性。 D2-40对SEM比CD 117更敏感和特异,CD 117在其他纵隔肿瘤中可能呈阳性(例如胸腺癌和黑色素瘤)。此外,D2-40在血管淋巴管和间皮肿瘤中可呈阳性,或在NSGCT中显示局灶性弱阳性。此外,SOX 2和SOX 17也可用于区分SEM和EC。SOX 2是EC的最佳标记物,因为它仅在EC中表达,在SEM中被抑制。然而,SOX 17在YST中也可以呈阳性表达。不推荐使用CD 30检测纵隔EC,因为它的特异性低于SOX 2,并且在大多数流行的纵隔B细胞淋巴瘤中呈阳性(例如霍奇金淋巴瘤和原发性纵隔大B细胞淋巴瘤)。SMARCA 4缺陷型肿瘤应被视为OCT 3/4阴性、SALL 4和SOX 2阳性肿瘤的鉴别诊断。 SEM中单个β-hCG阳性细胞类似于合体滋养细胞,可导致血清β-hCG水平升高,但不应诊断为混合型PMGCT。包括本研究在内的几项研究表明,GCT或PMGCT具有较强的核TdT免疫反应性。这在纵隔活检中诊断比较困难,因为正常胸腺组织、胸腺瘤和T淋巴母细胞淋巴瘤/白血病中TdT也持续阳性,故需结合其他标志物支持纵隔SEM的诊断。纵隔SEM显示CK特定点状染色模式,而睾丸SEM显示膜染色。在鉴别诊断中应认识到这一点,因为它与大多数胸腺瘤和胸腺癌强和弥漫CK染色需要鉴别开。YST显示出多种组织学模式(即微囊或大囊,腺泡,假乳头状、粘液瘤、肝样、卵黄样、肠型、实性和梭形),通常由一种以上的模式组成。 YST以实性生长模式为主需要与其他NSGCT区分开来,并且可以显示阴性AFP免疫反应性,因为AFP的灵敏度仅为60%。因此,FOXA 2和GPC 3是诊断YST较AFP敏感和特异的标志物。最近研究表明,FOXA 2在YST细胞系中的表达和在YST组织标本中的强核染色已经证明它是一种可靠的标记蛋白。此外,FOXA 2在区分YST和CC方面更具特异性,因为CC可以对GPC 3呈阳性,并且其核染色比GPC 3的细胞质染色更容易识别。然而,应进一步行β-hCG染色以识别或排除CC。如YST仅包含类似于合体滋养细胞的单个β-hCG阳性细胞,混合型PMGCT的诊断则不明确。此外,GATA 3是CC的另一个标志物,但YST也可能呈阳性GATA 3染色。因此,需要排除其他GATA 3阳性肿瘤(如乳腺癌或尿路上皮癌的转移)。总之,需要结合标记物来明确诊断YST和CC,因为两者没有特异性的独立标记物。
如果TER由成熟组织组成,则可以根据形态学容易诊断。不成熟的TER可能很难在形态上与不同的纵膈肿瘤(例如神经源性肿瘤)或不同的YST模式区分开来,这也是因为GPC 3染色呈阳性。畸胎瘤也可表现出SMT,因此类似于其他恶性肿瘤。由于许多标志物(例如FOXA 2、SALL 4、LIN 28、D2-40、SOX 2、β-hCG和GATA 3)在畸胎瘤中均可为局灶性阳性,因此诊断时必须谨慎。
GCO的确定
如果需要确定GCO,则SALL 4是最敏感的标志物,因为它在所有PMGCT亚型(不包括TER)中始终显示强核染色,这也得到了本研究的证实(表2)。然而,重要的是要考虑到,少数腺癌或其转移瘤病例和具有SMT的PMGCT可能对SALL 4也呈阳性。Cao等人表明,另一种生殖细胞标志物LIN 28对SEM和YST的敏感性与SALL 4相似,对性腺外YST的敏感性略高,但对性腺和性腺外CC的敏感性较低。这与我们的结果不完全一致,因为SALL 4阳性的病例多于LIN 28阳性的病例。因此,LIN28可用作辅助的生殖细胞标记物。
此外,i(12 p)或12 p染色体的获得是II型GCT中最重要且几乎是唯一的特异性分子改变之一。在其他实体恶性肿瘤中很少检测到,但可在无论原发部位和患有SMT的绝大多数GCT亚型中确定。由于荧光原位杂交(FISH)分析尚未广泛使用,本研究之前开发了qPCR分析来检测睾丸GCT中的i(12 p)。在89%的PMGCT中检测到i(12 p),前后研究的结果一致。此外,i(12p)检测在具有少量提取的DNA的小组织活检中也是可能的,甚至在仅具有少量存活肿瘤细胞的样品中也是可行的。Gurda等人通过FISH分析确定骶尾骨成熟TER和Kao等人描述的纵隔TER中缺乏i(12 p)。
纵隔NUT癌
最初诊断为EC的病例(病例11;表1;图5)最终诊断为NUT癌。这种侵袭性、低分化的癌伴常见的鳞状细胞分化,可以模仿其他不同的恶性肿瘤。 NUT癌通常发生在中线上皮结构(如鼻窦、气道、纵隔和膀胱),但也可发生在全身。它们通常具有平衡的t(15; 19)15号染色体上的NUT或NUTM 1与19号染色体上的BRD 4易位,导致SOX 2表达增加。本研究中,PMGCT的相似形态学特征和重叠免疫染色(SOX 2,SALL 4,CD 30和β-hCG)最初导致混淆而没有诊断为NUT癌。NUT癌的诊断可以通过特征性斑点状核NUT免疫染色来证实。SALL 4、CD 30和β-hCG的局灶性阳性在文献中尚未描述,未来的研究应更密切地关注这些发现。此外,一些GCT可以显示阳性局灶性NUT染色(<10%的肿瘤),这在本研究任何病例中都没有检测到(表4)。血清标志物(例如AFP和β-hCG)水平的轻微升高并不能排除NUT癌。因此,这两种标志物对于GCT检测的特异性和灵敏度有限,除非其标记物水平高度升高。miR 371 a-3 p是一种即将出现的血清标志物,其对所有睾丸GCT亚型(TER除外)的敏感性和特异性均高于AFP和β-hCG。
结论
本研究研发出诊断程序能够可靠地诊断PMGCT,尤其适用于活检小组织。除了形态学特征之外,通常还需要3-4种抗体的组合来进行正确的亚型分型。一些标记物必须仔细评估,因为与其他纵隔肿瘤重叠。i(12 p)分析即使在小活检样本中也可作为在选定病例中检测GCO的额外选择,qPCR也是一种有用的工具。最后,纵隔NUT癌可能是潜在的诊断陷阱,因为其与其他类型具有重叠的形态学和免疫染色,务必仔细。
点此下载原文献





















共0条评论