[导读] 译者:慧海拾穗
文献来源:Feng X, Tao J, He N, et al. ALK-positive histiocytosis in 12 Asian children. Hum Pathol. 2024 Oct;152:105637. doi: 10.1016/j.humpath.2024.105637.
【前言】最近《Human Pathology》杂志发表了一篇文章,题为“12名亚洲儿童ALK阳性组织细胞增生症”。让我们来看看中国儿童ALK阳性组织细胞增生症临床病理学特征。
【临床资料】12例患儿,年龄3月-8岁2月,单系统累及7例、多系统累及5例。病例7因发热而发现右肺肿块。单系统疾病发生在皮肤的不同部位。5名多系统疾病的临床症状各不相同。病例8-11首发症状为背部肿块、行走不稳、发热和头面部红斑。病例12在2014年诊断,是唯一的死亡病例。其首发症状为发热,然后出现全血细胞减少症、肝肿大和睾丸肿块。7例单系统疾病患者中,最常见的治疗方法是手术切除;但患者6接受中医治疗,患者7接受靶向药物(阿来替尼,alectinib,一种ALK抑制剂)治疗,而不是手术切除。5例多系统疾病患者中,4例接受阿来替尼治疗;1例未接受任何治疗而死亡。患者8在治疗前后有临床相关特征,治疗前发现患者2×3cm的背部皮肤结节,渐增大,变暗。在接受阿来替尼靶向治疗后,结节消失,颜色变淡(图1)。患者10目前是唯一停药的病例(2024年4月停用阿来替尼)。随访3年2月未复发,仍在密切监测(表1)。
表1:ALK阳性组织细胞增生症12例临床特征总结

【组织形态学和免疫表型】 肿瘤由形态不一的组织细胞构成。肝穿病例肿瘤细胞灶状分布,周围血窦也充满了肿瘤细胞。深部软组织或器官有时可见大量淋巴细胞、中性粒细胞和嗜酸性粒细胞覆盖肿瘤细胞,容易漏诊。肿瘤细胞核呈规则折叠或分叶状,染色质细腻,核仁小。部分病例可以见到Touton和/或多核巨细胞。所有病例均表达ALK和CD68。S-100阳性表达8例(2/3),CD163阳性表达7例(7/12)。Ki-67增殖指数为5-20%。所有病例均阴性表达CD1a、Langerin、BRAF和GFAP。
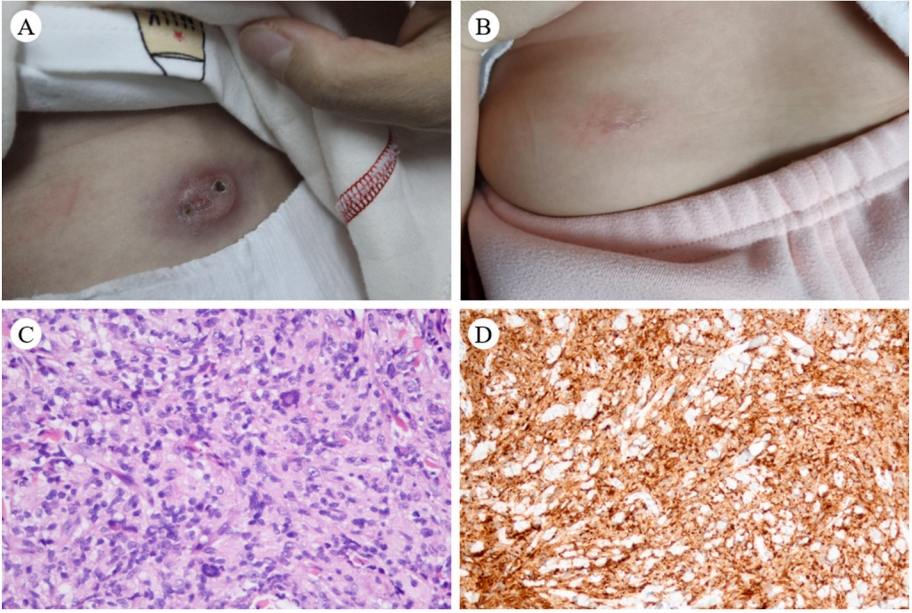 图1:A和B:阿来替尼治疗前后患者皮肤的变化治疗。C: 增生性肿瘤细胞小,核扭曲,轻度异型。D: ALK表达阳性。
图1:A和B:阿来替尼治疗前后患者皮肤的变化治疗。C: 增生性肿瘤细胞小,核扭曲,轻度异型。D: ALK表达阳性。
【讨论】自2008年以来,文献报道的ALK阳性组织细胞增生症病例不超过100例[5,7]。尽管纳入了儿童病例的研究,但大多数只是个案报道或病例较少。在此,我们对12例亚洲儿童病例进行了回顾性分析。ALK阳性组织细胞增生症发病机制和遗传变化尚未得到彻底研究。随着ALK阳性组织细胞增多症谱的扩大,公认的临床表现越来越多样化。文献报道发病年龄为0至41岁,最年轻的是一名仅7天大的女孩[8]。最初报道的病例表现为肝脾肿大、全系细胞减少和骨髓受累。成人肠道、骨髓、神经系统、肝脏、颅内和肺部也可能受到影响。也可能发生在女性乳腺、阑尾、肠系膜根部以及皮肤组织[5,9]。我们病例11病变位于睾丸,这是以前没有报道过的。本研究的系统性病变大多发生在1岁以下患者,而孤立性病变大多出现在1岁以上儿童。因此,在儿科病例中,尤其是在单系统诊断为ALK阳性组织细胞增生症的1岁以下患儿,对全身进行相关检查非常重要。ALK阳性组织细胞增生症也可能与慢性淋巴细胞白血病/小淋巴细胞淋巴瘤有关,在这两种疾病中都检测到了相同的免疫球蛋白重链基因重排[10,11]。
ALK阳性组织细胞增生症的肿瘤细胞可能富含嗜酸性细胞质或表现出不同的泡沫样。细胞核通常呈卵圆形,染色质致密,核折叠、深裂或分叶状,核仁小但模糊。随着疾病谱的扩大,越来越多的组织学特征被发现[11]。例如,可以观察到与Rosai-Dorfman病相似的多核Touton样细胞和吞噬作用。此外,观察到大量炎性细胞,包括淋巴细胞、浆细胞、嗜酸性粒细胞、肥大细胞和中性粒细胞,它们可以形成淋巴滤泡[10]。发生于乳腺的肿瘤细胞呈束状或带状,伴有反应性肌纤维母细胞[9]。本研究中的肠系膜病例,其特征是吻合毛细血管,增生的组织细胞增生延伸到大静脉。肿瘤细胞CD68和CD163阳性,部分病例S-100蛋白阳性,CD1a和Langerin阴性。ALK阳性组织细胞增生症不能仅根据形态学与其他组织细胞肿瘤区分开来。因此,ALK在免疫组织化学染色中的阳性具有重要意义。ALK蛋白在细胞质和/或细胞膜中表达,但在细胞核中不表达。然而,有些病例表现出弱的高尔基区表达[12]。ALK蛋白的弱表达也可能发生,这代表了一个需要警惕的“诊断陷阱”。因此,这些病例需要通过分子检测证实ALK重排。
ALK阳性组织细胞增生症中最常见的融合基因是KIF5B-ALK,罕见的配对基因如COL1A2、TRIM33、TPM3和EML4[3,4,16]。有趣的是,在迄今为止发现的77例病例中(65例以前报告的病例加上本研究报告的12例),只有6例是罕见的EML4-ALK融合,其中5例有肺部受累。最近一项研究在同一患者中检测到两个新的伴侣基因DCKN1-ALK和VRK2-ALK[5]。不同的基因融合可能导致局部ALK组织细胞增生症期间不同的组织学变化。例如,COL1A-ALK融合的肿瘤细胞表现出“嗜双色细胞质”,而携带KIF5B-ALK的肿瘤细胞则表现出“丰富的嗜酸性细胞质”。TRIM33-ALK阳性组织细胞增生症表现为巢状组织细胞增生[10]。此外,不同的基因融合可能支持不同的肿瘤发病机制。TRIM53是TRIM家族的成员,是参与单核/巨噬细胞介导的炎症反应的重要转录因子。它在组织细胞中表达,当与ALK融合时,促进肿瘤发生[17]。
儿童ALK阳性组织细胞增生症主要与朗格汉斯细胞组织细胞增生病(LCH)、幼年性黄色肉芽肿(JXG)和RDD疾病进行鉴别。LCH肿瘤细胞CD1a和Langerin阳性。有时在JXG中观察到ALK表达,但尚未检测到ALK重排[18]。JXG和RDD均不存在ALK基因改变[19]。此外,ALK阳性ALCL和炎性肌纤维母细胞肿瘤在儿童中很常见,表现出ALK蛋白表达和重排。然而,形态学分析和免疫组织化学染色有助于与ALK阳性组织细胞增生症的鉴别[9]。
ALK阳性组织细胞增生症的预后通常很好。总体而言,局部病变可以通过手术切除治愈,很少复发。多系统和多器官ALK阳性组织细胞增生症联合靶向治疗(ALK抑制剂阿来替尼)也取得了相当大的改善[4,5,8]。然而,短期内也可能发生快速疾病进展或复发,特别是对阿来替尼反应不佳的患者和患有与中枢神经系统(CNS)病变相关的多系统病变的幼儿,在这种情况下,预后不良和快速死亡是常见的[5]。在本研究中,尽管进行了手术、化疗、抗ALK和抗感染治疗,但颅内感染仍是ALK阳性组织细胞增生症患者死亡的原因。之前的一份报告还描述了一名患有中枢神经系统、肠道和骨髓侵袭的男孩病例,尽管接受了类固醇和化疗,他还是死于全身性疾病。并发症可能是死亡的重要原因[20]。值得注意的是,一名患有慢性淋巴细胞白血病/小淋巴细胞淋巴瘤并伴有ALK阳性组织细胞增生症的患者接受了伊布替尼治疗,随访4年未复发[21]。由于ALK阳性组织细胞增生症病例数量有限,关于ALK抑制剂应作为一线还是二线治疗仍存在争议。目前,对于最佳治疗方案和疗程尚未达成共识。















共0条评论