[导读] 编译:张波
摘要:纵隔生殖细胞肿瘤(MGCT)是最常见的性腺外生殖细胞肿瘤,好发于前纵隔,男性占比较高。MGCT也常见于Klinefelter综合征和伴有其他遗传疾病的患者。与其他性腺外部位的生殖细胞肿瘤(GCT)一样,MGCT是在胚胎发育过程中生殖细胞沿中线迁移时停滞在不当位置所产生。与睾丸中的GCT类似,MGCT可分为精原细胞性和非精原细胞性MGCT。精原细胞性肿瘤代表单纯性精原细胞瘤,而非精原细胞性肿瘤包括卵黄囊瘤、胚胎性癌、绒毛膜癌、成熟或未成熟畸胎瘤,以及混合型GCT(包含精原细胞瘤在内的任何GCT类型的组合)。体细胞型或血液系统恶性肿瘤也可与原发MGCT相关。分子研究方面,MGCT与其他部位的GCTS研究结果相同,最常见的是存在12p染色体获得和存在等臂染色体i(12p)。治疗方法包括新辅助化疗和手术切除残留肿瘤,对于良性畸胎瘤只需要手术切除而不需要化疗。本文重点阐述MGCT的病理、临床和分子特征的最新进展,并讨论每种肿瘤类型的免疫组织化学特征以及鉴别诊断等方面内容。
纵隔生殖细胞肿瘤(MGCT)占纵隔肿瘤的3%-24%。性腺外GCT是由于胚胎发生期间生殖细胞前体沿着中线的不适当迁移以及这些细胞在不适当位置(包括纵隔、腹膜后、颅骨和骶尾骨)停滞产生。纵隔是GCT最常见的性腺外部位,多发生在前纵隔,少部分发生在后纵隔。
广义上,MGCT分为精原细胞瘤性和非精原细胞瘤性。精原细胞瘤性MGCT,是指单纯性精原细胞瘤,而非精原细胞瘤性MGCT包括卵黄囊瘤(YST)、胚胎性癌、绒毛膜癌、畸胎瘤或混合型生殖细胞肿瘤。世界卫生组织(WHO)2015年MGCT分类还包括伴有体细胞型恶性肿瘤的MGCT和伴有相关血液恶性肿瘤的MGCT类别。
临床特征
流行病学
大多数MGCT以男性为主,男女比例为9:1.1。然而,良性畸胎瘤其性别分布男女比例大致相等;发生于儿童早期的MGCT,女童相对更常见。在一项研究中,51例纵隔精原细胞瘤性MGCT(发病年龄范围:18-65岁)和287例非精原细胞瘤性MGCT患者(发病年龄范围:14 - 51岁),平均为33岁。在儿科患者中,观察到MGCT发生存在2个峰值:其一为婴幼儿期,其二发生在10岁后。不同类型的MGCT也有不同的年龄倾向,青春期前患者中畸胎瘤和YST占主导地位,而其他MGCT类型几乎不存在;青春期后的男性中,精原细胞瘤和畸胎瘤各占MGCT病例的1/3,其余为混合型GCT、YST、胚胎性癌和绒毛膜癌。在青春期后女性中,畸胎瘤占MGCT病例的90%以上,其他类型MGCT发生率为1%-4%。
临床表现
MGCT可以在无症状患者中偶然发现,或由于纵隔肿块的生长而导致梗阻,出现各种症状和后遗症,常见症状包括胸痛、呼吸困难和咳嗽。MGCT也可能存在(按频率降序排列)伴发热、体重减轻、上腔静脉综合征、疲乏、颈部淋巴结肿大、咯血、声嘶或吞咽困难。 MGCT的个体病例还可发生心悸、心包填塞、复发性心包炎、心包积液、上腔静脉肿瘤血栓形成和弥漫性肺出血。儿童或新生儿患者发生的MGCT可能会出现需要紧急干预的严重症状,包括气道压迫、呼吸窘迫、心源性休克和心包积液。纵隔畸胎瘤特有的不太常见的症状包括毛咯血(咳出毛发)和由于畸胎瘤的胰腺内分泌成分引起的低血糖。MGCT患者常伴有Klinefelter综合征。值得一提的是,最近报告了1例MGCT患者最初怀疑患有COVID-19并出现呼吸道症状的病例。
影像学
MGCT的影像学表现因肿瘤类型而异。精原细胞瘤性MGCT通常较大,边缘清楚,在计算机断层扫描和磁共振成像扫描中显示均匀的内部衰减和信号强度,注射造影剂后显示轻微增强,在放射学上可能与淋巴瘤难以区分。非精原细胞瘤性MGCT较大且不均匀,边缘不规则,通常显示低密度。与前者不同的是,非精原细胞瘤性MGCT可显示侵犯邻近器官,并伴有周围脂肪平面消失。纵隔畸胎瘤显示为边界清楚、单房或多房囊性病变伴积液平面、软组织、脂肪变薄和各种形状的钙化,有时可见牙齿或骨组织影像。在磁共振成像上,纵隔畸胎瘤显示出不均匀的信号强度,代表其各种混合成分。畸胎瘤通常延伸至纵隔的另一侧,在对比增强图像上可以看到边缘增强壁。脂肪-积液平面是纵隔畸胎瘤的一个非常特异的影像学征象。在畸胎瘤破裂进入周围器官后,可观察到肺炎、胸腔积液或心包积液影像。氟脱氧葡萄糖正电子发射断层扫描/计算机断层扫描可用于检测治疗后残留的MGCT。这种成像方式可能对精原细胞瘤性MGCT比非精原细胞瘤性MGCT更有价值。
治疗及预后
目前MGCT的治疗依赖于新辅助化疗以及手术切除残余肿瘤。对于纯精原细胞瘤,可能需要增加放射治疗。单纯成熟良性畸胎瘤不需要化疗,可以通过完全手术切除治愈。用于MGCT的化疗药物包括博莱霉素、依托泊苷和顺铂。高剂量化疗和新型单药化疗药物由于效果不佳,已作为二线治疗。
血清肿瘤标志物,即甲胎蛋白(AFP)和β-人绒毛膜促性腺激素(hCG)在MGCT的诊断和治疗后监测中起关键作用。研究发现,纵隔肿块同时血清肿瘤标志物升高即可以考虑诊断MGCT,甚至可以取代病理活检。新辅助化疗和手术切除后血清肿瘤标志物持续升高表明肿瘤复发或切除不完全。值得注意的是,这些血清肿瘤标志物在单纯性畸胎瘤中不升高。此外,尽管β-hCG在单纯性畸胎瘤中可能升高,但AFP水平不升高。
虽然没有标准化的MGCT分期系统,但Moran和Suster 在1997年提出了基于肿瘤范围的分期系统。在该方案指出,I期包括局限于纵隔的肿瘤,II期包括显示浸润到邻近器官(即,胸膜、心包和大血管)的肿瘤,III期包括转移到胸内(IIIa)或胸外(IIIb)器官的肿瘤,该分期方案与MGCT患者的临床预后相关性良好。
与其他部位的GCT相比,MGCT的预后更差。15岁以上单纯性YST也具有相对良好的预后。与临床结局相关的其他因素包括年龄、肿瘤大小、转移部位数量、手术切除完整性、化疗后肿瘤完全坏死、治疗前肿瘤标志物高度升高等。
精原细胞瘤
大体特征
肿物外表光滑,有光泽分叶状,切面柔软,奶油色、白色至浅褐色结节,实性或囊实性,可含有坏死成分,肿瘤直径一般为数cm,最大为16cm。
组织形态学
纵隔精原细胞瘤组织学(图1A,B)与性腺精原细胞瘤相同。肿瘤呈片状或巢状排列,瘤细胞相对均匀,大,圆形至多边形,有透明的胞浆和圆形的细胞核,核仁突出。瘤细胞包膜清晰,分布均匀,无核重叠。通常存在薄的纤维血管间隔,形成分叶状外观。这些纤维血管间隔含有不同数量的淋巴细胞。肉芽肿反应经常可见,并且可能分布广泛并掩盖了肿瘤细胞(图1C、D)。其他组织学特征包括生发中心显著的淋巴组织增生、胸腺残留、合体滋养层细胞灶和囊性形态。在囊性形态的病例中,可能需要显微镜仔细观察和大量取样来判定囊性成分中的肿瘤细胞,否则可能被误诊为多房性胸腺囊肿。
免疫组织化学
免疫组化显示,原发性纵隔精原细胞瘤通常显示出与睾丸对应肿瘤相似的染色模式。 OCT 3/4、SALL 4、c-kit、胎盘碱性磷酸酶(PRAP)、NANOG、UTF 1和波形蛋白在大多数病例中呈阳性。CD 30、CK 20、上皮膜抗原、glypican-3、AFP、SOX 2、GATA-3、PAX 8、S100、白细胞共同抗原、癌胚抗原均为阴性。值得注意的是,与睾丸精原细胞瘤相反,纵隔精原细胞瘤显示细胞角蛋白阳性的发生率增加,特别是低分子量细胞角蛋白CAM 5.2、细胞角蛋白7、高分子量细胞角蛋白和AE 1/AE 3也可在纵隔精原细胞瘤中呈阳性。肿瘤抑制蛋白p53在13例纵隔精原细胞瘤中的4例(31%)和13例睾丸精原细胞瘤中的10例(77%)中呈阳性。D2-40在大多数性腺外精原细胞瘤中呈阳性,包括纵隔病例。最近研究的干细胞标记物TCL1在一项研究中几乎没有阳性病例(1/32),在另一项研究中全部为阳性(9/9)。另一项最近研究的性腺外GCT标记物LIN28在所有(9/9)纵隔病例中均为阳性。
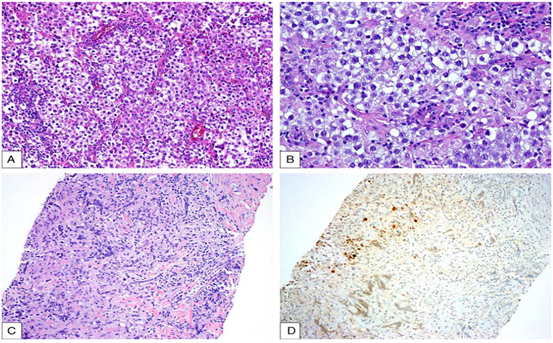
图1.精原细胞瘤。A,典型的精原细胞瘤组织学表现为均匀的圆形至多边形细胞巢,胞质淡染至透明,穿插有含淋巴细胞的纤维带.B,精原细胞瘤高倍镜下,肿瘤细胞分布均匀,细胞边界清楚,细胞核无重叠.C,纵隔精原细胞瘤的活检,其中致密的肉芽肿性炎症使精原细胞瘤细胞模糊.D,活检中可见散在的瘤细胞OCT 3/4核染色阳性.
分子遗传学
与其他不同部位的GCT一样,纵隔精原细胞瘤经常发生染色体12 p异常。在1项研究中,23例纵隔精原细胞瘤中有22例(96%)显示12 p染色体异常,包括20例12 p扩增和15例存在等臂染色体i(12 p)。在另一项研究中, KIT外显子17位点在8例纵隔精原细胞瘤中的4例中发现了点突变,并且与在肥大细胞增多症和性腺原发性肿瘤中检测到的KIT突变不同。KRAS密码子13突变的频率在纵隔精原细胞瘤(1/13)和原发性睾丸精原细胞瘤(2/13)中相似。还检测到DNA倍数改变,大多数纵隔精原细胞瘤中存在非整倍体DNA含量。
鉴别诊断
纵隔精原细胞瘤的鉴别诊断包括其他可能发生在纵隔的肿瘤,包括胸腺瘤、胸腺癌、纵隔B细胞淋巴瘤和转移性黑色素瘤。免疫组织化学染色可以区分精原细胞瘤和其他肿瘤,因为其他肿瘤GCT标记为阴性。一个重要的鉴别诊断是来自睾丸的转移性精原细胞瘤,其形态学和免疫组化染色几乎相同。因此,临床病史、体格检查和影像学检查以排除原发性睾丸精原细胞瘤是必要的。其他MGCT,如YST,胚胎性癌和绒毛膜癌,可以根据形态学和免疫组化与其区分。
卵黄囊瘤
大体特征
纵隔YST表现为实性或囊性形态,切面柔软、浅灰色或灰白色,呈胶冻样或粘液状。较大肿瘤和接受新辅助治疗的肿瘤通常表现为出血和坏死。囊肿形成可能与治疗有关或表明存在其他GCT成分。
组织形态学
纵隔YST与性腺中常见的YST一样,表现出多种组织学模式(图2),与其他解剖部位的YST无法区分。
微囊或网状结构的特点是细胞扁平或立方,胞浆稀少,排列成网状的囊腔和通道。黏液瘤样生长模式由黏液样间质细胞组成。内胚窦型显示乳头状结构和Schiller-Duval小体。管泡样结构显示由腺泡状、腺管状或较大囊性腔隙衬覆着扁平或立方上皮细胞,排列在致密的纤维间质中。实性模式显示细胞实性片状,细胞质淡染至透明,通常丰富,多形性最少。肝样模式(即细胞质丰富,类似肝细胞)在1例研究中被描述为纵隔YST中与其他模式混合存在,在另一个病例中为单纯形式。3例纵隔YST报道伴明显梭形细胞形态。还可能遇到的其他模式包括肠型(腺体类似于人胎肠),以及子宫内膜样型(腺体类似于分泌性子宫内膜)。在纵隔YST中经常可以看到胞浆内或细胞外PAS阳性透明小球。具有广泛基底膜沉积的YST被称为壁型YST。
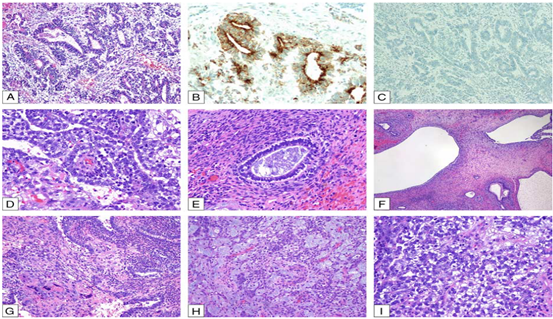
图2.卵黄囊瘤(YST)。A,腺体形态.B,Glypican-3阳性和C,OCT 3/4阴性YST细胞.D,YST内胚窦型伴Schiller-Duval小体.E,YST腺具有核下空泡,类似子宫内膜.F,大囊YST形态.G,YST伴散在的合体滋养层细胞(左下).H,黏液样YST.I,实性YST形态.
免疫组织化学
最近对14例原发性纵隔YST 的研究显示CAM 5.2(14/14)、SALL 4(14/14)、glypican-3(10/14)(图2B)和AFP(10/14)为阳性;OCT 3/4(0/14)(图2C)、CD 30(1/14)和c-kit(3/14)为阳性;PLAP(5/14)、GATA-3(5/14)、CDX 2(4/14)为阳性。这项研究和其他研究强调,没有一个单一的免疫组化是YST100%可靠的诊断标记物,因为个别标记物在其他GCT或体细胞恶性肿瘤中均可能是阳性的,这些肿瘤经常作为YST的鉴别诊断。因此,在大多数情况下,需要一组免疫染色抗体才最适合诊断YST。纵隔YST的免疫染色表达情况与睾丸YST的几乎相同。
其他最近研究的标志物可能为YST提供更大程度的敏感性和特异性。HNF 1 β在49例YST中呈阳性,其中包括2例纵隔纯YST,在该研究中,所有的胚胎性癌和精原细胞瘤均为阴性。ZBTB 16是另一种潜在的高度敏感性和特异性的YST标记物,在YST中始终呈阳性,包括1例纵隔YST,但在所有其他非YST GCT中呈阴性。LIN28,在原发性性腺外GCT中检测,包括10个纵隔YST(4个纯YST和6个与其他成分混合的YST),在性腺外YST中比SALL 4敏感。
分子遗传学
纵隔的YST显示出与其他部位相同的分子改变。YST与其他不同部位的GCT一样,频繁显示等臂染色体i(12 p)。较小比例的病例显示21号染色体和X获得,13号染色体缺失。8岁以下儿童的YST显示出不同的遗传特征,包括1p、4q和6q缺失,1q、3、20 q和20号染色体获得。对30例不同部位的YST(包括1例纵隔YST)进行了DNA倍性分析,结果显示非整倍体发生率较高。
鉴别诊断
由于YST有许多不同的形态学模式,纵隔YST的鉴别诊断广泛。重要的考虑因素包括来自胃肠道的转移癌,其可能类似于腺型YST和转移性肝细胞癌,后者可能类似于肝样型YST。典型的YST区域和临床病史有助于鉴别YST和转移癌。原发性胸腺癌也可能与纵隔YST相混淆,但胸腺癌中CD 5常为阳性,而纵隔YST中为阴性。精原细胞瘤可能类似于YST的实性模式,但前者通常为OCT 3/4、c-kit和D2-40阳性,glypican-3阴性。胚胎性癌可能与YST具有相似的结构特征,然而,胚胎性癌细胞通常比YST显示更大程度的多形性和异型性,并且更频繁地表达CD 30和OCT 3/4。混合型GCT,其中可能包括YST和其他GCT成分,充分的取材和仔细显微镜下观察肿瘤切片可以鉴别。具有梭形形态的YST可能类似于肉瘤,但后者不具有任何常规的YST区域,并且对角蛋白染色为阴性而间充质标记物染色为阳性。具有明显囊性改变的YST可能类似于多房胸腺囊肿,但充分取才和仔细显微镜观察将发现YST细胞,这在多房胸腺囊肿中是不存在的。与其他GCT一样,YST可能含有局灶性合体滋养层细胞,不应过度解释为绒毛膜癌(图2G)。
胚胎性癌
大体特征
胚胎性癌通常肿瘤较大,具有侵袭性或浸润性外观,棕褐色-白色-灰色或粉红色,柔软或肉质的切面,可能有坏死或出血区域,囊性区域可能表明存在其他GCT成分。
组织形态学
从组织学上看,纵隔中的胚胎性癌类似于性腺原发性肿瘤。胚胎性癌最常见伴发于YST或其他GCT成分,而以单纯形式发生的频率较低。胚胎性癌表现为实性、腺体或乳头状生长模式(图3A-C)。细胞明显异型性和多形性(图3D),具有中度嗜酸性细胞质和圆形核,核内含有突出和不规则的核仁。细胞边界不明显,细胞核经常重叠。核分裂丰富,出血和肿瘤坏死经常广泛存在。目前已经描述了具有肝样形态和脱-γ-羧基凝血酶原(PIVKA-II)产生的原发性纵隔胚胎性癌。由于出血和坏死区域经常含有高级别GCT成分,如胚胎性癌、YST和绒毛膜癌,这些区域应多取样并仔细进行显微镜检查。
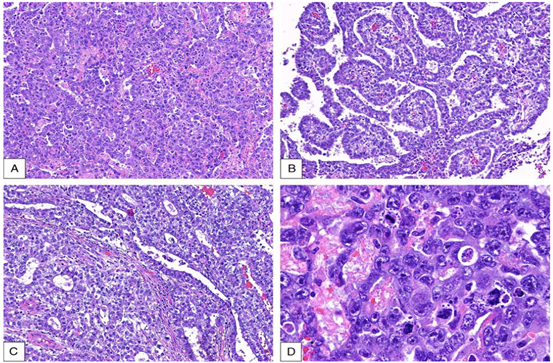
图3.胚胎性癌。实性(A)、乳头状(B)和腺体结构(C).D,胚胎性癌细胞,核异型性,核仁突出,核重叠,有几个核分裂象。
免疫组织化学
纵隔胚胎性癌常呈低分子量角蛋白、CD 30、SOX 2、OCT 3/4、SALL 4、NANOG、c-kit、PLAP和AP-2γ阳性。阴性或不常见的阳性染色包括CEA、D2-40、EMA和波形蛋白。可能观察到AFP免疫反应阳性,但与YST不同,染色不会呈强阳性。
分子遗传学
由于相对罕见性,纵隔胚胎性癌的分子特征的研究报道并不多。与其他部位的GCT一样,等臂染色体i(12p)是存在的。研究发现,1例Klinefelter综合征患者发生纵隔胚胎性癌,核型为(47,XXY)并伴有其他额外染色体。
鉴别诊断
胚胎性癌应与其他类型的GCT区分开来。精原细胞瘤通常很容易根据其特征性的形态学与胚胎性癌相鉴别。精原细胞瘤的细胞学特征是细胞浸润少,细胞边界清楚,肿瘤细胞分布均匀,无核重叠,CD30阴性。YST的许多组织学类型可能更接近于胚胎性癌,甚至在儿童纵隔胚胎性癌病例中也可观察到细胞内和细胞外PAS染色阳性透明小球,这通常是YST的典型特征。值得注意的是,胚胎性癌仍可能显示更大程度的细胞学异常,可见类似绒毛膜癌的大合体细胞。胚胎性癌巢周围的退行性改变的镶嵌图案也可能类似于绒毛膜癌。胸腺癌或其他转移性高级别癌可能具有类似于胚胎性癌的细胞学特征,但仔细注意临床病史和适当的免疫组化组合选择将有助于正确鉴别诊断。转移性胚胎性癌到纵隔也应考虑,要借助临床检查和影像学研究排查。混合型GCT应与纯胚胎性癌相鉴别,后者需要对肿瘤进行充分取材。淋巴源性恶性肿瘤,特别是间变性大细胞淋巴瘤,可能要与纵隔胚胎性癌进行鉴别诊断。在这种情况下,需要仔细识别上皮样组织结构(例如,实性、腺体或乳头状形态),并需要谨慎解释CD30和EMA阳性,因为胚胎性癌和间变性大细胞淋巴瘤对这些标志物都可能呈阳性。
——未完待续——
点此下载原文献
















共0条评论